Основные понятия термодинамики
 Скачать 279.3 Kb. Скачать 279.3 Kb.
|
|
1) Основные понятия термодинамики Термодина́мика— раздел физики, изучающий соотношения и превращения теплоты и других форм энергии. В отдельные дисциплины выделились химическая термодинамика, изучающая физико-химические превращения, связанные с выделением или поглощением тепла, а также теплотехника. Термодинамической системой называется тело или группа тел,отделённые от окружающей среды реальной или воображаемой поверхностью раздела. Если между частями системы не существует физических границ границ раздела ,то такие системы называются гомогенными (водный раствор поваренной соли),для гетерогенных сисетм характерно наличие границ (вода с плавающими в ней кусочками льда).С Состояние термодинамической системы определяется совокупностью её физических и химических свойств,характеризующихся экстенсивными и интенсивными параметрами. Состояния системы: -равновесное(свойства постоянны,нет потоков веществ и энергии) -термодинамически обратимое(равновесны все промежуточные стадии) -стандартное. Интенсивные параметры(зависящие от кол-ва вещества в системе- масса объем энергия) Экстенсивные параметры(не зависящие от кол-ва- температура давление плотность). Внутренняя энергия-энергия системы,слагающаяся из энергии кинетического движения,составляющих ее частицы и энергии потенциальной при таком движении.Работа-упорядоченная форма передачи энергии,с изменением параметров состояния системы.Теплота-неупорядоченная форма пердачи. Типы систем: -изолированная(не обменивается ни Е ни m) -закрытая(обмнивается только Е пример ампула) -открытая(обмен и тем и другим пример живая клетка) Процессы: -изотермические(Т постоянная) -изобарные(Р постоянно) -изохорные(v постоянно). Вопрос 2 Первый закон термодинамики: приращение внутренней Е сис-мы в некотором процессе = теплоте полученное сис-мой + работаW , совершенная над системой в этом процессе. Дельта E=Q+W.Q обычно отдается в биологич. Системах, поэтому удобно польз. Этой.ф-лой –дельта Е=-Q-W. Е не создается и не уничтож. Возможны лишь ее переходы из одного вида в другой в строго эквивалентных кол-вах. Внутренняя Е: функция состояния, приращение которой= теплотеQ полученной сис-мой в изохорном процессе. Тепловой эффект: кол-во теплоты, выделяемой или поглощаемой реагирующей сис-мой. Тепловой эффект=изменению внутренней Е сис-мы при изохорном процессе и изменению энтальпии при изобарном. Энтальпия: функция состояния, приращение которой = теплотеQ, полученное сис-мой в изобарном процессе. дельта Н=дельтаЕ+р*дельтаV . дельтаН сгор характериз ищменения энтальпии происходящее при сгорании 1 моль вещ-ва. Закон Гесса: теплота хим р-ции, протекающей при р или V=const определяется только природой исходных в-в и продуктов р-ции и не зависит от числа и последовательности промежуточных стадий при условии, что теплоты измерены при одинаковых t. 1)теплота образования в-ва=теплоте его разложения, взятой с обратным знаком. 2)энтальпия образования=разности сумм энтальпий образования продукта р-ции и исходных в-в 3)энтальпия сгорания=разности сумм энтальпий сгорания исходных в-в и продуктов р-ции. Термохимическое ур-е: ур-е реакции для которой указываются соответств. этой реакции дельтаЕ и дельтаН или какой либо др. функции состоян В биологических системах термодинамически невыгодные (эндергонические) реакции могут протекать лишь за счёт энергии экзергонических реакций. Экзергонический процесс это самопроизв. протекающ. процесс сопровожд уменьш свободной энергии системы(наприм. Катаболизм) Анаболизм это эндергонический процесс.-Экзергон. процесс передают свободную энергию для осуществл эндеогонич проц-такие как синтез, неспецифич и специфич эффекты возбуждения.В живых кл главным высокоэнергет продуктом явл АТФ. 3.Второе начало термодинамики …. Второй закон термодинамики определяет движущую силу самопроизвольно совершающихся в природе процессов, в точности хим. реакций путем рассмотрения еще одной функции состояния энтропии (S). Самопроизвольный процесс, проходящий без изменения энергетического запаса системы, совершается только в направлении, при котором система приходит в более вероятное состояние. Мерой вероятности данного состояния вещества или системы является термодинамическая функция состояния системы – энтропия (S). Она характеризует меру беспорядка. 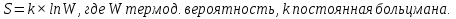 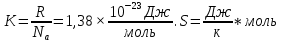 . . 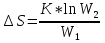 . Самопроизвольный процесс . Самопроизвольный процесс 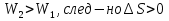 (для изолированных систем). Второй закон термодинамики: В изолированных системах самопроизвольно могут совершаться только такие процессы, при которых энтропия системы возрастает, энергия Гиббса уменьшается.. Энтропию можно рассчитать. Изменение энтропии подчиняется закону Гесса. (для изолированных систем). Второй закон термодинамики: В изолированных системах самопроизвольно могут совершаться только такие процессы, при которых энтропия системы возрастает, энергия Гиббса уменьшается.. Энтропию можно рассчитать. Изменение энтропии подчиняется закону Гесса. 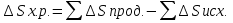 Процесс называется термодинамически обратимым, если при переходе из начального состояния в конечное все промежуточные состояния оказываются равновесными. Процесс называется термодинамически необратимым, если хоть одно из промежуточных состояний неравновесно. Стандартная эн Гиббса ΔG = ΔH – T ΔS (G, кДж). Изолированная сис-ма: не обменивается со средой ни в-вом, ни Е. Закрытая сис-ма: не обменивается в-вом, но может обмениваться Е. Пусть ΔН < 0 (экзотермический процесс), а ТΔS > 0.Тогда из формулы ΔG =ΔН – ТΔS видно, что ΔG < 0 и процесс протекает самопроизвольно.2). ΔН> 0 (эндотермический процесс), ТΔS < 0 и тогда ΔG > 0. В этом случае самопроизвольный процесс не протекает, но может протекать при затрате энергии из окружающей среды.3) ΔН = ТΔS и тогда ΔG = 0. Наступает термодинамическое равновесие в системе.4) ΔН < 0 и ТΔS < 0, ΔН > 0 и ТΔS > 0. В этом случае значение ΔG зависит от того, какая из величин больше: ΔН или ТΔS.Если ТΔS >> ΔН, то ΔG < 0; если ТΔS << ΔН, то ΔG < 0. Процесс называется термодинамически обратимым, если при переходе из начального состояния в конечное все промежуточные состояния оказываются равновесными. Процесс называется термодинамически необратимым, если хоть одно из промежуточных состояний неравновесно. Стандартная эн Гиббса ΔG = ΔH – T ΔS (G, кДж). Изолированная сис-ма: не обменивается со средой ни в-вом, ни Е. Закрытая сис-ма: не обменивается в-вом, но может обмениваться Е. Пусть ΔН < 0 (экзотермический процесс), а ТΔS > 0.Тогда из формулы ΔG =ΔН – ТΔS видно, что ΔG < 0 и процесс протекает самопроизвольно.2). ΔН> 0 (эндотермический процесс), ТΔS < 0 и тогда ΔG > 0. В этом случае самопроизвольный процесс не протекает, но может протекать при затрате энергии из окружающей среды.3) ΔН = ТΔS и тогда ΔG = 0. Наступает термодинамическое равновесие в системе.4) ΔН < 0 и ТΔS < 0, ΔН > 0 и ТΔS > 0. В этом случае значение ΔG зависит от того, какая из величин больше: ΔН или ТΔS.Если ТΔS >> ΔН, то ΔG < 0; если ТΔS << ΔН, то ΔG < 0. 4) а)ХИМИЧЕСКОЕ РАВНОВЕСИЕ – состояние химической системы, при котором возможны реакции, идущие с равными скоростями в противоположных направлениях. При химическом равновесии концентрации реагентов, температура и другие параметры системы не изменяются со временем. б)Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например: 3H2 + N2 ? 2NH3.* Направление обратимых реакций зависит от концентраций веществ — участников реакции. Так в приведённой реакции, при малой концентрации аммиака в газовой смеси и больших концентрациях азота и водорода происходит образование аммиака; напротив, при большой концентрации аммиака он разлагается, реакция идёт в обратном направлении. По завершении обратимой реакции, т. е. при достижении химического равновесия, система содержит как исходные вещества, так и продукты реакции.* Простая (одностадийная) обратимая реакция состоит из двух происходящих одновременно элементарных реакций, которые отличаются одна от другой лишь направлением химического превращения. * Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложение взрывчатых веществ, горение углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ. Ba(ClO2)2 + H2SO4 > 2HClO2 + BaSO4v NaHCO3 + CH3COOH > CH3COONa + H2O + CO2^ Однако надо понимать, что при изменении условий протекания реакции, теоретически возможно сместить равновесие любой реакции. в) Условия равновесия в процессах переноса теплоты определяют измерениями температур соприкасающихся фаз. Механическое равновесие обнаруживают по равенству непосредственно измеренных давлений в соприкасающихся фазах. Процесс перехода массы из одной фазы в другую в изолированной замкнутой системе, состоящей из двух или большего числа фаз, возникает самопроизвольно и протекает до тех пор, пока между фазами при данных условиях (температуре и давлении) установится подвижное фазовое равновесие. Оно характеризуется тем, что в единицу времени из первой фазы во вторую переходит столько же молекул компонента, сколько из второй в первую. Достигнув состояния равновесия, система может находиться в нем без количественных и качественных изменений сколь угодно долго, пока какое-либо внешнее воздействие не выведет ее из этого состояния. г)Константа химического равновесия — характеристика химической реакции, по значению которой можно судить о направлении процесса при исходном соотношении концентраций реагирующих веществ, о максимально возможном выходе продукта реакции при тех или иных условиях. Константа химического равновесия определяется по закону действующих масс. Ее значения находят расчетно или на основании экспериментальных данных. Константа химического равновесия зависит от природы реагентов и от температуры. д)Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Факторы влияющие на химическое равновесие:1) температура При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции. CaCO3=CaO+CO2 -Q t↑ →, t↓ ← N2+3H2↔2NH3 +Q t↑ ←, t↓ → 2) давление При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся. CaCO3=CaO+CO2 P↑ ←, P↓ → 1моль=1моль+1моль 3) концентрация исходных веществ и продуктов реакции При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при понижении концентрации продуктов реакции-в сторону исходных веществ. S2+2O2=2SO2 [S],[O]↑ →, [SO2]↑ ← Катализаторы не влияют на смещение химического равновесия! 5. Предмет и основные понятия химической кинетики. Химическая кинетика как основа для изучения скоростей и механизмов биохимических процессов. Скорость реакции. Классификация реакций, применяющиеся в кинетике: Реакции гомогенные, гетерогенные; реакции простые и сложные. Молекулярность реакции. Кинетические уравнения. Порядок реакции. Период полупревращения. Кинетика изучает скорость химической реакции, ее зависимость от различных факторов и механизмы реакций. Изучение cкорости и механизмов химических процессов – предмет химической кинетики. К основным понятиям, на которых строится теория химических реакций и химическая кинетика, относятся такие понятия, как механизм или схема химической реакции, гомогенность и гетерогенность, гомофазность и гетерофазность химической реакции и реакционного процесса в целом, а также понятия открытой и замкнутой системы Важнейшей количественной характеристикой протекания химической реакции во времени является скорость реакции. Понятие скорости реакции характеризует количество вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени. Для гомофазного химического процесса, идущего при постоянном объеме, скоростью процесса по некоторому компоненту называется изменение концентрации этого компонента в единицу времени. Если же в процессе реакции происходит изменение объема реагирующей системы, то концентрация вещества оказывается связанной в этом случае не только с числом актов химического превращения, но и с тем, по какому закону изменяется объем системы. В общем случае это изменение может осуществляться произвольным образом. Понятие кинетического уравнения, то есть уравнения, описывающего зависимость скорости химического процесса от концентрации компонентов реакционной смеси. Для подавляющего большинства химических процессов скорость реакции может быть представлена в виде произведения концентрации реагентов в соответствующих степенях, называемых порядком реакции по соответствующему веществу. Еще одним из важнейших понятий химической кинетики является понятие энергии активации, которая характеризует температурную зависимость скорости химической реакции в соответствии с законом Аррениуса. Гомогенность и гетерогенность реакции. Определяется по агрегатному состоянию реагентов в (одной фазе и в разных фазах) Скорость реакции - изменение концентрации вещества в единицу времени. Ʊ=∆с/∆t. Истинная скорость - положительна . Ʊист=dс/dt Химическое равновесие - когда скорости прямой и обратной реакций сравниваются. Классификация реакций: 1)по механизму: Простые- осуществляется посредством однотипных элементарных актов. Сложные- разнотипные элементарные акты 2) по агрегатному состоянию: Гомогенные-все исходные вещ-ва в одной фазе, реакция идет по всему объему смеси Гетерогенные - исх. вещ-ва в разных фазах, важна площадь соприкосновения реагирующих вещ-в. Молекулярность реакции - число молекул, учавствующих в простой реакции. Кинетические уравнения: -первого порядка, V=kc (k-константа скорости реакции) -второго порядка, V=kc2 Порядок реакции- сумма показателей степеней концентраций реагирующих вещ-в. Период полупревращений- промежуток времени, в течении которого начальное кол-во реагента или его концентрация уменьшаются в 2 раза. T1/2=ln2/k Порядок реакции показывает, каким образом скорость реакции зависит от концентрации реагентов. Порядок кинетического уравнения может принимать значения 0,1,2 и 3; он может быть также дробным. Уравнения нулевого порядка:С0 – с1= kt ; C0-0.5 C0=kt0.5 ;T0.5= 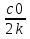 ; Где с0 – начальная концентрация реагента; ; Где с0 – начальная концентрация реагента;с1 – концентрация реагента в момент времени t; k – константа скорости реакции; T0.5 – период полураспада. Уравнения первого порядка: ln= 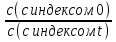 = - kt ; = - kt ;T0.5= 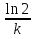 = =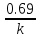 ; ;Где ct=0.5 c0 Уравнения второго порядка: 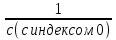 - - 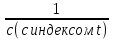 = kt; = kt;T0.5= 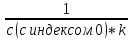 ; ;6) Зависимость скорости реакции от концентрации реагентов. Кинетическое уравнение реакций первого, второго и нулевого порядков. Скорость гомогенной хим. реакции определяется изменением концентрации реагирующих веществ (или продуктов реакции) в единицу времени. Скорость прямой реакции уменьшается по мере расходования исходных веществ, а скорость обратной реакции увеличивается по мере накопления продуктов реакции. Когда скорости прямой и обратной реакции сравняются, система перейдет в состояние химического равновесия.Истинная скорость в любой момент времени является только положительной величиной и определяется первой производной концентрации по времени 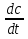 . Если измерение истинной скорости проводят по изменению концентрации исходных веществ, то перед производной ставят знак минус: V= - . Если измерение истинной скорости проводят по изменению концентрации исходных веществ, то перед производной ставят знак минус: V= - 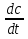 Средняя скорость: Vср = Средняя скорость: Vср =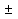 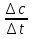 Зависимость скорости хим. реакции от концентрации описывается кинетическим уравнением. Порядок реакции показывает, каким образом скорость реакции зависит от концентрации реагентов. Порядок кинетического уравнения может принимать значения 0,1,2 и 3; он может быть также дробным. Уравнения нулевого порядка: С0 – с1= kt; C0-0.5 C0=kt0.5 ; T0.5= 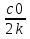 ; ;Где с0 – начальная концентрация реагента; с1 – концентрация реагента в момент времени t; k – константа скорости реакции; T0.5 – период полураспада. Уравнения первого порядка: ln= 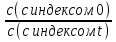 = - kt ; = - kt ;T0.5= 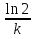 = =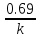 ; ;Где ct=0.5 c0 Уравнения второго порядка: 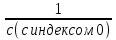 - - 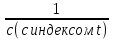 = kt; = kt;T0.5= 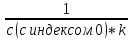 ; ;Закон действующий масс (Закон Гульберта и Вааге): скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степени их стехиометрических коэффициентов. Т.е. чем больше концентрация, тем больше скорость хим. реакции. 7. Зависимость скорости реакции от температуры. Температурный коэффициент реакции и его особенности для биохимических процессов. Понятие о теории активных соударений. Энергетический профиль реакции; энергия активации; уравнение Арениуса. Для большинства реакций справедливо правило Вант-Гоффа: Повышение температуры на 10К увеличивает скорость большинства реакций в 2-4 раза: |
