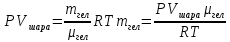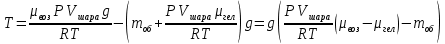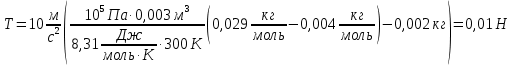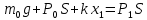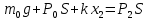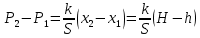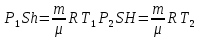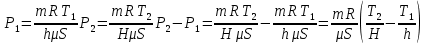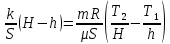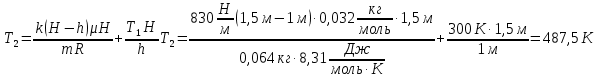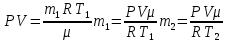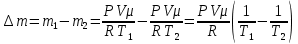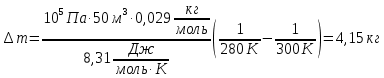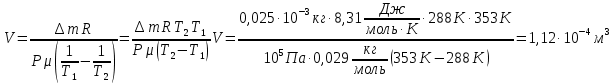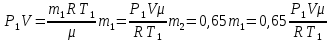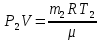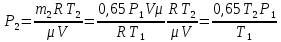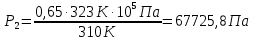|
|
Опорный конспект по решению задач. Основные теоретические сведения
В герметично закрытом сосуде находится 1 моль неона и 2 моля водорода. При температуре Т1=300К, когда весь водород молекулярный, атмосферное давление в сосуде Р1=105 Па. При температуре Т2=3000К давление возросло до Р2=1,5∙105 Па. Какая часть молекул водорода диссоциировала на атомы?
ν1=1 моль
ν2=2 моль
Т1 =300К
Т2 =3000К
Р1=105 Па
Р2=1,5∙105 Па
|
При температуре Т1 давление газа в сосуде складывается из парциальных давлений двух газов и равно:
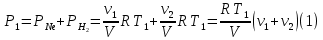
При температуре Т2 давление газа равно:
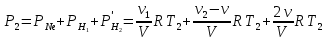
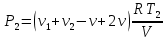
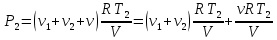
|
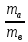
|
Из уравнения (1):
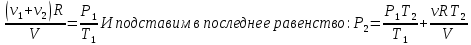
Из первого находим объем V:
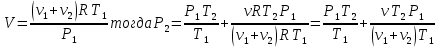
|
 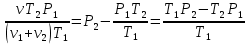
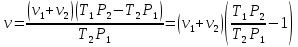 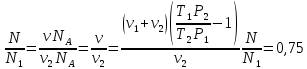
|
В закрытом баллоне находится смесь из m1= 0,50 г водорода и m2 = 8,0 г кислорода при давлении Р1= 2,35∙105 Па. Между газами происходит реакция с образованием водяного пара. Какое давление Р установится в баллоне после охлаждения до первоначальной температуры? Конденсации пара не происходит.
V = 25 л
μ1 = 2г/моль
m1 = 0,5 г
μ2 = 32г/моль
m2 = 8 г
|
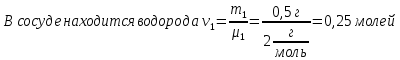
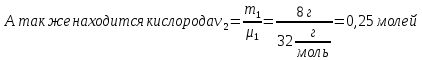
В сосуде будет происходить реакция водорода с кислородом с образованием воды:
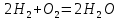
|
Р-?
|
Из уравнения реакции видно, что если в реакцию вступит весь водород, то кислорода только половина
|
В результате образуется ν3=0,25 молей водяного пара и останется ν4= 0,125молей кислорода.
По закону Дальтона результирующее давление в сосуде равно сумме парциальных давлений
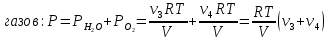
Так как известно, что до реакции давление в сосуде было Р1, то для этого момента можно так же применить закон Дальтона:
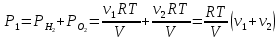
Решаем полученные уравнение в системе относительно неизвестного:
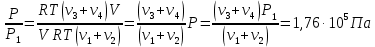
|
С добавлением законов механики.
На дне сосуда, заполненного воздухом, лежит шарик радиусом r и массой m. До какого давления надо сжать воздух в сосуде, чтобы шарик поднялся вверх. Температура воздуха Т известна.
m
r
Т
Т
|
З апишем уравнение динамики и уравнение Менделеева-Клапейрона. Решаем полученную систему уравнений относительно неизвестного: апишем уравнение динамики и уравнение Менделеева-Клапейрона. Решаем полученную систему уравнений относительно неизвестного:
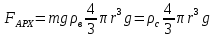
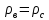
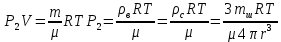
|
Р-?Р
Р-?
|
Тонкостенный резиновый шар массой 50г наполнен азотом и погружен в озеро на глубину 100 м. Найти массу азота, если шар находится в положении равновесия. Атмосферное давление 760мм. рт. ст. Температура воды в озере на глубине 100м равна 4°С.
mоб=50г
h=100м
Р=760мм.рт.ст.
t=4°С
μ=0,028кг/моль
|
0,05кг
105Па
Т=277К
|
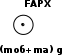
|
Запишем второй закон Ньютона в проекции на вертикальную ось.
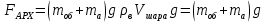
Объем шара равен объему азота в нем. Запишем уравнение Менделеева-Клапейрона для азота и выразим из него объем азота
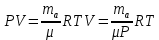
|
ma-?
|
Р-?
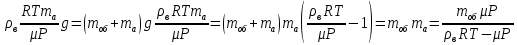 Давление азота на этой глубине равно давлению внешнему на шар, так как по условию оболочка шара не пульсирует. Следовательно: Давление азота на этой глубине равно давлению внешнему на шар, так как по условию оболочка шара не пульсирует. Следовательно:
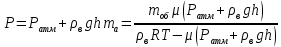
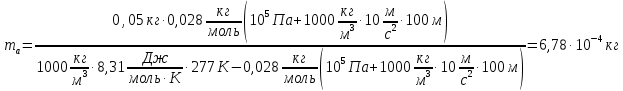
|
Н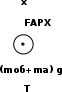 адувной шарик, заполненный гелием, удерживают на нити. Найдите натяжение нити, если масса оболочки шарика 2г, объем 3литра, давление гелия 105 Па, температура 27°С. Плотность воздуха 1,3 кг/м3 адувной шарик, заполненный гелием, удерживают на нити. Найдите натяжение нити, если масса оболочки шарика 2г, объем 3литра, давление гелия 105 Па, температура 27°С. Плотность воздуха 1,3 кг/м3
mоб=2г
Р=105Па
t=27°С
μгел=0,004кг/моль
Vшара=3л
μвоз=0,029 кг/моль
|
0,002кг
Т=300К
0,003м3
|
|
Запишем второй закон Ньютона в проекции на вертикальную ось х.
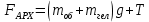
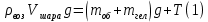
|
Т-?
|
Объем шара равен объему гелия в нем, а значит 3литра; Запишем уравнение Менделеева-Клапейрона для воздуха (среда, в которой находится шар), и введем в него плотность воздуха:
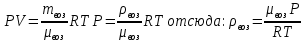
Тогда уравнение (1) принимает вид:
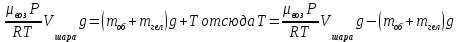 Теперь надо записать уравнение Менделеева-Клапейрона для гелия и выразить из него массу гелия. Надо учесть, что объем азота равен объему шара. А так же температура окружающего воздуха и температура гелия равны, как равны и давления воздуха и гелия. Теперь надо записать уравнение Менделеева-Клапейрона для гелия и выразить из него массу гелия. Надо учесть, что объем азота равен объему шара. А так же температура окружающего воздуха и температура гелия равны, как равны и давления воздуха и гелия.
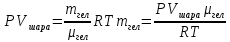
С учетом определенной массы гелия, сила натяжения равна:
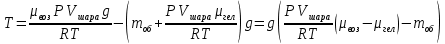
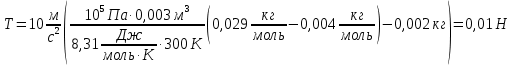
|
В вертикально расположенном цилиндре находится кислород массой m= 64 г, отделенный от атмосферы поршнем, который соединен с дном цилиндра пружиной жесткостью k = 830 H/м. При температуре T1= 300 К поршень располагается на расстоянии h = 1 м от дна цилиндра. До какой температуры T2 надо нагреть кислород, чтобы поршень расположился на высоте H = 1,5м от дна цилиндра? Универсальная газовая постоянная R= 8,31 Дж/(моль∙ К), молярная масса кислорода μ = 32 г/моль.
m=0,064кг
Т1=300К
h=1м
H=1,5м
k=830 Н/м
μ = 0,032 кг/моль
|
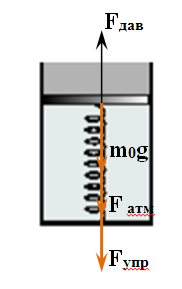 Поскольку в условии задачи не сказано, что поршень невесом, будем полагать, что он обладает некоторой массой, которую обозначим через m0. Ничего не говорится также про атмосферное давление, поэтому будем считать, что оно равно Р0 Таким образом, на поршень действуют в общем случае четыре силы: сила тяжести, сила упругости пружины, сила атмосферного давления, направленные вниз, и сила давления газа в цилиндре, направленная вверх. Условия равновесия поршня в начальном и конечном состояниях имеют вид: Поскольку в условии задачи не сказано, что поршень невесом, будем полагать, что он обладает некоторой массой, которую обозначим через m0. Ничего не говорится также про атмосферное давление, поэтому будем считать, что оно равно Р0 Таким образом, на поршень действуют в общем случае четыре силы: сила тяжести, сила упругости пружины, сила атмосферного давления, направленные вниз, и сила давления газа в цилиндре, направленная вверх. Условия равновесия поршня в начальном и конечном состояниях имеют вид:
|
Т2-?
|
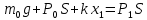
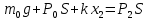
|
Здесь через Р1 и через Р2 обозначено давление газа в первом и во втором состояниях. Через х1 и х2 обозначена деформация пружины в двух состояниях.
Вычтем из второго уравнения первое уравнение:
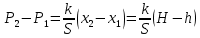
Запишем уравнение Менделеева-Клапейрона для двух состояний газа:
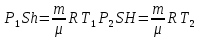
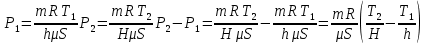
Приравняем разности давлений газа, найденные двумя способами:
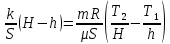
Из полученного уравнения находим Т2:
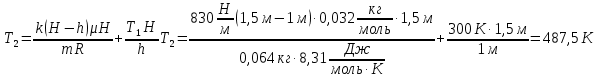
|
ВТОРОЙ ТИП ЗАДАЧ: ЕСТЬ ИЗМЕНЕНИЯ МАССЫ
Температуру воздуха в комнате подняли с t1 = 7 °С до t2 = 27 °С. Какая масса воздуха должна выйти из комнаты, чтобы давление осталось неизменным, Р = 105 Па? Объем воздуха в комнате V = 50 м3.
μ = 0,029кг/моль
t1 = 7°C
t2 = 27°C
Р =105 Па
V=50м3
|
Т1=280К
Т2=300К
|
Так как при нагревании все тела расширяются, а комната не герметична, следовательно, масса воздуха в комнате при нагревании уменьшается (есть утечка газа), но при этом, понятно, что объем газа не меняется и остается равным объему комнаты. Для каждого состояния газа запишем уравнение Менделеева-Клапейрона, и определим из них массу воздуха в комнате при разной температуре.
|
ρ-?
|
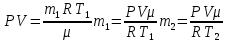
|
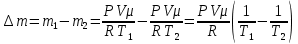
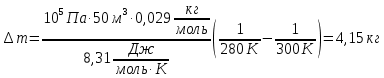
|
Стеклянная колба закрыта пробкой и взвешена при температуре t1 = 15 °С. Открыв пробку, колбу нагрели до температуры t2 = 80 °С. При следующем взвешивании масса колбы оказалась на m = 0,25 г меньше. Чему равен объем колбы?
μ = 0,029кг/моль
t1 = 15°C
t2 = 80°C
Р =105 Па
∆m=0,25 г
|
Т1=288К
Т2=353К
0,25∙10-3кг
|
Масса стеклянной колбы не меняется, меняется масса газа в ней, так как есть утечка: при нагревании все тела расширяются, а колба не герметична, следовательно, масса воздуха в ней при нагревании уменьшается, но при этом, понятно, что объем газа не меняется и остается равным объему колбы. Будем считать, что атмосферное давление нормальное.
Для каждого состояния газа запишем уравнение Менделеева-Клапейрона, и определим из них массу воздуха в колбе при разной температуре.
|
V -?
|
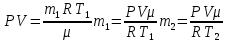
|
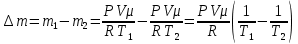
Выразим отсюда объем колбы:
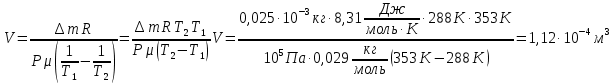
|
В баллоне емкостью V = 12 л находится азот массой m1 = 1,5 кг при температуре t1 = 37°С. Каким станет давление в баллоне при температуре t2 =50 °С, если выпустить 35% азота? Первоначальное давление считать нормальным.
μ = 0,028кг/моль
t1 = 37°C
t2 = 50°C
Р1 =105 Па
m2=0,65m1
|
Т1=310К
Т2=323К
|
Для каждого состояния газа запишем уравнение Менделеева-Клапейрона.
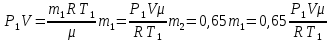
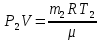
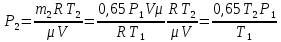
|
Р2 ?
|
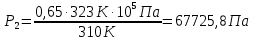
|
В сосуде объемом V = 1 л находится идеальный газ. В сосуде объемом V = 1 л находится идеальный газ. Сколько молекул газа нужно выпустить из сосуда, чтобы при понижении температуры в k=2 раза его давление уменьшилось в z =4 раза?
μ = 0,028кг/моль
t1 = 37°C
t2 = 50°C
Р1 =105 Па
m2=0,65m1
|
Т1=310К
Т2=323К
|
Для каждого состояния газа запишем уравнение Менделеева-Клапейрона.
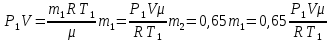
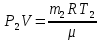
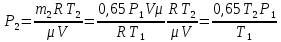
|
Р2 ?
|
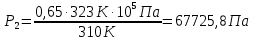
| |
|
|
 Скачать 170.12 Kb.
Скачать 170.12 Kb.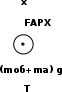 адувной шарик, заполненный гелием, удерживают на нити. Найдите натяжение нити, если масса оболочки шарика 2г, объем 3литра, давление гелия 105 Па, температура 27°С. Плотность воздуха 1,3 кг/м3
адувной шарик, заполненный гелием, удерживают на нити. Найдите натяжение нити, если масса оболочки шарика 2г, объем 3литра, давление гелия 105 Па, температура 27°С. Плотность воздуха 1,3 кг/м3
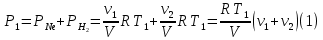
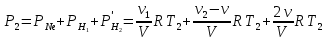
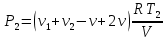
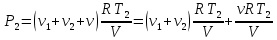
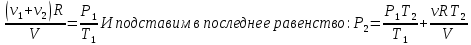
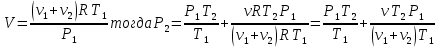

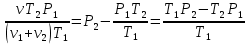
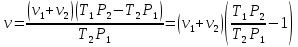
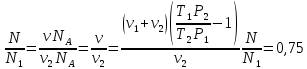
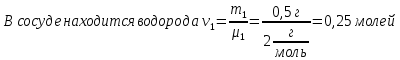
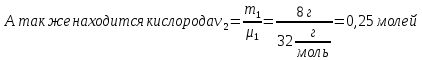
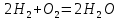
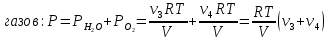
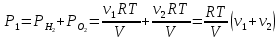
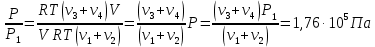
 апишем уравнение динамики и уравнение Менделеева-Клапейрона. Решаем полученную систему уравнений относительно неизвестного:
апишем уравнение динамики и уравнение Менделеева-Клапейрона. Решаем полученную систему уравнений относительно неизвестного: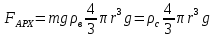
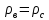
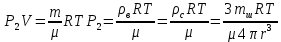
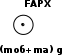
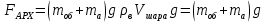
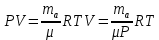
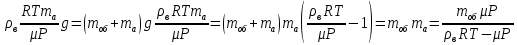 Давление азота на этой глубине равно давлению внешнему на шар, так как по условию оболочка шара не пульсирует. Следовательно:
Давление азота на этой глубине равно давлению внешнему на шар, так как по условию оболочка шара не пульсирует. Следовательно: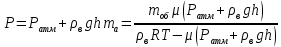
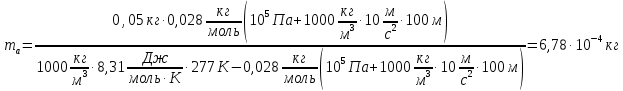
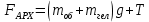
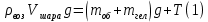
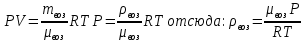
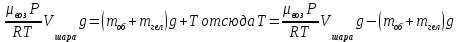 Теперь надо записать уравнение Менделеева-Клапейрона для гелия и выразить из него массу гелия. Надо учесть, что объем азота равен объему шара. А так же температура окружающего воздуха и температура гелия равны, как равны и давления воздуха и гелия.
Теперь надо записать уравнение Менделеева-Клапейрона для гелия и выразить из него массу гелия. Надо учесть, что объем азота равен объему шара. А так же температура окружающего воздуха и температура гелия равны, как равны и давления воздуха и гелия.