Методичка Химия. Отчет может быть оформлен либо в описательной форме, либо в форме таблицы на двух развернутых страницах Лабораторная работа
 Скачать 1.87 Mb. Скачать 1.87 Mb.
|
|
Схема записи гальванического элемента Для обозначения гальванического элемента используют символическую запись, упрощающую их описание. Например, элемент Даниэля-Якоби, может быть описан следующей краткой схемой ө   Zn| ZnSO4 | | CuSO4 | Cu Zn| ZnSO4 | | CuSO4 | Cu   C1 C2 C1 C2полуэлемент полуэлемент анод катод граница раздела обозначение «солевого мостика», металл-раствор т.е. полуэлементы пространственно (реакция идет разделены, электролиты соединяются на электроде) «солевым мостиком»
Коррозия металлов – это их самопроизвольное разрушение под воздействием окружающей среды. Причиной его является термодинамическая неустойчивость металла-восстановителя по отношению к окислителям, присутствующим в среде. Коррозию по механизму взаимодействия металла со средой подразделяют: а) на химическую; б) электрохимическую; в) биологическую; г) радиационную. Электрохимическая коррозия – это разрушение металла в среде электролита с возникновением внутри системы электрического тока. По механизму электрохимической коррозии протекает атмосферная, почвенная коррозии, коррозия природными речными, морскими водами, электрокоррозия блуждающими токами. Электрохимическая коррозия протекает, если между двумя участками металлической конструкции возникает «разность потенциалов». Причины возникновения разности потенциалов между разными участками металлической конструкции
Участки с меньшим значением окислительно-восстановительного потенциала называют анодными, с большим окислительно-восстановительным потенциалом – катодными участками. Рассмотрим механизм электрохимической коррозии на примере контакта двух разных металлов:  Среда электролита: H2O, O2 Среда электролита: H2O, O2активный неактивный металл (1) металл (2) Zn 2e Sn ө    Zn2+ OH–, H2↑   φ1 = –0,76 < φ2 = –0,14 анодный участок катодный участок Более активный металл характеризуется меньшим значением окислительно-восстановительного потенциала (φ1<φ2). Избыток электронов от активного металла – Zn (анодного участка) – переходит к неактивному металлу – Sn (катодному участку). Следовательно, на анодном участке с меньшим значением окислительно-восстановительного потенциала протекает реакция окисления активного металла. Анодная реакция (на участке с меньшим окислительно-восстановительным потенциалом) 1) Ме(1) – ne– → Men+(1) (p-p) активный металл Zn – 2e → Zn2+(p-p) Катионы активного металла – Меn+(1) или Zn2+ переходят в среду электролита, накапливаются у поверхности и раствор у анодного участка приобретает избыточный положительный заряд. Неактивный металл на катодном участке – Sn – выполняет роль металлического проводника. Электроны перемещаются к поверхности катодного участка металла, где протекает реакция восстановления окислителей, присутствующих в среде электролита. Наибольшее значение имеют окислители кислород – О2 и вода –Н2О (Н+). Катодные реакции (на участке с большим окислительно-восстановительным потенциалом) 2) восстановление H2O (H+) 2H2O + 2e– → H2 + 2OH–; (pH≥7) или 2H+ + 2e → H2; (pH<7) 3) восстановление О2 О2 + 2Н2О + 4е– → 4ОН–; (рН≥7) или О2 + 4Н+ + 4е → 2Н2О; (рН<7) Анодные и катодные реакции протекают одновременно. Суммарные уравнения процессов коррозии можно составить, суммируя уравнения 1) и 2) или 1) и 3) с учетом коэффициентов электронного баланса. I процесс (коррозия с водородной деполяризацией) 2Ме + 2nH2O → 2Men+ + nH2 + 2nOH– –ne +2e восстановитель окислитель Zn + 2H2O → Zn2+ + H2 + 2OH– Коррозия металла водой (Н2О или Н+) возможна, если II процесс (коррозия с кислородной деполяризацией) 4Me + nO2 + 2nH2O → 4Men+ + 4nOH– 2Zn + O2 + 2H2O → 2Zn2+ + 4OH– Коррозия металла кислородом (О2) возможна, если У поверхности катодного участка скапливаются анионы – ОН– или кислотные остатки и раствор приобретает избыточный отрицательный заряд. Следовательно, в среде электролита возникает разность потенциалов у поверхности анодного и катодного участков. В результате чего катионы Men+(1) (или Zn2+) и анионы – ОН– (или кислотные остатки) перемещаются навстречу друг другу. Таким образом, в системе направленно перемещаются заряженные частицы – электроны по металлу и ионы в среде электролита, т.е. возникает электрический ток. Совокупность анодного, катодного участков и электролита образуют коррозионный гальванический элемент, который описывает следующая краткая схема. А   нодный ө Активный Электролит Неактивный нодный ө Активный Электролит Неактивный участок металл (1) Н2О, О2, … металл (2) участок , и   ли: ө Zn H2O, O2 Sn ли: ө Zn H2O, O2 Sn В зависимости от свойств катионов активного металла и состава коррозионной среды могут протекать разнообразные вторичные процессы коррозии
Men+ + nOH– → Me(OH)n↓;
Например: 2Men+ + nS2- → Me2Sn↓ например: Fe3+ + PO43- → FePO4↓;
Men+ + mL лиганд Например: Zn2+ + 4NH3
Например 4Fe2+ + O2 + 2H2O → 4Fe3+ + 4OH–;
Например, «ржавчина» имеет сложный переменный состав x FeO ∙ y Fe2O3 ∙ z H2O;
9.4. Электролиз Электролиз – окислительно-восстановительный процесс, протекающий в среде электролита под воздействием электрического тока и сопровождающийся разрядом ионов на электродах. Электролиз – разложение электролита электрическим током. Процессы электролиза проводятся в электролитических ячейках (электролизерах). Электролитическая ячейка состоит из двух электродов, погруженных в расплавленную соль или водный раствор, как показано на рис. 8. Электрическую энергию получают от аккумуляторной батареи или от другого источника электрического тока. Каков бы ни был источник электрического тока, он играет роль «электронного насоса», нагнетающего электроны в один электрод и удаляющего их с другого электрода. При удалении электронов с электрода на нем создается положительный заряд, а при нагнетании электронов на электрод – отрицательный заряд. При электролизе расплавленного NaCl, схематически изображенном на рис. 8, ионы Na+ присоединяют электроны на отрицательном электроде и восстанавливаются. По мере уменьшения концентрации ионов Na+ вблизи этого электрода к нему диффундируют дополнительные ионы Na+. Точно так же происходит и перемещение ионов Cl– к положительному электроду, где они отдают электроны и окисляются. Как и в гальваническом элементе, электрод, на котором происходит восстановление, называется катодом, а электрод, на котором происходит окисление, называется анодом. В рассматриваемом случае в электролитической ячейке протекают следующие реакции 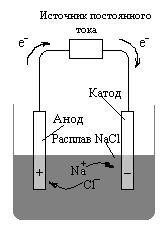 на аноде: 2Cl– (ж.) → Cl2(г.) + 2e– на катоде: 2Na+(ж.) + 2e– → 2Na(ж.) 2Na+(ж.) + 2Cl–(ж.) → 2Na(ж.) + Cl2(г.)  Рис. 8. Электролиз расплава хлорида натрия Потенциал разложения – минимальное напряжение, которое необходимо устанавливать, чтобы элетролиз шел с заметной скоростью. Величина потенциала разложения изменяется в интервале от 0,5 В (очистка меди) до 7 В (получение алюминия). Потенциал разложения пропорционален разности окислительно-восстановительных потенциалов окислителя и восстановителя, но всегда её превышает на величину потенциала перенапряжения (Uперен.) Uразл .= |φок. – φвос.| + Uперен. Uперен. = φперен. + φперен, , кат. ан. то есть на практике для проведения электролиза всегда требуется более высокое напряжение, чем вычисленное по электродным потенциалам. Это объясняется наличием внутреннего сопротивления электролизера, явлением концентрационной и электрохимической (перенапряжение) поляризации электродов. Особое значение приобретает электрохимическая поляризация, так как в результате выделения на инертных электродах продуктов электролиза меняется состояние поверхности электродов; в электролизере возникает гальванический элемент, ЭДС которого необходимо преодолеть. Перенапряжение – сложное по своей природе явление и зависит от многих факторов как внешних, так и внутренних материала электродов, характера их поверхности, плотности тока, температуры и других условий электролиза; природы продуктов электролиза, их агрегатных состояний. Металлы выделяются, как правило, с небольшим перенапряжением. Газообразные продукты характеризуются большим перенапряжением выделения при электролизе. Потенциал перенапряжения определяют экспериментально. Электролиз растворов солей В растворах солей, помимо гидратированных катионов и анионов электролита, присутствует растворитель – вода, которая может проявлять свойства окислителя за счет водорода в степени окисления +1 либо восстановителя за счет кислорода в степени окисления –2. Н2О – окислитель  2Н+ + 2е 2Н2О + 2е Окислительно-восстановительный потенциал «водородного электрода» зависит от рН рН=0 рН=7 рН=14 Н2О – восстановитель  2Н2О – 4е 4ОН– – 4е Окислительно-восстановительный потенциал «кислородного электрода» зависит от рН рН=0 рН=7 рН=14 Если в растворе электролита присутствует несколько возможных окислителей и несколько возможных восстановителей, осуществляется тот процесс, который характеризуется наименьшим потенциалом разложения. То есть на катоде восстанавливается окислитель с наибольшим суммарным значением окислительно-восстановительного потенциала и перенапряжения, а на аноде окисляется восстановитель с наименьшим суммарным значением окислительно-восстановительного потенциала и перенапряжения. Электролиз водного раствора иодида натрия В растворе осуществляются процессы диссоциации Иодид натрия гидролизу не подвергается, следовательно, среда в растворе нейтральная и рН=7. Положительно заряженные ионы перемещаются к отрицательно заряженному электроду – катоду. Возможные окислители (Na+ и H+) характеризуются следующими значениями окислительно-восстановительных потенциалов Следовательно, более сильным окислителем является ион Н+ и на катоде осуществляется процесс восстановления воды до молекулярного водорода к  атодная 2H2O + 2e → H2 + 2OH– 1 атодная 2H2O + 2e → H2 + 2OH– 1реакция Отрицательно заряженные ионы перемещаются к положительно заряженному электроду-аноду. Сравним значения окислительно-восстановительных потенциалов возможных восстановителей (I– и OH–) Более сильным восстановителем является иодид-ион и на аноде осуществляется процесс окисления I––ионов до I2:
Составим суммарное уравнение реакции, объединив уравнения катодной и анодной реакций с учетом коэффициентов электронного баланса 2H2O + 2I– 2H2O + 2KI |
