Методичка Химия. Отчет может быть оформлен либо в описательной форме, либо в форме таблицы на двух развернутых страницах Лабораторная работа
 Скачать 1.87 Mb. Скачать 1.87 Mb.
|
|
7.3. Лабораторная работа № 3 Получение и химические свойства средних, кислых и основных солей Опыт 1. Получение и свойства кислой соли – гидрокарбоната кальция Налить в пробирку раствор гидроксида кальция. Пропустить диоксид углерода из аппарата Киппа (рис.4), полностью погрузив конец отводной трубки в пробирку с раствором гидроксида кальция. Наблюдать вначале образование осадка средней соли, а затем его растворение вследствие образования кислой соли. К полученному раствору гидрокарбоната кальция прилить раствор гидроксида кальция. 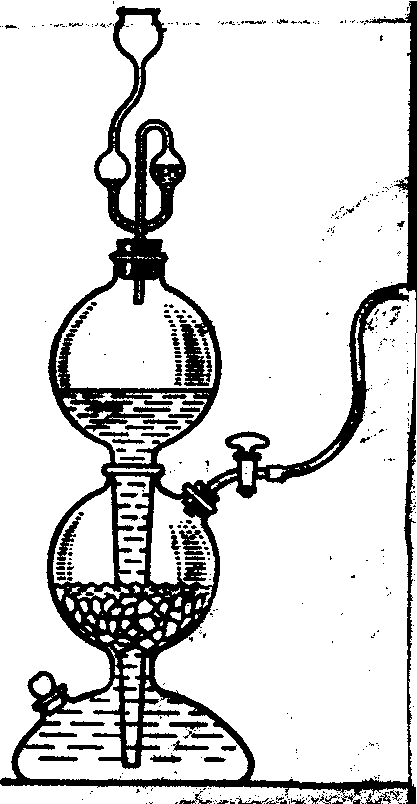 - Объяснить принцип работы аппарата Киппа; - составить уравнение реакции, протекающей в аппарате Киппа: CaCO3↓ + HCl → …;
рода при взаимодействии с гидроксидом кальция, к ка- кому типу относится эта реакция; - составить уравнение реакции Ca(OH)2 + CO2 → ... + …; осадок
осадком карбоната кальция и избытком диоксида угле- рода: CaCO3↓ + H2O + CO2 → …;
Рис. 4. Аппарат Киппа «средних» и какая - к классу «кислых солей»; - сравнить растворимость «средних» и «кислых» солей; - составить уравнение реакции взаимодействия гидрокарбоната кальция с гидроксидом кальция Ca(HCO3)2 +Ca(OH)2→…; - указать, какие свойства в этом взаимодействии проявляет кислая соль - гидрокарбонат кальция. Опыт 2. Получение и свойства основной соли – хлорида гидроксокобальта (II) В две пробирки внести по 2 капли раствора хлорида кобальта (II) и 2 н раствора гидроксида натрия до образования синего осадка. В первую пробирку к образовавшемуся хлориду гидроксокобальта (II) добавить раствор гидроксида натрия до изменения цвета осадка, во вторую – раствор соляной кислоты до его растворения. - Отметить цвет полученного осадка и образовавшегося раствора. - Составить уравнение I стадии взаимодействия хлорида кобальта (II) с гидроксидом натрия в молекулярной и ионной форме: CoCl2 + NaOH → … + …; - составить уравнение реакции основной соли – хлорида гидроксокобальта (II) с избытком гидроксида натрия в молекулярной и ионной форме: (CoOH)Cl↓ + NaOH → ... + …; гидроксид кобальта (II) - составить уравнение реакции основной соли – хлорида гидроксокобальта (II) с избытком соляной кислоты в молекулярной и ионной форме (CaOH)Cl + HCl → … + ….; - указать, «основную» и «среднюю» соль кобальта (II); - указать, какие кислотно-основные свойства проявляет основная соль. Опыт 3. Взаимодействие соли слабой кислоты с сильной кислотой Поместить в пробирку один микрошпатель кристаллического ацетата натрия и прилить 8 капель 2 н серной кислоты. Слегка подогреть пробирку в ладони и по запаху определить продукт реакции. - Составить уравнение реакции взаимодействия ацетата натрия и серной кислоты в молекулярной и ионной форме: CH3COONa + H2SO4 → … + …; - к какому типу относится эта реакция; - указать, какая кислота образуется – сильная или слабая; - сформулировать условие протекания ионно-обменной реакции. Опыт 4. Образование плохо растворимой соли – сульфата бария Налить в три пробирки по 2 капли раствора хлорида бария и добавить в одну из них 3 капли раствора Na2SO4, в другую – раствора H2SO4, в третью - раствора Al2(SO4)3. Наблюдать появление одинакового осадка. - Составить уравнения реакций в молекулярной и ионной форме 1) BaCl2 + Na2SO4 → …; 2) BaCl2 + H2SO4 → …; 3) BaCl2 + Al2(SO4)3 → …; - сравнить ионные уравнения реакций 1) – 3); - к какому взаимодействию сводится суть всех трех реакций; - к какому типу относятся реакции; - сформулировать, в каком направлении протекают ионно-обменные реакции. Опыт 5. Произведение растворимости и образование осадков галогенидов свинца (II) В две пробирки налить по 3 капли 0,005 М раствора нитрата свинца (II). В одну из них прибавить такой же объём 0,05 М раствора хлорида калия, а в другую – такой же объем 0,05 М раствора иодида калия. - Отметить, какой осадок образуется и какой - нет; - составить уравнение диссоциации нитрата свинца (II) и рассчитать концентрацию ионов Pb2+ в исходном 0,005 М растворе соли Pb(NO3)2: Pb(NO3)2 → …; 0,005 моль/л [Pb2+]o=? - составить уравнение диссоциации хлорида (иодида) калия и рассчитать концентрацию хлорид (иодид) – ионов в исходном 0,05 М растворе соли: KCl → …; KI → …; 0,05 моль/л 0,05 моль/л [Cl-]o = ? [I-]o = ? - рассчитать концентрации ионов Pb2+ и хлорид (иодид) - ионов после смешивания равных объемов исходных растворов: [Pb2+]см .= ? [Cl-]см. = ? [I-]см. = ?; - ответить, какие растворы называют насыщенными, из каких растворов образуются осадки; - рассчитать произведение концентраций - ответить, является раствор после смешивания нитрата свинца (II) и хлорида калия ненасыщенным или перенасыщенным; - рассчитать произведение концентраций - ответить, является раствор после смешивания нитрата свинца (II) и иодида калия ненасыщенным или перенасыщенным; - сформулировать условие образования осадка. Контрольные тестовые задания по теме: «Получение и химические свойства средних, кислых, основных солей». Задание 3.1.1 Кислой солью является: Ответы: 1) Fe(HSO4) 2; 2) H2SO4; 3) Ca(OH)2; 4) H3PO3; 5) CaCl2. Задание 3.1.2 Средней солью является: Ответы: 1) Fe(HSO4) 2; 2) H2SO4; 3) Ca(OH)2; 4) H3PO3; 5) CaCl2. Задание 3.1.3 Кислой солью является: Ответы: 1) CaCl2; 2) Ca(HCO3) 2; 3) H2CO3; 4) CaCO3; 5) CaOHCl. Задание 3.1.4 Основной солью является: Ответы: 1) MgCl2; 2) Mg(OH)2; 3) MgOHCl; 4) MgSO4; 5) MgCO3. Задание 3.1.5 Кислой солью является: Ответы: 1) FeSO3; 2) FeSO4; 3) Fe2(SO4) 3; 4) Fe(OH)3; 5) Fe(HSO3) 2. Задание 3.1.6 Средней солью является: Ответы: 1) Co(HS)2; 2) CoO; 3) CoS; 4) Co(OH)2; 5) H2S. Задание 3.1.7 Кислой солью является: Ответы: 1) NaHCO3; 2) Na2CO3; 3) NaOH; 4) H2CO3; 5) NaCl. Задание 3.1.8 Основной солью является: Ответы: 1) FeSO4; 2) FeOHSO4; 3) Fe(OH)2; 4) Fe2O3; 5) Na2SO4. Задание 3.1.9 Кислой солью является: Ответы: 1) Na2HPO4; 2) Na3PO4; 2) NaOH; 4) NaCl; 5) Na2O. Задание 3.1.10 Средней солью является: Ответы: 1) Fe(HSO4)2; 2) H2SO4; 2) Ca(OH)2; 4) CoSO4; 5) CoOHCl. Задание 3.1.11 Кислой солью является: Ответы: 1) MgCl2; 2) Mg(OH)2; 2) MgOHCl; 4) MgSO4; 5) Mg(HCO2) 2. Задание 3.1.12 Основной солью является: Ответы: 1) CaCl2; 2) Ca(HCO2) 2; 2) H2CO3; 4) CaCO3; 5) CaOHCl. Задание 3.1.13 Кислой солью является: Ответы: 1) CaHPO4; 2) CaSO4; 2) CaOHCl; 4) CaCl2; 5) Ca(OH)2. Задание 3.1.14 Средней солью является: Ответы: 1) KHCO3; 2) K2CO3; 2) KOH; 4) K2O; 5) KHSO3. Задание 3.1.15 Кислой солью является: Ответы: 1) FeSO4; 2) Fe(HSO2) 2; 2) Fe(OH)2; 4) Fe2O3; 5) Na2SO4. Задание 3.2.1 В молекулярном уравнении ионно-обменной реакции AgNO3 + FeCl3 … сумма коэффициентов равна: Ответы: 1) 8; 2) 4; 3) 6; 4) 5; 5) 7. Задание 3.2.2 В молекулярном уравнении ионно-обменной реакции Pb(NO3)2 + K2S … сумма коэффициентов равна: Ответы: 1) 4; 2) 5; 3) 3; 4) 6; 5) 8. Задание 3.2.3 В молекулярном уравнении ионно-обменной реакции Ba(NO3)2 + Al2(SO4)3 … сумма коэффициентов равна: Ответы: 1) 5; 2) 4; 3) 9; 4) 6; 5) 8. Задание 3.2.4 В молекулярном уравнении ионно-обменной реакции CaCl2 + Na3PO4 … сумма коэффициентов равна: Ответы: 1) 12; 2) 4; 3) 6; 4) 8; 5) 10. Задание 3.2.5 В молекулярном уравнении ионно-обменной реакции AgCl + K2S … сумма коэффициентов равна: Ответы: 1) 3; 2) 4; 3) 5; 4) 6; 5) 8. Задание 3.2.6 В молекулярном уравнении ионно-обменной реакции Na2S + HCl … сумма коэффициентов равна: Ответы: 1) 3; 2) 4; 3) 6; 4) 5; 5) 8. Задание 3.2.7 В молекулярном уравнении ионно-обменной реакции KCN + H2SO4 … сумма коэффициентов равна: Ответы: 1) 4; 2) 6; 3) 3; 4) 5; 4) 8. Задание 3.2.8 В молекулярном уравнении ионно-обменной реакции AlBr3 + AgNO3 … сумма коэффициентов равна: Ответы: 1) 7; 2) 6; 3) 4; 4) 5; 5) 8. Задание 3.2.9 В молекулярном уравнении ионно-обменной реакции KHSO3 + KOH … сумма коэффициентов равна: Ответы: 1) 4; 2) 6; 3) 5; 4) 8; 5) 10. Задание 3.2.10 В молекулярном уравнении ионно-обменной реакции Pb(NO3)2 + KI … сумма коэффициентов равна: Ответы: 1) 4; 2) 6; 3) 5; 4) 8; 5) 3. Задание 3.2.11 В молекулярном уравнении ионно-обменной реакции AgNO3 + Na2CrO4 … сумма коэффициентов равна: Ответы: 1) 8; 2) 4; 3) 3; 4) 6; 5) 5. Задание 3.2.12 В молекулярном уравнении ионно-обменной реакции Ni(NO3)2 + H2S … сумма коэффициентов равна: Ответы: 1) 5; 2) 4; 3) 6; 4) 8; 5) 7. Задание 3.2.13 В молекулярном уравнении ионно-обменной реакции FeSO4 + K2S … сумма коэффициентов равна: Ответы: 1) 6; 2) 4; 3) 5; 4) 8; 5) 7. Задание 3.2.14 В молекулярном уравнении ионно-обменной реакции Ca(HCO3)2 + Ca(OH)2 … сумма коэффициентов равна: Ответы: 1) 5; 2) 4; 3) 6; 4) 7; 5) 8. Задание 3.2.15 В молекулярном уравнении ионно-обменной реакции CaHPO4 + Ca(OH)2 … сумма коэффициентов равна: Ответы: 1) 6; 2) 4; 3) 8; 4) 7; 5) Задание 3.2.16 В молекулярном уравнении ионно-обменной реакции CaSO4 + Na2CO3 … сумма коэффициентов равна: Ответы: 1) 7;2) 6; 3) 3; 4) 4; 5) 8. Задание 3.2.17 В молекулярном уравнении ионно-обменной реакции KHCO3 + KOH … сумма коэффициентов равна: Ответы: 1) 5; 2) 6; 3) 3; 4) 4; 5) 8. Задание 3.3.1 В кратком ионном уравнении реакции CaSO4 + Na2CO3 … сумма коэффициентов равна: Ответы: 1) 4; 2) 3; 3) 5; 4) 6; 5) 8. Задание 3.3.2 В кратком ионном уравнении реакции AgCl + Na2S … сумма коэффициентов равна: Ответы: 1) 4; 2) 6; 3) 3; 4) 8; 5) 5. Задание 3.3.3 В кратком ионном уравнении реакции Sr(NO3)2 + Na2CO3 … сумма коэффициентов равна: Ответы: 1) 8; 2) 4; 3) 3; 4) 6; 5) 12. Задание 3.3.4 В кратком ионном уравнении реакции Ca3(PO4)2 + HCl(изб) … сумма коэффициентов равна: Ответы: 1) 12; 2) 5; 3) 8; 4) 6; 5) 4. Задание 3.3.5 В кратком ионном уравнении реакции MnS + HCl … сумма коэффициентов равна: Ответы: 1) 3; 2) 4; 3) 6; 4) 5; 5) 7. Задание 3.3.6 В кратком ионном уравнении реакции AgCl + NaI … сумма коэффициентов равна: Ответы: 1) 3; 2) 4; 3) 5; 4) 6; 5) 7. Задание 3.3.7 В кратком ионном уравнении реакции Ca(H2PO4)2(раствор) + Ca(OH)2 … сумма коэффициентов равна: Ответы: 1) 14; 2) 8; 3) 12; 4) 10; 5) 6. Задание 3.3.8 В кратком ионном уравнении реакции FeS + HCl … сумма коэффициентов равна: Ответы: 1) 6; 2) 4; 3) 5; 4) 3; 5) 9. Задание 3.3.9 В кратком ионном уравнении реакции CuS + HCl … сумма коэффициентов равна: Ответы: 1) 5; 2) 4; 3) 6; 4) 3; 5) 9. Задание 3.3.10 В кратком ионном уравнении реакции (CuOH)2CO3(тв) + HCl(изб) … + … + газ сумма коэффициентов равна: Ответы: 1) 8; 2) 5; 3) 6; 4) 11; 5) 9. Задание 3.3.11 В кратком ионном уравнении реакции CaCO3 + HCl(изб) … + газ сумма коэффициентов равна: Ответы: 1) 4; 2) 6; 3) 5; 4) 3; 5) 8. Задание 3.3.12 В кратком ионном уравнении реакции Na2SO3 + H2SO4(изб) … + газ сумма коэффициентов равна: Ответы: 1) 5; 2) 4; 3) 6; 4) 8; 5) 11. Задание 3.3.13 В кратком ионном уравнении реакции NaHCO3 + HCl … + газ сумма коэффициентов равна: Ответы: 1) 8; 2) 5; 3) 4; 4) 9; 5) 6. Задание 3.3.14 В кратком ионном уравнении реакции CH3COOK + H2SO4 … сумма коэффициентов равна: Ответы: 1) 3; 2) 6; 3) 13; 4) 4; 5) 8. Задание 3.3.15 В кратком ионном уравнении реакции HCOONa + HCl … сумма коэффициентов равна: Ответы: 1) 7; 2) 4; 3) 8; 4) 3; 5) 6. Задание 3.3.16 В кратком ионном уравнении реакции Ca(HCO3)2(р-р) + Ca(OH)2 … сумма коэффициентов равна: Ответы: 1) 6; 2) 10; 3) 8; 4) 5; 5) 9. Задание 3.3.17 В кратком ионном уравнении реакции Na2HPO4 + NaOH … сумма коэффициентов равна: Ответы: 1) 7; 2) 3; 3) 6; 4) 4; 5) 8. Задание 3.3.18 В кратком ионном уравнении реакции BaSO3 + H2SO4(изб) … + … + газ сумма коэффициентов равна: Ответы: 1) 7; 2) 5; 3) 8; 4) 6; 5) . Задание 3.3.19 В кратком ионном уравнении реакции NaHCO3 + NaOH … сумма коэффициентов равна: Ответы: 1) 8; 2) 3; 3) 9; 4) 6; 5) 4. Задание 3.3.20 В кратком ионном уравнении реакции CaHPO4(р-р) + Ca(OH)2 … сумма коэффициентов равна: Ответы: 1) 9; 2) 6; 3) 3; 4) 7; 5) 8. Задание 3.3.21 В кратком ионном уравнении реакции CaCO3 + H2CO3 … сумма коэффициентов равна: Ответы: 1) 4; 2) 5; 3) 3; 4) 6; 5) 7. Задание 3.3.22 В кратком ионном уравнении реакции NiS + H2SO4 … сумма коэффициентов равна: Ответы: 1) 6; 2) 4; 3) 3; 4) 5; 5) 8. Задание 3.3.23 В кратком ионном уравнении реакции BaCl2 + Na2CrO4 … сумма коэффициентов равна: Ответы: 1) 8; 2) 5; 3) 7; 4) 6; 5) 3. Задание 3.3.24 В кратком ионном уравнении реакции Ag2CrO4 + KI … сумма коэффициентов равна: Ответы: 1) 6; 2) 3; 3) 10; 4) 8; 5) 5. Задание 3.3.25 В кратком ионном уравнении реакции (CoOH)2SO4(тв) + H2SO4 … сумма коэффициентов равна: Ответы: 1) 4; 2) 6; 3) 8; 4) 3; 5) 7. 7.4. Лабораторная работа № 4 Гидролиз солей Опыт 1. Определение рН в растворах солей Испытуемые растворы: MgCl2, CuSO4, Na2CO3, NaCl. Определить рН растворов солей. На чистое сухое предметное стекло положить четыре полоски универсального индикатора, нанести на каждую из них по 1 капле испытуемых растворов и сравнить окраску бумаги с эталонной шкалой рН универсального индикатора. - Записать значения рН, указать, какая среда в испытуемых растворах; - ответить, что такое «гидролиз солей»; - ответить, в растворах каких солей гидролиз не протекает; - в растворах каких солей протекает гидролиз по катиону; - составить уравнение гидролиза MgCl2 в молекулярной и ионной форме: 1 стадия: MgCl2 + H2O 2 стадия: MgOHCl + H2O - составить уравнения гидролиза CuSO4 в молекулярной и ионной форме: 1 стадия: CuSO4 + H2O 2 стадия: (CuOH)2SO4 + H2O - ответить, какая стадия (1-я или 2-я) протекает в большей степени; - ответить, используя значения рН в растворах, какая соль MgCl2 или CuSO4 гидролизуется в большей степени; - ответить, как связаны сила основания и склонность его солей к гидролизу по катиону; - по результатам гидролиза солей MgCl2 и CuSO4 сравнить основные свойства соответствующих гидроксидов: Mg(OH)2 и Cu(OH)2; - ответить, в растворах каких солей протекает гидролиз по аниону; - составить уравнение гидролиза Na2CO3 в молекулярной и ионной форме 1 стадия: Na2CO3 + H2O 2 стадия: NaHCO3 + H2O - составить выражения для констант гидролиза Na2CO3 по 1-й и по 2-й стадии: - рассчитать константы гидролиза Na2CO3 по 1-й и по 2-й стадии, используя значения констант диссоциации для угольной кислоты (табл.1 приложения ) 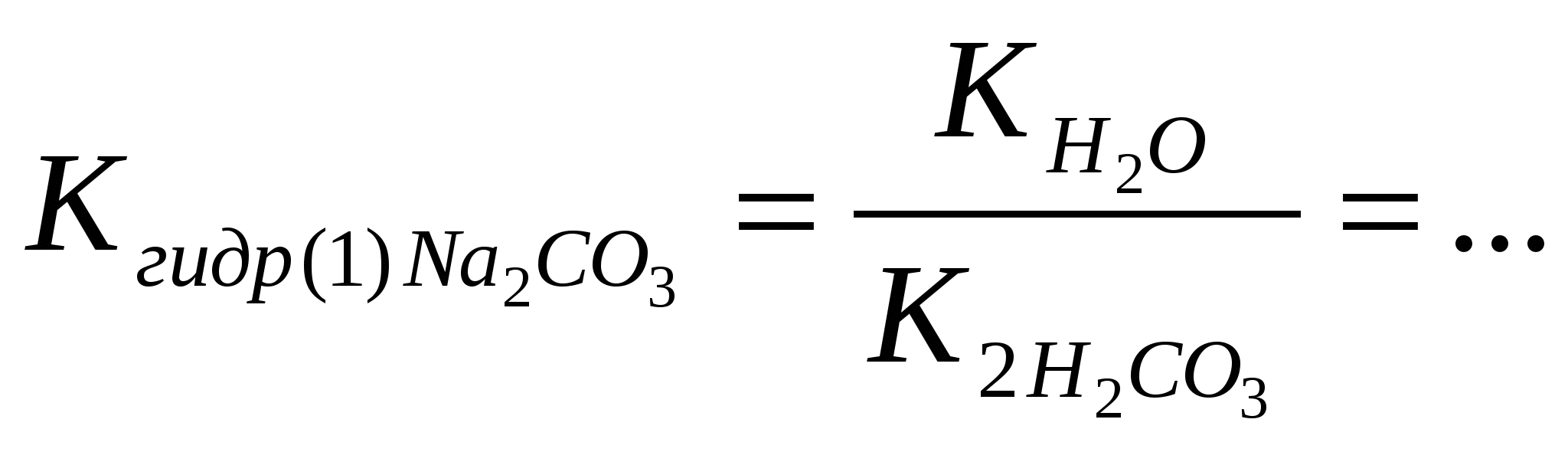 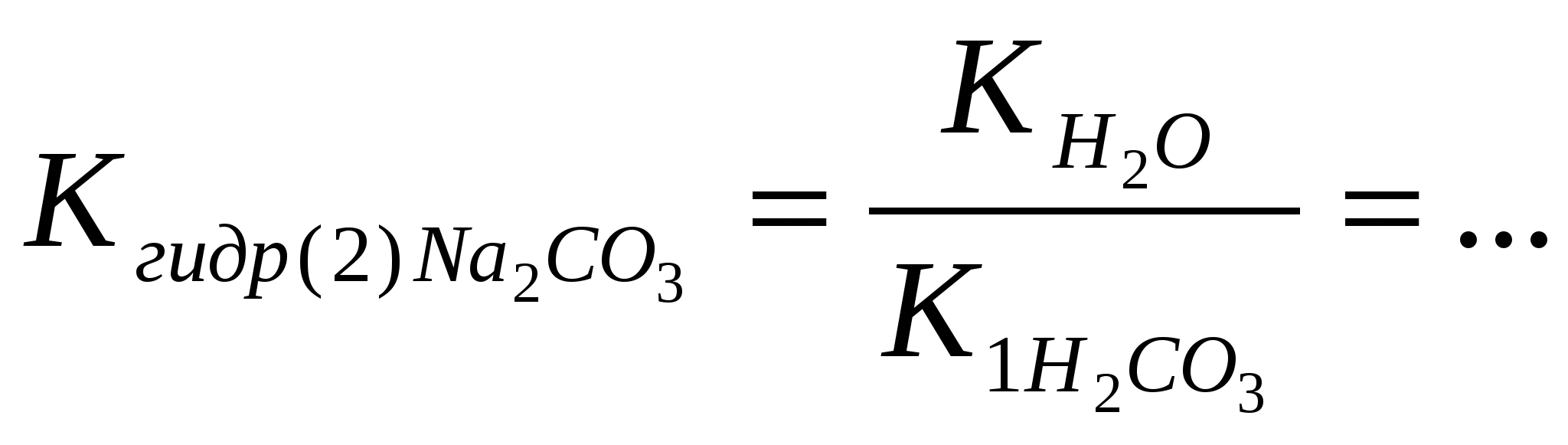 - ответить, какая стадия гидролиза Na2CO3 протекает в большей степени; - ответить, в каком направлении смещено равновесие гидролиза соли Na2CO3 ; - ответить, в испытуемых растворах протекает частичный или полный гидролиз. Опыт 2. Влияние температуры на гидролиз соли. Обратимость гидролиза Налить в пробирку 1 мл 0,5 М раствора ацетата натрия и 1 каплю фенолфталеина. Нагреть раствор до кипения, после чего вновь охладить. - Отметить изменение окраски раствора при нагревании и при охлаждении; - используя рис. 2 по окраске фенолфталеина, указать, какая среда в растворе ацетата натрия и как она изменяется при нагревании и при охлаждении раствора соли; - составить уравнение гидролиза ацетата натрия в молекулярной и ионной форме CH3COONa + H2O CH3COO- + H2O - ответить, в каком направлении смещается равновесие гидролиза при нагревании и при охлаждении раствора; - используя принцип Ле Шателье и результаты опыта, ответить, гидролиз соли протекает с выделением или поглощением тепла; гидролиз – экзо - или эндотермический процесс; - по результатам опыта ответить, гидролиз - обратимый или необратимый про цесс. Опыт 3. Полный гидролиз соли В две пробирки внести по 1-2 капли хлорида алюминия. В первую пробирку прилить раствор карбоната натрия, во вторую пробирку – раствор сульфида натрия до выпадения осадка. - Отметить внешние проявления реакций: образование осадка, выделение газа, запахи; - ответить, образуется ли карбонат алюминия в водном растворе; - составить уравнение реакции между водными растворами карбоната натрия и хлорида алюминия в молекулярной и ионной форме: AlCl3 + Na2CO3 + H2O → …; Al3+ + CO32- + H2O → …; - ответить, образуется ли сульфид алюминия в водном растворе; - составить уравнения реакции между водными растворами сульфида натрия и хлорида алюминия в молекулярной и ионной форме: AlCl3 + Na2S + H2O → …; Al3+ + S2- + H2O → …; - отличаются или нет по составу образующиеся осадки в первой и во второй пробирках; - совместный гидролиз по катиону и по аниону взаимно усиливаются или нет; - ответить, какие соли подвергаются полному гидролизу, как это отражается в таблице растворимости (табл.4 приложения) Контрольные тестовые задания по теме: «Гидролиз солей» Задание 4.1.1 Гидролизу не подвергается: Ответы: 1) FeSO4; 2) Na2SO3; 3) Fe(NO3)2; 4) Fe2(SO4)3; 5) Na2SO4. Задание 4.1.2 Гидролизу не подвергается: Ответы: 1) BaI2; 2) Na2CrO4; 3) CuCl2; 4) MgI2; 5) K2СO3 . Задание 4.1.3 Гидролизу не подвергается: Ответы: 1) K2CO3; 2) KCl; 3) ZnCl2; 4) ZnCO3; 5) BeCl2.. Задание 4.1.4 Гидролизу не подвергается: Ответы: 1) Cu(NO3)2; 2) CuCl2; 3) FeCl3; 4) Ca(NO3)2; 5) BiCl3. Задание 4.1.5 Гидролизу не подвергается: Ответы: 1) Cs2CO3; 2) K2CO3; 3) Cs2SO4; 4) FeSO4; 5) FeCl2. Задание 4.1.6 Гидролизу по аниону подвергается: Ответы: 1) FeSO4; 2) Na2SO3; 3) Fe(NO3) 2; 4) Fe2(SO4) 3; 5) Na2SO4. Задание 4.1.7 Гидролизу по аниону подвергается: Ответы: 1) BaI2; 2) Na2CrO4; 3) CuCl2; 4) MgI2; 5) KNO3. Задание 4.1.8 Гидролизу по аниону подвергается: Ответы: 1) K2CO3; 2) KCl; 3) ZnCl2; 4) Zn(NO3) 2; 5) BeSO4. . Задание 4.1.9 Гидролизу по аниону подвергается: Ответы: 1) RbI; 2) NaNO3; 3) K2SO4; 4) CuCl2; 5) CH3COONa . Задание 4.1.10 Гидролизу по катиону подвергается: Ответы: 1) K2SO4; 2) NaCl; 3) NH4Cl; 4) Na2S; 5) CaCl2 . Задание 4.1.11 Гидролизу по аниону подвергается: Ответы: 1) K2SO4; 2) NaCl; 3) NH4Cl; 4) Na2S; 5) CaCl2 . Задание 4.1.12 Гидролизу по катиону подвергается: Ответы: 1) Cs2CO3; 2) K2CO3; 3) Cs2SO4; 4) CaSO4; 5) FeCl2. Задание 4.1.13 Гидролизу по катиону подвергается: Ответы: 1) BaI2; 2) Na2CrO4; 3) CuCl2; 4) SrI2; 5) K2СO3 . Задание 4.1.14 Гидролизу по катиону подвергается: Ответы: 1) Na3PO4; 2) NaHS; 3) CoSO4; 4) K2SO4; 5) KI . Задание 4.1.15 Гидролизу по катиону подвергается: Ответы: 1) NaBr; 2) NiBr2; 3) K2CO3; 4) KHCO3; 5) BaCl2 . Задание 4.2.1 Кислaя среда в растворе соли: Ответы: 1) FeSO4; 2) Na2SO3; 3) Fe(OH)2; 4) Fe2O3; 5) Na2SO4. Задание 4.2.2 Кислaя среда в растворе соли: Ответы: 1) Na2CO3; 2) CuCl2; 3) NaCl; 4) Na2S; 5) NaI. Задание 4.2.3 Кислaя среда в растворе соли: Ответы: 1) NaNO3; 2) Na2CO3; 3) KNO3; 4) BiCl3 ; 5) NaHCO3. Задание 4.2.4 Кислaя среда в растворе соли: Ответы: 1) CoSO4; 2) Na2SO4; 3) K2SO4; 4) CsI; 5) CaCl2. Задание 4.2.5 Кислaя среда в растворе соли: Ответы: 1) Ca(NO3) 2; 2) SrCl2; 3) Sr(HCO3) 2; 4) Fe(NO3) 3 ; 5) Ba(NO3) 2. Задание 4.2.6 Нейтральная среда в растворе соли: Ответы: 1) FeSO4; 2) NaHSO3; 3) Fe(OH)2; 4) Fe2O3; 5) Na2SO4. Задание 4.2.7 Нейтральная среда в растворе соли: Ответы: 1) Ni(NO3) 2; 2) Na2CO3; 3) KNO3; 4) BiCl3 ; 5) NaHCO3. Задание 4.2.8 Нейтральная среда в растворе соли: Ответы: 1) Ca(NO3) 2; 2) SnCl2; 3) Sr(HCO3) 2; 4) Fe(NO3) 3 ; 5) Bi(NO3) 3. Задание 4.2.9 Нейтральная среда в растворе соли: Ответы: 1) Na2CO3; 2) CuCl2; 3) NaCl; 4) Na2S; 5) FeSO4. Задание 4.2.10 Нейтральная среда в растворе соли: Ответы: 1) BaCl2; 2) CuSO4; 3) K2CO3; 4) Na3PO4; 5) NaHCO3. Задание 4.2.11 Основная среда в растворе соли: Ответы: 1) Na2SO4; 2) CuCl2; 3) NaCl; 4) Na2S; 5) FeSO4. Задание 4.2.12 Основная среда в растворе соли: Ответы: 1) Ni(NO3) 2; 2) Na2CO3; 3) KNO3; 4) BiCl3 ; 5) NaHSO3. Задание 4.2.13 Основная среда в растворе соли: Ответы: 1) FeCl3; 2) Na2SO4; 3) K2SO3; 4) CsI; 5) CaCl2. Задание 4.2.14 Основная среда в растворе соли: Ответы: 1) BaCl2; 2) CuSO4; 3) KNO3; 4) Na3PO4; 5) NaHSO4. Задание 4.2.15 Основная среда в растворе соли: Ответы: 1) NaNO2; 2) FeSO4; 3) KI; 4) Ba(NO3) 2; 5) NaNO3 8. Окислительно-восстановительные процессы
Реакции, протекающие с изменением степеней окисления участвующих в них элементов, называют окислительно-восстановительными реакциями (ОВР). Степень окисления элемента – формальный заряд, который был бы на атоме, если бы все связи были ионными. Окислительно-восстановительная реакция протекает между окислителем и восстановителем. Окислитель – реагент, степень окисления элемента в котором в результате присоединения электронов понижается. Окислитель является акцептором электронов, то есть «принимает электроны» и восстанавливается. Восстановитель – реагент, степень окисления элемента в котором повышается в результате отдачи электронов. Восстановитель является донором электронов, то есть «отдает электроны» и окисляется. В окислительно-восстановительных реакциях восстановитель переходит в соответствующую окисленную форму, и наоборот, окислитель – в соответствующую восстановленную форму. Каждый из реагентов со своим продуктом образует сопряженную окислительно-восстановительную пару. Окисление – процесс в котором степень окисления элемента повышается вследствие отдачи электронов; Восстановление – процесс в котором степень окисления элемента понижается вследствие присоединения электронов. Процессы окисления и восстановления протекают одновременно. Степень окисления понижается Присоединение электронов   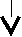 Восстановление В  осстановитель Окислитель осстановитель Окислитель Отдача электронов Отдача электроновСтепень окисления повышается  Сопряженные окислительно-восстановительные пары
восстан. окисл. форма (1) форма (1) 2. 2H+ + 2e – окисл. восстан. форма (2) форма (2) Вещества в окислительно-восстановительных реакциях могут проявлять
Окислительно-восстановительные реакции подразделяют на следующие типы
восстановитель окислитель
  окислитель восстановитель
0 -2+4 3S + 6KOH → 2K2S + K2SO3 + 3H2O ; и окислитель и восстановитель
восстановитель окислитель В уравнениях окислительно-восстановительных реакций должен быть отражен «электронный» и «материальный» баланс. Электронный баланс: число электронов, «отданных» восстановителем, должно быть равно числу электронов, «принятых» окислителем. Материальный баланс: число атомов одного элемента в левой и правой части уравнения должно быть одинаковым. Подбор коэффициентов в уравнении ОВР проводят либо методом электронного баланса, либо методом ионно-электронного баланса. Метод электронного баланса применяют для составления уравнений реакцией ОВР любого типа. Он включает следующие этапы.
окислитель восстановитель
Cr+6 + 3e → Cr+3 (процесс восстановления) I– – e → Io (процесс окисления)
Наименьшее Коэффициенты  общее кратное электронного баланса общее кратное электронного балансаС  3 r+6 + 3e → Cr+3 1 I– – 1e → Io 3
K2Cr2O7 + 6KI + H2SO4 → Cr2(SO4)3 + 3I2 + K2SO4 + H2O
K2Cr2O7 + 6KI + 7H2SO4 → Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
число атомов 0 число атомов 0 в левой части уравнения в правой части уравнения [7 + 7∙4] = 35 [(3∙4 + 4∙4 + 7)] = 35 Метод ионно-электронного баланса применяют для составления уравнений ОВР, протекающих в водных растворах. Он включает следующие этапы:
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O (молекуляр- наяформа) K++MnO4– +2Na++SO32–+2H++SO42-→Mn2++SO42-+2Na++SO42–+H2O (ионная форма)
MnO4– → Mn2+ SO32– → SO42–
MnO4– + 8H+ → Mn2+ + 4H2O SO32– + H2O → SO42– + 2H+
MnO4– + 8H+ + 5e– → Mn2+ + 4H2O (процесс восстановления) суммарный заряд суммарный заряд число переданных до превращения после превращения электронов [–1+8(+1)]=+7 [+2+4∙0]=+2 n1= +7–2= +5 SO32– + H2O – 2e → SO42– + 2H+ (процесс окисления) суммарный заряд суммарный заряд число переданных до превращения после превращения электронов [–2+0]=–2 [–2+2∙(+1)]=0 n2= –2–0= –2
Наименьшее общее коэффициенты элек- кратное тронного баланса   5∙2=10 MnO4– + 8H+ + 5e → Mn2+ + 4H2O 10 : 5=2 SO32– + H2O – 2e → SO42– + 2H+ 10 : 2=5
ответствующие коэффициенты электронного баланса, «приведение по добных членов» и составление краткого ионного уравнения: 2MnO4– + 16H+ + 2MnO4– + 6H+ + 5SO32– → 2Mn2+ + 5SO42– + 3H2O (краткое ионное уравнение)
2KMnO4 + 3H2SO4 + 5Na2SO3 → 2MnSO4 + 5Na2SO4 + 3H2O + K2SO4
суммарное число атомов 0 суммарное число атомов 0 в левой части уравнения в правой части уравнения [2∙4+3∙4+5∙3]=35 [2∙4+5∙4+3+4]=35
Условием протекания окислительно-восстановительных реакций является наличие двух сопряженных окислительно-восстановительных пар, причем взаимодействие осуществляется между сильным окислителем и сильным восстановителем с образованием слабого окислителя и слабого восстановителя:    окислитель (1) + восстановитель (2) → восстановитель (1) + окислитель (2) окислитель (1) + восстановитель (2) → восстановитель (1) + окислитель (2) сильные слабые сильные слабыеСвойства сопряженной окислительно-восстановительной пары характеризует окислительно-восстановительный потенциал(φок./вос.). Чем больше величина окислительно-восстановительного потенциала, тем более сильным окислителем является окисленная форма системы и тем слабее выражены восстановительные свойства восстановленной формы. Чем меньше величина окислительно-восстановительного потенциала, тем более сильным восстановителем является восстановленная форма системы. В самопроизвольных окислительно-восстановительных реакциях окислитель имеет больший (более положительный), а восстановитель – меньший (менее положительный) окислительно-восстановительный потенциал. φок(1) > φвос(2) Следовательно, разность окислительно-восстановительных потенциалов - электродвижущая сила (ЭДС) – самопроизвольно протекающих окислительно-восстановительных реакций положительна. ЭДС = φок(1) – φвос(2) > 0 Определить абсолютное значение окислительно-восстановительного потенциала сопряженной окислительно-восстановительной пары нельзя. Но можно измерить разность потенциалов между двумя окислительно-восстанови-тельными системами (рис. 5) За систему сравнения выбран стандартный водородный электрод: платиновая пластина, погружённая в раствор кислоты с концентрацией ионов [Н+]=1 моль/л, которая при 101,325 кПа и 298 К омывается водородом. Стандартный окислительно-восстановительный потенциал для системы Н2 возникающий в стандартном водородном электроде, принят равным нулю: φо(Н+/Н2) = 0,00 В. О Вольтметр кислительно-восстановительный потенциал электрохимической системы в стандартных условиях, измеренный относительно стандартного водородного электрода называют стандартным окислительно-восстано-вительным потенциалом. Значения стандартных окислительно-восстанови-тельных потенциалов, измеренные экспериментально, приводят в таблицах «Стандартные окислительно-восстановительные потенциалы» (табл.3 приложения). 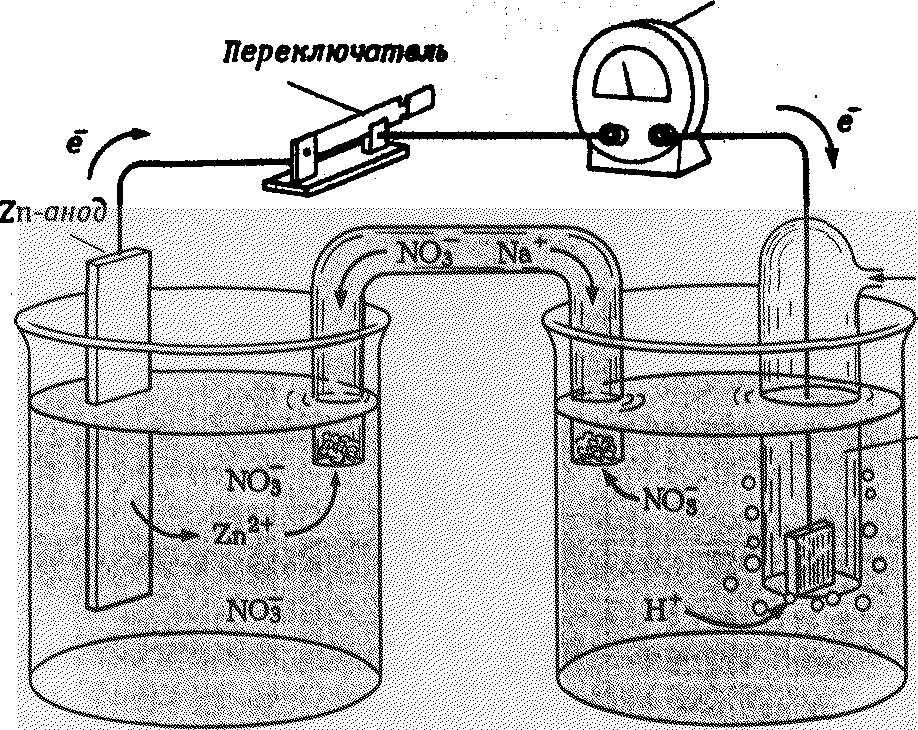 б) а) Рис. 5. Гальванический элемент с водородным электродом: а) цинковый электрод; б) водородный электрод 8.3. Химические свойства металлов 8.3.1. Ряд стандартных окислительно-восстановительных потенциалов металлов Металлы в реакциях с любыми простыми или сложными веществами проявляют восстановительные свойства. Химическую активность металлов в реакциях с водными растворами окислителей характеризует окислительно-восстановительный потенциал Ме – ne восст. форма окисл. Форма
Анализ ряда стандартных окислительно-восстановительных потенциалов металлов
Чем правее стоит металл в ряду, тем меньше его восстановительная способность и тем более выражена окислительная способность катионов металла.
Например    2е
2Мео + 2nH+ → 2Men+ + nH2 восстановитель окислитель Например: Fe + 2HCl → FeCl2 + H2 Металлы, стоящие в ряду правее водорода, характеризуются положительными значениями окислительно-восстановительных потенциалов и не вытесняют молекулярный водород из растворов кислот. Например: | |||||||||||||||||||||||||||||||||||||||||||||||||


 3,04 -2,92 -2,87 -2,71 -2,36 -1,66 -1,18 -0,76 -0,74 -0,41 -0,40 -0,25 -0,13 0 +0,34 +0,80 +0,85 +1,41
3,04 -2,92 -2,87 -2,71 -2,36 -1,66 -1,18 -0,76 -0,74 -0,41 -0,40 -0,25 -0,13 0 +0,34 +0,80 +0,85 +1,41