Методичка Химия. Отчет может быть оформлен либо в описательной форме, либо в форме таблицы на двух развернутых страницах Лабораторная работа
 Скачать 1.87 Mb. Скачать 1.87 Mb.
|
|
Рис. 3. Кислотно-основные свойства оксидов и соответствующих им гидроксисоединений Характерным свойством основных соединений является их способность взаимодействовать с кислотами, кислотными или амфотерными оксидами с образованием солей, например: KOH + HCl Ba(OH)2 + CO2 2NaO + Al2O3 В зависимости от числа протонов, которые могут присоединяться к основанию, различают основания однокислотные (например, LiOH, KOH, NH4OH), двукислотные [Ca(OH)2, Fe(OH)2] и т.д. Для многокислотных оснований реакция нейтрализации может протекать постадийно с образованием сначала основных, а затем средних солей. HCl HCl Me(OH)2 гидроксид NaOH основная NaOH средняя металла соль соль Например:1 стадия: Co(OH)2 + HCl хлорид гидроксокобальта (II) (основная соль) 2 стадия: Co(OH)Cl + HCl хлорид кобальта (II) (средняя соль) 5.3.2. Свойства кислотных соединений проявляют оксиды и кислоты неметаллов, а также d-металлов в степени окисления (+5, +6, +7) (см. рис. 3). Характерным свойством является их способность взаимодействовать с основаниями, основными и амфотерными оксидами с образованием солей, например: 2HNO3 + Cu(OH)2 → Cu(NO3)2 + 2H2O 2HCl + CaO → CaCl2 + H2O H2SO4 + ZnO → ZnSO4 + H2O CrO3 + 2NaOH → Na2CrO4 + H2O По наличию кислорода в своем составе кислоты делятся на кислородсодержащие (например, H2SO4, HNO3) и бескислородные (HBr, H2S). По числу содержащихся в молекуле кислоты атомов водорода, способных замещаться атомами металла, различают кислоты одноосновные (например, хлороводород HCl, азотистая кислота HNO2), двухосновные (сернистая H2SO3, угольная H2CO3), трехосновные (ортофосфорная H3PO4) и т.д. Многоосновные кислоты нейтрализуются ступенчато с образованием первоначально кислых, а затем средних солей: NaOH NaOH H2X HCl HCl многоосновная кислая средняя кислота соль соль Например, ортофосфорная кислота может образовать три вида солей в зависимости от количественного соотношения взятых кислоты и щелочи: а) NaOH + H3PO4 → NaH2PO4 + H2O; 1 : 1 дигидрофосфат натрия б) 2NaOH + H3PO4 → Na2HPO4 + 2H2O; 2 : 1 гидрофосфат натрия в) 3NaOH + H3PO4 → Na3PO4 + 3H2O. 3 : 1 ортофосфат натрия 5.3.3. Амфотерные оксиды и гидроксиды образуют Ве, р-металлы, находящиеся вблизи «диагонали амфотерности» (Al, Ga, Sn, Pb), а также d-металлы в степенях окисления (+3, +4) и Zn (+2) (см. рис. 3). Незначительно растворяясь, амфотерные гидроксиды диссоциируют как по основному, так и по кислотному типу: 2H2O 2H+ + [Zn(OH)4]2– Поэтому амфотерные оксиды и гидроксиды могут взаимодействовать как с кислотами, так и с основаниями. При взаимодействии с более сильными кислотами амфотерные соединения проявляют свойства оснований. ZnO + SO3 → ZnSO4 + H2O кислотный оксид Zn(OH)2 + H2SO4 → ZnSO4 + H2O основные кислота соединения При взаимодействии с сильными основаниями амфотерные соединения проявляют свойства кислот, образуя соответствующие соли. Состав соли зависит от условий проведения реакции. При сплавлении образуются простые «обезвоженные» соли. to 2NaOH + Zn(OH)2 → Na2ZnO2 + H2O↑ (тв) (тв) основание кислотное цинкат натрия соединение (H2ZnO2) 2NaOH + ZnO → Na2ZnO2 + H2O↑ (тв) (тв) В водных растворах щелочей образуются комплексные соли: 2NaOH + Zn(OH)2 → Na2[Zn(OH)4] (водный тетрагидроксоцинкат раствор) натрия 5.3.4. Закономерности изменения кислотно-основных свойств оксидов и гидроксисоединений Кислотно-основные свойства оксидов и гидроксисоединений закономерно изменяются по периоду и подгруппе. В составе гидроксисоединений всегда присутствует фрагмент ―Э–– О ––Н I II Например: 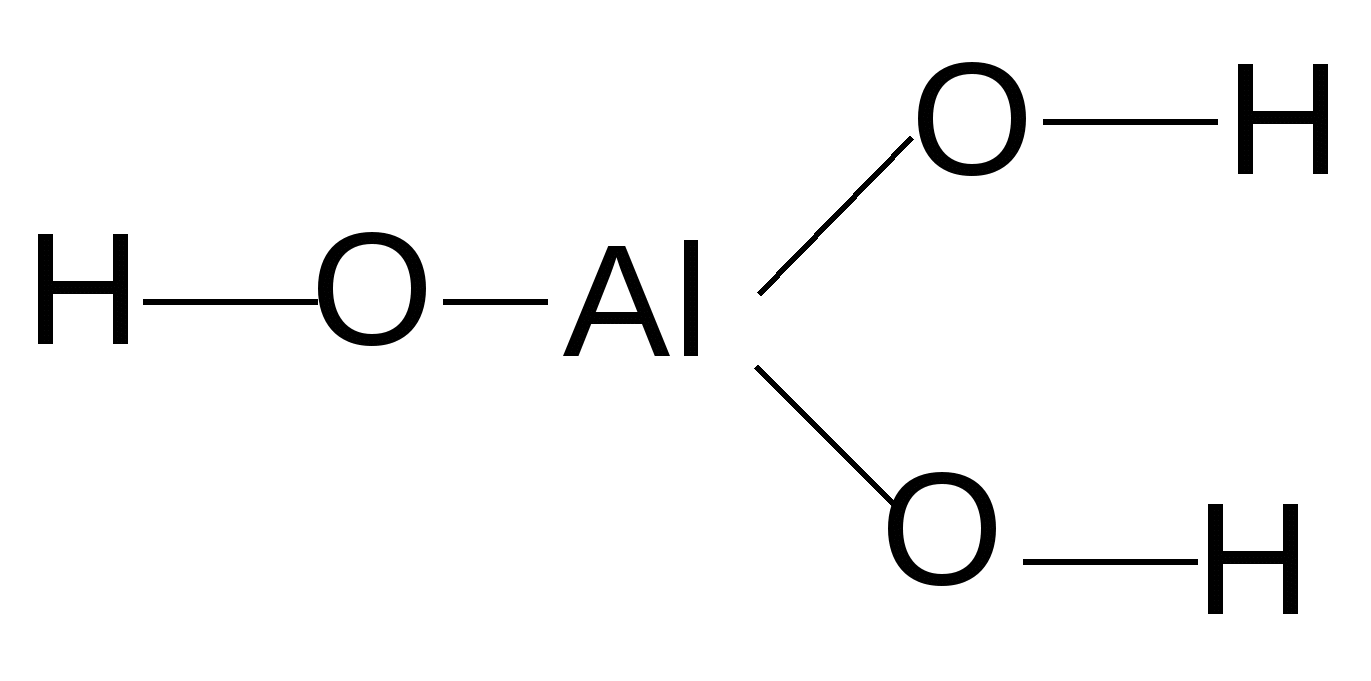 ; ; 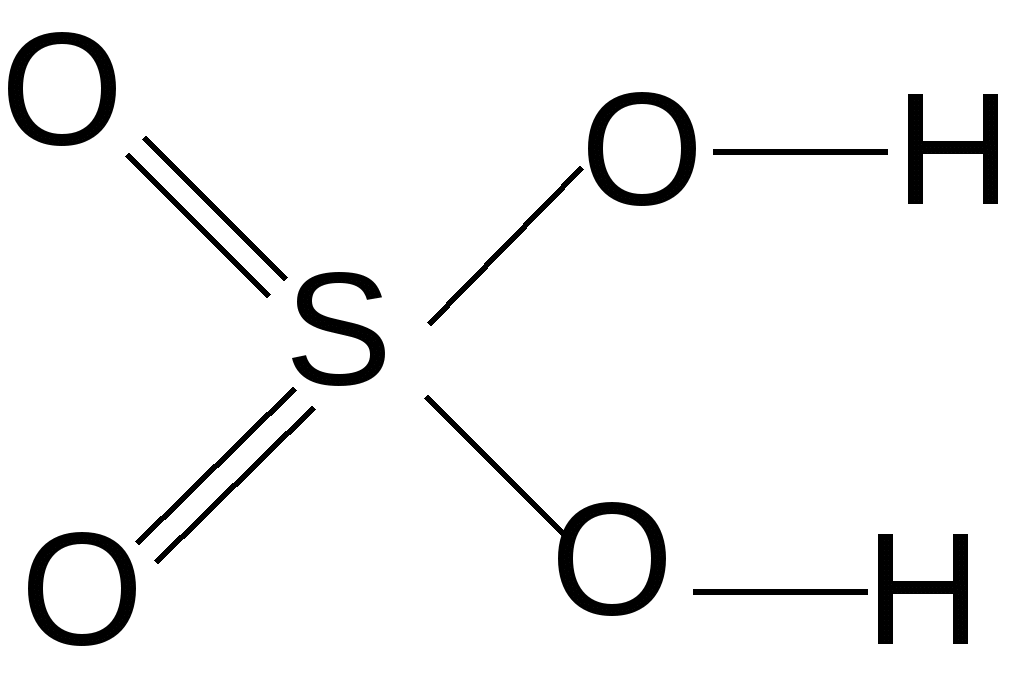 ; ; 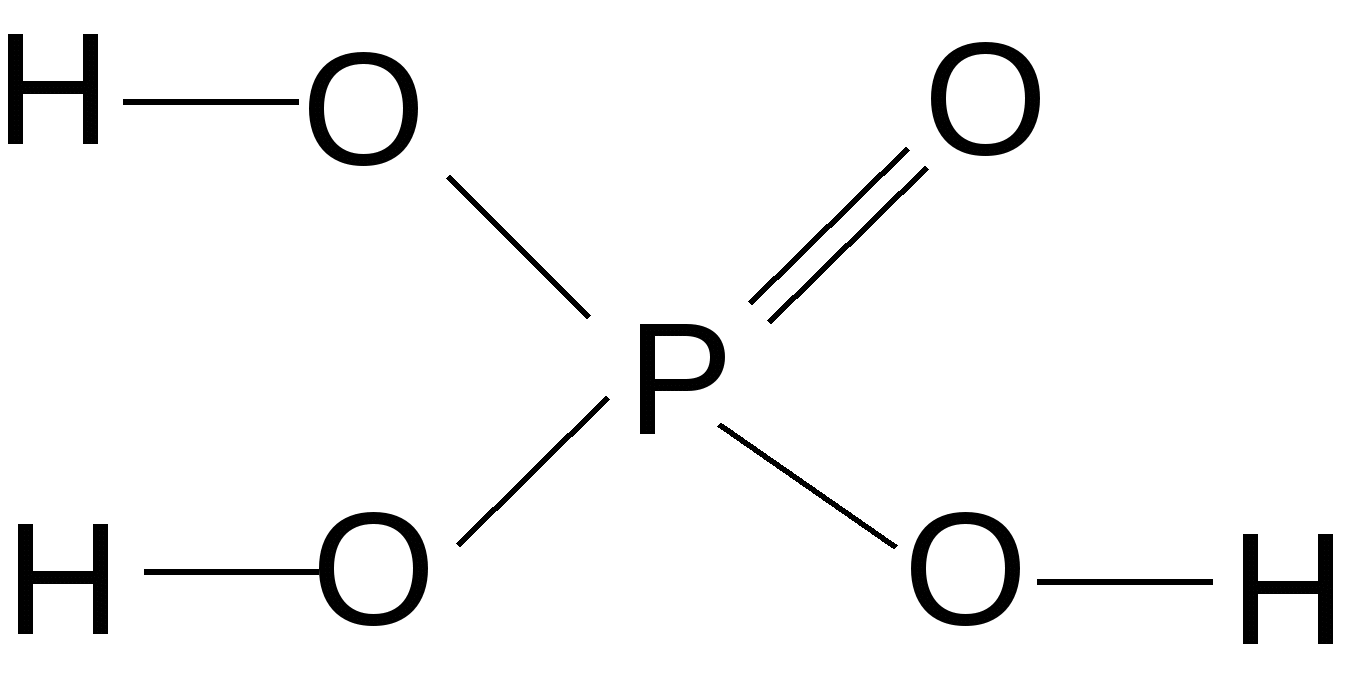 . .Кислотно-основные свойства вещества определяются типом химических связей I и II . Ионный тип химической связи I определяет её относительно легкую диссоциацию в растворе с образованием ОН—ионов ―Э― О Н → ―Э+1 + ОН— Вещества с преимущественно ионной связью I проявляют основные свойства. С увеличением электроотрицательности центрального атома (Э) ковалентность и прочность связи I возрастают. Одновременно связь II становится более полярной и менее прочной, это определяет её преимущественную диссоциацию в растворе с образованием ионов Н+: ―Э―О―Н Такие соединения проявляют кислотные свойства. Соединения с прочными промежуточными по характеру – ионно-ковалентными связями I и II – проявляют амфотерные свойства. С увеличением электроотрицательности центрального атома (Э) фрагмента ––Э––О––Н усиливаются кислотные и ослабляются основные свойства со-ответствующего гидроксисоединения в периоде в направлении слева направо и в подгруппе снизу вверх. Сравним, например, свойства гидроксисоединений элементов III периода и IIA-подгруппы: Be(OH)2 Амфотер- ный гидроксид NaOH Mg(OH)2 Al(OH)3 H2SiO3 H3PO4 H2SO4 HClO4 Очень Средней Амфотерный Очень Средней Сильная Очень сильное силы гидроксид слабая силы кислота сильная основание основание кислота кислота кислота   Ca(OH)2 - увеличение электроотрицательности центрального Сильное атома (Э) основание - усиление кислотных свойств оксидов и гидроксисое- Sr(OH)2 динений Сильное - ослабление основных свойств оксидов и гидрокси- основание соединений Ba(OH)2 - усиление гидролиза по катиону Сильное основание С увеличением степени окисления элемента (Э+n) возрастает его электроотрицательность и, следовательно, усиливаются кислотные и ослабляются основные свойства соответствующих оксидов и гидроксисоединений. +2 +3 +6 Например: CrO Cr2O3 CrO3 Cr(OH)2 Cr(OH)3 H2CrO4 основные амфотерные кислотные Таблица 7 Сравнительная характеристика свойств оксидов металлов и неметаллов
Генетическая связь между классами неорганических соединений  Основной Основнойо   ксид ксидМ соль  еталл Основание еталл Основание     Н   еметалл Кислотный Кислота еметалл Кислотный Кислотаоксид 5.4. Гидролиз солей Гидролиз солей – ионно-обменное взаимодействие солей с водой, сопровождающееся разложением соли. Гидролиз – реакция, обратная нейтрализации. соль основание кислота + Н2О
Составим уравнения гидролиза NH4Cl: NH4Cl + H2O (H++OH-) слабое. сильная. уравнение) основание кислота NH4+ + Cl– + H2O NH4+ + H2O В растворе увеличивается концентрация ионов Н+, следовательно, среда в растворе кислая (рН<7). Процесс гидролиза равновесный, характеризуется константой гидролиза и степенью гидролиза: Степень гидролиза – это отношение молярной концентрации гидролизовавшейся соли к общей молярной концентрации соли в растворе. h = Mгидр./Mo Многозарядные катионы слабых оснований подвергаются гидролизу ступенчато: Рассмотрим гидролиз CuSO4: C  uSO4 uSO4 H2O 1 стадия Cu2+ + H2O 2CuSO4 + 2H2O 2 стадия CuOH+ + H2O [CuOH]2SO4 + 2H2O Вторая стадия гидролиза идет в гораздо меньшей степени, чем первая, т.е. «подавлена».
Рассмотрим гидролиз соли CH3COONa. CH3COO–Na+ + H2O (H+―OH–) слабая сильное кислота основание CH3COO– + Na+ + H2O СH3COO– + H2O В растворе увеличивается концентрация ОН– - ионов, следовательно, среда щелочная (рН>7).
Например: CH3COO–NH4+ + H2O (H+―OH–) слабая слабое кислота основание CH3COO– + NH4+ + H2O Некоторые соли подвергаются полному гидролизу, если образующиеся продукты – газы или плохо растворимые соединения. Например:  Al2S3 + 6H2O |
