|
|
Методичка Химия. Отчет может быть оформлен либо в описательной форме, либо в форме таблицы на двух развернутых страницах Лабораторная работа
Опыт 6. Взаимодействие металлов – Mg, Fe, Cu – с разбавленной азотной кислотой (показательный)
В три пробирки налить по 2-3 мл разбавленной азотной кислоты. Осторожно опустить в первую пробирку пластинку меди, во вторую – железа, в третью – магния. Если реакция идет слабо, слегка нагреть пробирки, после охлаждения в пробирку с Fe добавить 1 каплю тиоцианата калия (KSCN)
отметить, какие изменения происходят в каждой из пробирок, с каким металлом реакция идет наиболее энергично;
составить уравнения возможных реакций Mg с разбавленной азотной кислотой, учитывая, что образуется нитрат магния, вода и продукт восстановления азота (V)
Mg + HNO3(разб.) → NO + … + …
Mg + HNO3(разб.) → NH4NO3 + … + …;
составить уравнения реакции Fe с разбавленной азотной кислотой, учитывая, что образуются нитрат железа (III), вода и оксид азота (II):
Fe + HNO3(разб.) → …;
ответить, действием какого реактива можно доказать образование соли железа (III);
составить уравнение реакции меди с разбавленной азотной кислотой, учитывая, что образуются нитрат меди (II), вода и оксид азота (II).
Cu + HNO3(разб.) → NO + … + …
Опыт 7. Взаимодействие металлов – Al, Fe, Cu – с концентрированной азотной кислотой (показательный)
В три пробирки налить по
1 мл концентрированной азотной кислоты. Осторожно опустить в первую пробирку пластинку меди, во вторую – железа, в третью – алюминия. Наблюдать за изменениями в пробирках в течение
2 минут. Пробирки с железом и алюминием нагреть.
Отметить, какие изменения происходят в каждой из пробирок при комнатной температуре; при нагревании;
ответить, с каким металлом при комнатной температуре реакция идет наиболее энергично, какие металлы "пассивируются" концентрированной азотной кислотой;
составить уравнение реакции меди с концентрированной азотной кислотой, протекающей при комнатной температуре с образованием нитрата меди (II), оксида азота (IV) и воды:
Cu + HNO3 → NO2↑ + … + …;
(конц.) бурый
составить уравнение реакции железа с концентрированной азотной кислотой, протекающей при нагревании с образованием соли – нитрата железа (III), оксида азота (IV) и воды:
Fe + HNO3(конц.) → NO2↑ + … + …;
составить уравнение реакции алюминия с концентрированной азотной кислотой, протекающей при нагревании с образованием соли – нитрата алюминия, оксида азота (IV) и воды:
Al + HNO3(конц.) → NO2↑ + … + …
Контрольные тестовые задания по теме «Химические свойства металлов»
Задание 5.1.1
Среди приведенных металлов наиболее активный:
Ответы: 1) Na; 2) Fe; 3) Mg; 4) Cu; 5) Ag.
Задание 5.1.2
Используя ряд электродных потенциалов металлов, расположите металлы в порядке увеличения их химической активности:
а) Zn, б) Ca, в) Ag.
Ответы: 1) Zn, Ca, Ag; 2) Ca, Ag, Zn; 3) Ag, Zn, Ca; 4) Ca, Zn, Ag; 5) Zn, Ag, Ca.
Задание 5.1.3
Используя ряд электродных потенциалов металлов, расположите металлы в порядке увеличения их химической активности:
а) Fe, б) Cu, в) Al.
Ответы: 1) Fe, Cu, Al; 2) Cu, Al, Fe; 3) Al, Fe, Cu; 4) Cu, Fe, Al; 5) Fe, Al, Cu.
Задание 5.1.4
Используя ряд электродных потенциалов металлов, расположите металлы в порядке увеличения их химической активности:
а) Mg, б) Hg, в) Sn.
Ответы: 1) Mg, Hg, Sn; 2) Hg, Sn, Mg; 3) Sn, Mg, Hg; 4) Hg, Mg, Sn;
5) Mg, Sn, Hg.
Задание 5.1.5
Используя ряд электродных потенциалов металлов, расположите металлы в порядке уменьшения их химической активности:
а) Na, б) Al, в) Au.
Ответы: 1) Na, Al, Au; 2) Al, Au, Na; 3) Au, Na, Al; 4) Al, Na, Au; 5) Na, Au, Al.
Задание 5.1.6
Используя ряд электродных потенциалов металлов, расположите ме-
таллы в порядке увеличения их химической активности:
а) Ba, б) Pb, в) Zn.
Ответы: 1) Ba, Pb, Zn; 2) Pb, Zn, Ba; 3) Zn, Ba, Pb; 4) Pb, Ba, Zn; 5) Ba, Zn, Pb.
Задание 5.1.7
Железо из раствора соли FeCl2 вытесняет:
Ответы: 1) магний; 2) олово; 3) свинец; 4) медь; 5) серебро.
Задание 5.1.8
Цинк из раствора соли ZnSO4 вытесняет:
Ответы: 1) железо; 2) свинец; 3) медь; 4) никель; 5) алюминий.
Задание 5.1.9
Металл, который не вытесняет олова из соли SnCl2:
Ответы: 1) Ca; 2) Mg; 3) Cu; 4) Fe; 5) Ni.
Задание 5.1.10
Железо вытесняет металл из раствора соли:
Ответы: 1) NaCl; 2) Pb(NO3)2; 3) MgSO4; 4) ZnSO4; 5) Al2(SO4)3.
Задание 5.1.11
Химическая реакция произойдет между веществами:
Ответы: 1) Cu и HCl; 2) Ag и CuSO4; 3) Zn и FeSO4; 4) Zn и MgCl2;
5) Au и AgNO3.
Задание 5.1.12
Раствор железного купороса можно хранить в посуде из металла:
Ответы: 1) Mg; 2) Zn; 3) Al; 4) Cr; 5) Cu.
Задание 5.1.13
Раствор медного купороса можно хранить в посуде из металла:
Ответы: 1) Cr; 2) Ag; 3) Fe; 4) Zn; 5) Al.
Задание 5.1.14
Раствор медного купороса нельзя хранить в посуде из металла:
Ответы: 1) Au; 2) Ag; 3) Fe; 4) Pt; 5) Pd.
Задание 5.1.15
Никель из сульфата никеля вытесняет металл:
Ответы: 1) Sn; 2) Mg; 3) Cu; 4) Pb; 5) Ag.
Задание 5.2.1
Водород из разбавленной соляной кислоты вытесняет:
Ответы: 1) медь; 2) золото; 3) платина; 4) серебро; 5) магний.
Задание 5.2.2:
Водород из разбавленной серной кислоты вытесняет:
Ответы: 1) цинк; 2) медь; 3) серебро; 4) золото; 5) платина.
Задание 5.2.3
Металл, который не вытесняет водород из раствора соляной
кислоты:
Ответы: 1) Ca; 2) Fe; 3) Zn; 4) Hg; 5) Sn.
Задание 5.2.4
Не вытесняет водород из раствора соляной кислоты:
Ответы: 1) K; 2) Ag; 3) Mn; 4) Zn; 5) Li.
Задание 5.2.5
Металл, который вытесняет водород из раствора соляной кислоты:
Ответы: 1) Cu; 2) Ag; 3) Hg; 4) Mg; 5) Au.
Задание 5.2.6
Не вытесняет водород из соляной кислоты металл:
Ответы: 1) Mg; 2) Pt; 3) Zn; 4) Fe; 5) Al.
Задание 5.2.7
Не вытесняет водород из соляной кислоты металл:
Ответы: 1) Ca; 2) Fe; 3) Cu; 4) Mn; 5) Al.
Задание 5.2.8
Водород из разбавленной серной кислоты вытесняет:
Ответы: 1) Bi; 2) Co; 3) Cu; 4) Ag; 5) Au.
Задание 5.2.9
Водород из разбавленной серной кислоты вытесняет:
Ответы: 1) Ni; 2) As; 3) Hg; 4) Pt; 5) Bi.
Задание 5.2.10
Водород из разбавленной серной кислоты вытесняет:
Ответы: 1) Hg; 2) Ag; 3) Pt; 4) Au; 5) Cr.
Задание 5.2.11
Водород из разбавленной серной кислоты вытесняет:
Ответы: 1) Hg; 2) Cd; 3) Ag; 4) Au; 5) Bi.
Задание 5.2.12
Водород из разбавленной соляной кислоты не вытесняет:
Ответы: 1) Fe; 2) Zn; 3) Al; 4) Ag; 5) Mg.
Задание 5.2.13
Водород из разбавленной соляной кислоты не вытесняет:
Ответы: 1) Mg; 2) Al; 3) Be; 4) Cr; 5) Au.
Задание 5.2.14
Водород из разбавленной соляной кислоты не вытесняет:
Ответы: 1) Pt; 2) Fe; 3) Ca; 4) Mn; 5) Ba.
Задание 5.2.15
Водород из разбавленной соляной кислоты не вытесняет:
Ответы: 1) Sr; 2) Ag; 3) Al; 4) Be; 5) Fe.
Задание 5.2.16
Водород из разбавленной соляной кислоты не вытесняет:
Ответы: 1) Ca; 2) Zn; 3) Hg; 4) Mg; 5) Mn.
Задание 5.3.1
С водой взаимодействует металл:
Ответы: 1) Sn; 2) Pb; 3) Cu; 4) Ag; 5) K.
Задание 5.3.2
Водород из воды вытесняет металл:
Ответы: 1) Na; 2) Au; 3) Cu; 4) Ag; 5) Sn.
Задание 5.3.3
С водой взаимодействует металл:
Ответы: 1) Co; 2) Sn; 3) K; 4) Pb; 5) Bi.
Задание 5.3.4
С водой взаимодействует металл:
Ответы: 1) Co; 2) Fe; 3) Ag; 4) Fr; 5) Bi.
Задание 5.3.5
С водой взаимодействует металл:
Ответы: 1) Mn; 2) Ti; 3) Pb; 4) Cu; 5) Sr.
Задание 5.3.6
С водой взаимодействует металл:
Ответы: 1) Co; 2) Zn; 3) Ba; 4) Be; 5) Al.
Задание 5.3.7
С водой взаимодействует металл:
Ответы: 1) Rb; 2) Co; 3) Ni; 4) Bi; 5) Cu.
Задание 5.3.8
С водой взаимодействует металл:
Ответы: 1) Fe; 2) Cs; 3) Sn; 4) Pb; 5) Ag.
Задание 5.3.9
С водным раствором гидроксида натрия взаимодействует металл:
Ответы: 1) Al; 2) Mg; 3) Mn; 4) Cu; 5) Ag.
Задание 5.3.10
С водным раствором гидроксида натрия взаимодействует металл:
Ответы: 1) Fe; 2) Co; 3) Cd; 4) Bi; 5) Zn.
Задание 5.3.11
С водным раствором гидроксида натрия взаимодействует металл:
Ответы: 1) Cu; 2) Sn; 3) Mn; 4) Ag; 5) Co.
Задание 5.3.12
С водным раствором гидроксида натрия взаимодействует металл:
Ответы: 1) Ni; 2) Bi; 3) Fe; 4) Pb; 5) Mg.
Задание 5.3.13
С водным раствором гидроксида натрия взаимодействует металл:
Ответы: 1) Be; 2) Cd; 3) Fe; 4) Hg; 5) Au.
Задание 5.3.14
С водным раствором гидроксида натрия взаимодействует металл:
Ответы: 1) Co; 2) Ag; 3) Al; 4) Au; 5) Pt.
Задание 5.3.15
С водным раствором гидроксида натрия взаимодействует металл:
Ответы: 1) Pt; 2) Ca; 3) Mg; 4) Mn; 5) Bi.
Задание 5.4.1
Сумма коэффициентов в уравнении реакции
Cu + HNO3 → Cu(NO3)2 + NO2 + H2O равна:
конц.
Ответы: 1) 3; 2) 6; 3) 5; 4) 8; 5) 10.
Задание 5.4.2
Сумма коэффициентов в уравнении реакции
Cu + HNO3 → Cu(NO3)2 + NO + H2O равна:
разб.
Ответы: 1) 5; 2) 12; 3) 14; 4) 20; 5) 10.
Задание 5.4.3
Сумма коэффициентов в уравнении реакции
to
Fe + HNO3 → Fe(NO3)3 + NO2 + H2O равна:
конц.
Ответы: 1) 8; 2) 14; 3) 10; 4) 12; 5) 5.
Задание 5.4.4
Сумма коэффициентов в уравнении реакции
Fe + HNO3 → Fe(NO3)3 + NO + H2O равна:
разб.
Ответы: 1) 8; 2) 14; 3) 10; 4) 12; 5) 9.
Задание 5.4.5
Сумма коэффициентов в уравнении реакции
Sn + HNO3 → H2SnO3 + NO2 + H2O равна:
конц.
Ответы: 1) 7; 2) 11; 3) 9; 4) 13; 5) 5.
Задание 5.4.6
Сумма коэффициентов в уравнении реакции
H2O + Sn + HNO3 → H2SnO3 + NO равна:
разб.
Ответы: 1) 8; 2) 14; 3) 20; 4) 10; 5) 15.
Задание 5.4.7
Сумма коэффициентов в уравнении реакции
Zn + HNO3 → Zn(NO3)2 + NO2 + H2O равна:
конц.
Ответы: 1) 10; 2) 12; 3) 8; 4) 6; 5) 14.
Задание 5.4.8
Сумма коэффициентов в уравнении реакции
Zn + HNO3 → Zn(NO3)2 + NO + H2O равна:
разб.
Ответы: 1) 14; 2) 12; 3) 8; 4) 18; 5) 20.
Задание 5.4.9
Сумма коэффициентов в уравнении реакции
Al + NaOH + H2O → Na[Al(OH)4] + H2 равна:
Ответы: 1) 16; 2) 14; 3) 15; 4) 10; 5) 8.
Задание 5.4.10
Сумма коэффициентов в уравнении реакции
Ca + H2SO4 → CaSO4 + H2S + H2O равна:
конц.
Ответы: 1) 10; 2) 12; 3) 18; 4) 16; 5) 14.
Задание 5.4.11
Сумма коэффициентов в уравнении реакции
Zn + H2SO4 → ZnSO4 + SO2 + H2O равна:
конц.
Ответы: 1) 5; 2) 7; 3) 9; 4) 10; 5) 12.
Задание 5.4.12
Сумма коэффициентов в уравнении реакции
Mg + H2SO4 → MgSO4 + S + H2O равна:
конц.
Ответы: 1) 9; 2) 17; 3) 15; 4) 13; 5) 7.
Задание 5.4.13
Сумма коэффициентов в уравнении реакции
Zn + NaOH + H2O → Na2[Zn(OH)4] + H2 равна:
Ответы: 1) 7; 2) 9; 3) 5; 4) 11; 5) 10.
Задание 5.4.14
Сумма коэффициентов в уравнении реакции
Al + H2SO4 → Al2(SO4)3 + S + H2O равна:
Ответы: 1) 8; 2) 5; 3) 7; 4) 12; 5) 10.
Задание 5.4.15
Сумма коэффициентов в уравнении реакции
Ba + H2SO4 → BaSO4 + H2S + H2O равна:
Ответы: 1) 10; 2) 12; 3) 14; 4) 16; 5) 18.
Электрохимические процессы
9.1. Основные понятия
Электрохимический процесс – окислительно-восстановительный процесс, протекающий на электродах с участием электрического тока.
Особенности электрохимических процессов
1) - пространственное разделение процессов окисления и восстановления;
2) - наличие внешней цепи (металлический проводник) и внутренней цепи (электролит) (рис. 6);
3) - первичные реакции идут на «электродах» – поверхности контакта металлического проводника и электролита;
катод – электрод, на котором идет процесс восстановления;
анод – электрод, на котором идет процесс окисления.
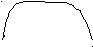   внешняя цепь (металлический проводник) внешняя цепь (металлический проводник)
 

электро-
лит
  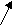 внутренняя цепь внутренняя цепь
электроды
Рис. 6. Схема электролитической ячейки
Электрохимические процессы подразделяются на две группы
а) процессы, происходящие в гальванических элементах и сопровождающиеся возникновением электрической энергии за счет химических процессов;
б) процессы, протекающие в элетролизерах под действием электрической энергии от внешнего источника тока, вызывающей химические реакции на электродах.
Сравнение процессов в гальванических элементах и электролиза
Электрохимический процесс
|
с получением электрической энергии
|
с потреблением электрической энергии
|
Преобразование энергии
|
Преобразование химической энергии в электрическую
|
Преобразование электрической энергии в химическую энергию продуктов электролиза
|
Протекание процесса
|
Самопроизвольное
|
Принудительное
|
Устройство
|
Гальванический элемент
|
Электролизер
|
Знак заряда
катода
анода
|
+
–
|
–
+
|
Воздействие перенапряжения
|
Напряжение снижается
|
Напряжение повышается
|
Наименование процессов
|
процессы в химических источниках электрической энергии;
электрохимическая коррозия.
|
электролиз расплавов;
электролиз растворов с инертным анодом;
электролиз растворов с активным анодом.
|
9.2. Гальванический элемент
Гальванический элемент – устройство, в котором химическая энергия самопроизвольно протекающей окислительно-восстановительной реакции превращается в электрическую энергию. Гальванический элемент содержит два полуэлемента, между электродами которых возникает разность потенциалов.
Принцип работы гальванического элемента иллюстрирует гальванический элемент Даниэля-Якоби, состоящий из цинкового и медного полуэлементов (рис. 7).
В цинковом полуэлементе металлическая цинковая пластина погружена в водный раствор соли цинка, с концентрацией [Zn2+]=1 моль/л. В медном полуэлементе – металлическая медная пластина погружена в водный раствор соли меди (II) с концентрацией [Cu2+]=1 моль/л. Цинковая и медная пластины соединены металлическим проводником, растворы солей – «солевым мостиком» («электролитический ключ»).
Вольтметр
Cu-катод
Рис. 7. Гальванический элемент Даниэля-Якоби
До замыкания цепи на каждой из металлических пластин на границе с
раствором устанавливаются равновесия:
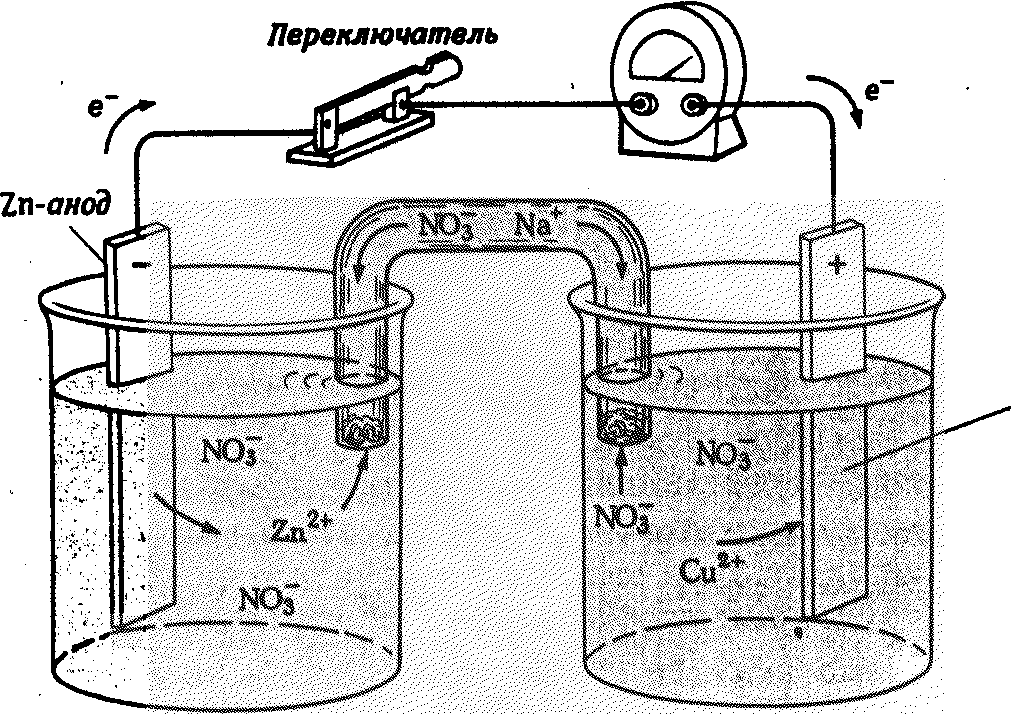
Cuo(тв.)  Сu2+(р-р) + 2e(на мет.); Сu2+(р-р) + 2e(на мет.); 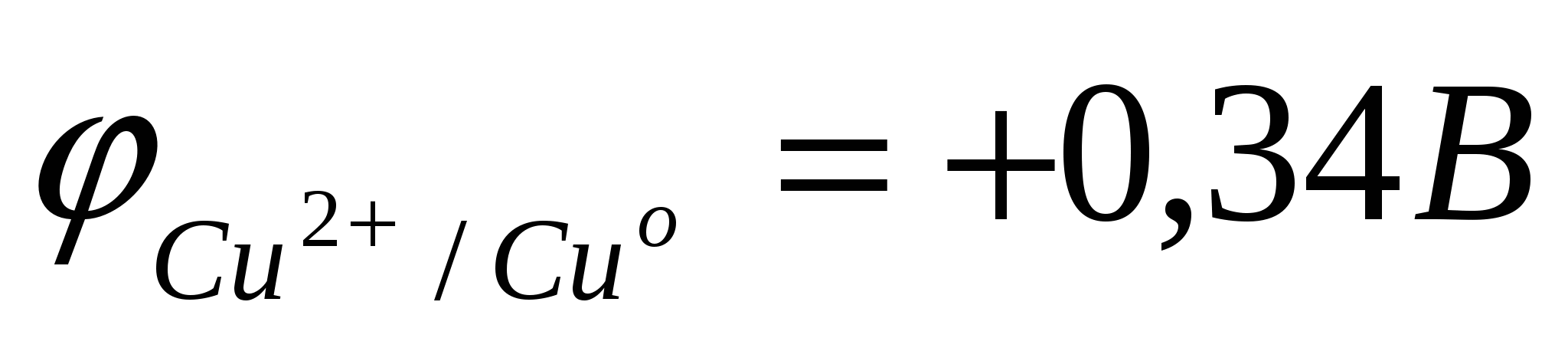
Zno(тв.)  Zn2+(р-р) + 2e(на мет.); Zn2+(р-р) + 2e(на мет.); 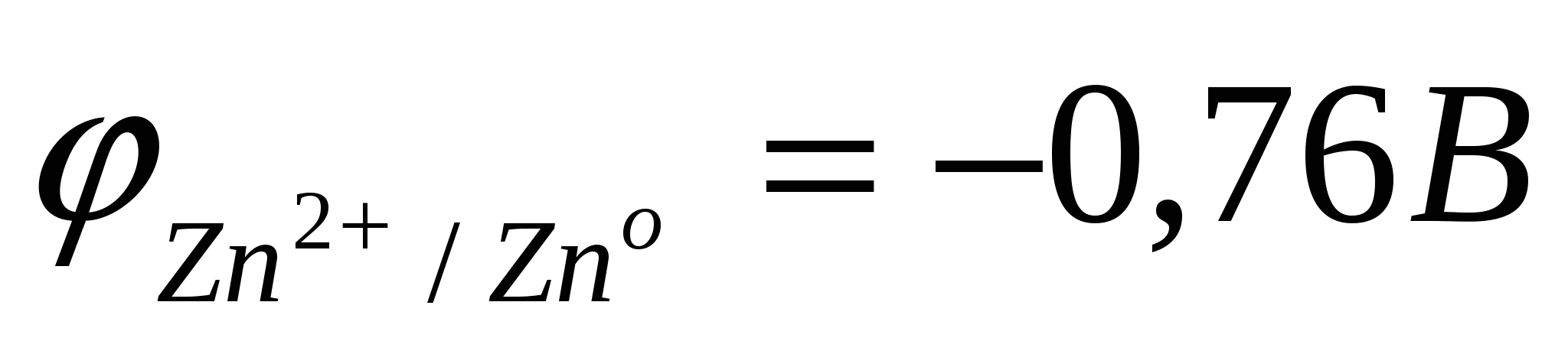
Цинковая пластина заряжена более отрицательно, чем медная. Между ними возникает разность потенциалов. При замыкании системы в цепь равновесия на границе металл–раствор нарушаются. По внешней цепи – металлическому проводнику – избыток электронов с Zn–пластины переходит на Cu–пластину, где их концентрация меньше, так как 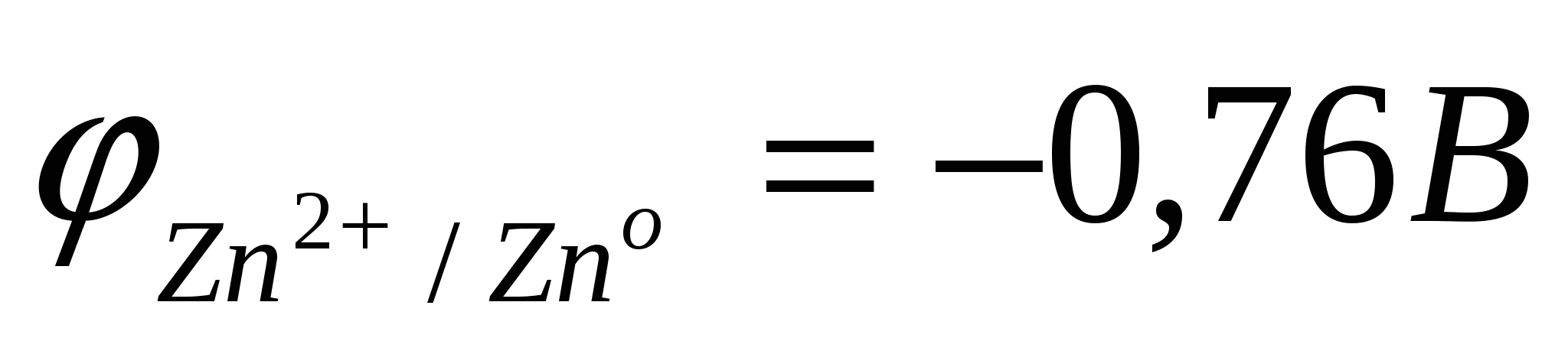 < < 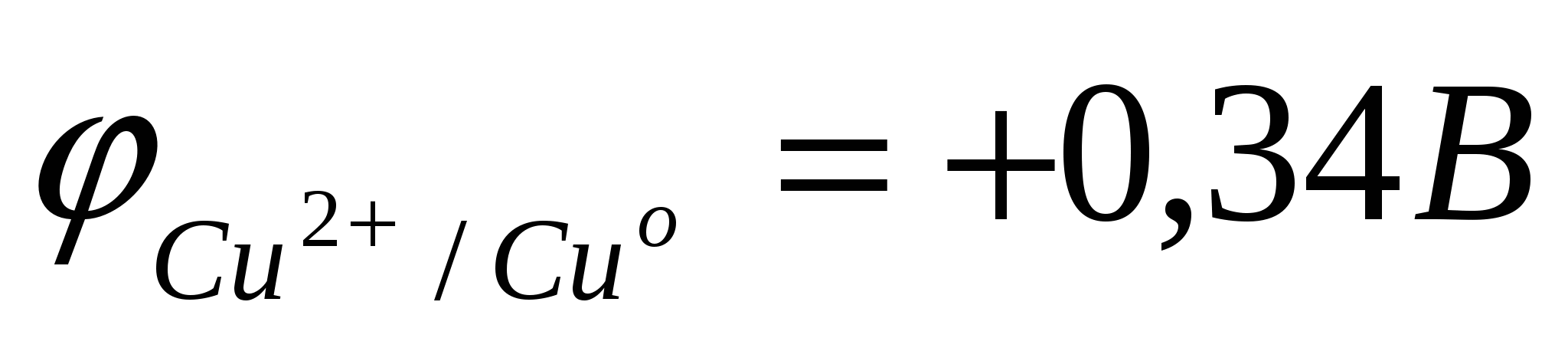 . .
В результате, равновесие на Zn-пластине смещается вправо, идет окисление металлического цинка.
На Cu-пластине равновесие смещается влево, протекает восстановление ионов меди (II).
Анод Zn(тв.) – 2e → Zn2+(р-р) (процесс окисления)
Катод Cu2+(р-р) + 2e → Сuo(тв.) (процесс восстановления)

Ионное
уравнение Zn(тв.) + Cu2+(р-р) → Zn2+(р-р) + Cuo(тв.)
суммарной реакции
Молекулярное Zn + Cu(NO3)2 → Zn(NO3)2 + Cu
уравнение суммарной реакции
Между растворами электролитов также возникает разность потенциалов. В цинковом полуэлементе в результате растворения цинка увеличивается концентрация ионов Zn2+, в растворе создается избыток положительно заряженных ионов. В медном полуэлементе в результате осаждения меди концентрация ионов Cu2+ уменьшается и в растворе создается избыток отрицательно заряженных ионов. По внутренней цепи – «солевому мостику» – катионы и анионы перемещаются навстречу друг другу. Таким образом, в системе возникает направленное перемещение заряженных частиц, т.е. возникает электрический ток.
Электродвижущая сила – ЭДС – гальванического элемента определяется разностью потенциалов катода и анода
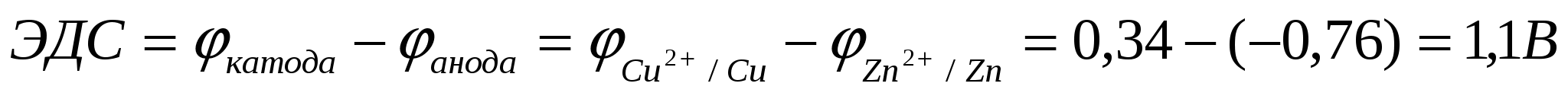 > 0 > 0
По мере работы гальванического элемента значения потенциалов катода и анода изменяются.
Поскольку молярная концентрация ионов Cu2+ – уменьшается, в соответствии с уравнением Нернста уменьшается потенциал катода
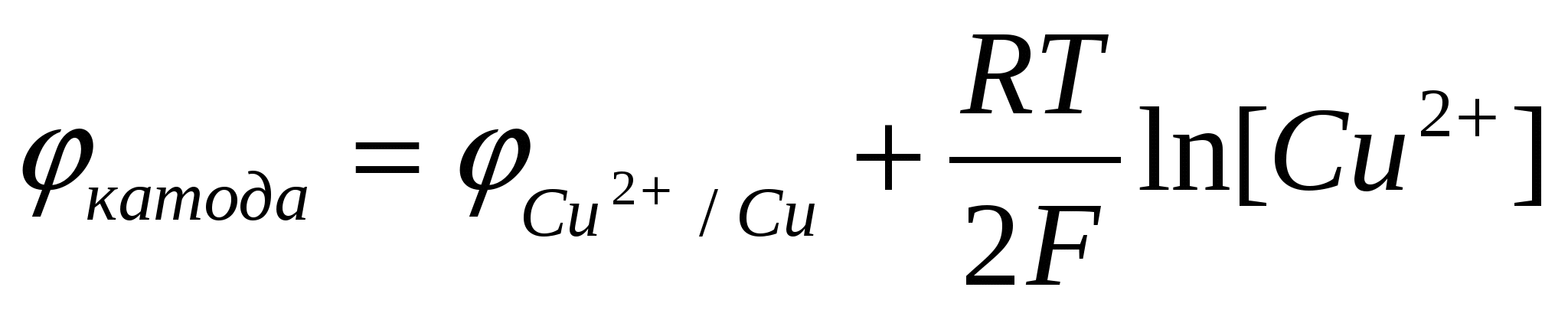 . .
Молярная концентрация ионов Zn2+– [Zn2+] – увеличивается, следовательно, увеличивается потенциал анода
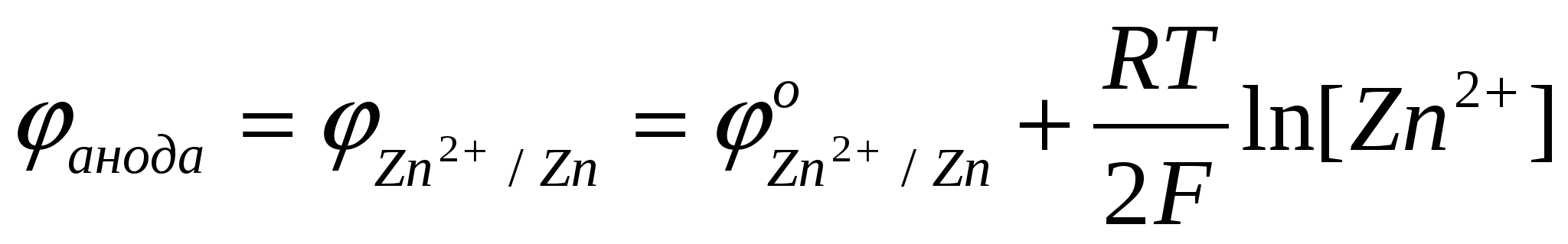 . .
Таким образом, по мере работы гальванического элемента ЭДС уменьшается, так как происходящие на электродах процессы приводят к выравниванию потенциалов. Система приходит в равновесие и гальванический элемент прекращает работу при условии
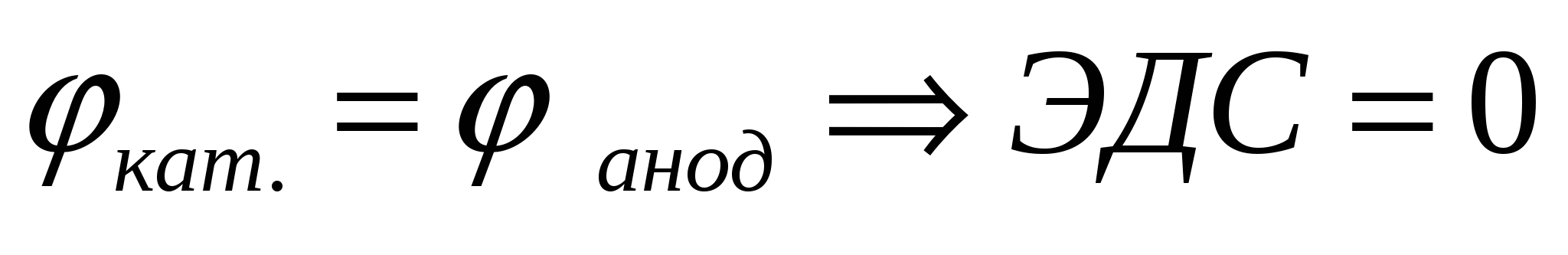 |
|
|
 Скачать 1.87 Mb.
Скачать 1.87 Mb.




 внешняя цепь (металлический проводник)
внешняя цепь (металлический проводник)


 внутренняя цепь
внутренняя цепь