ответы. основы энергетики. Ответы к экзаменационным вопросам по предмету Основы энергетики
 Скачать 0.74 Mb. Скачать 0.74 Mb.
|
|
Ответы к экзаменационным вопросам по предмету Основы энергетики 1. Единая электроэнергетическая система, назначение. Единая энергетическая система России (ЕЭС России) — электроэнергетическая система, которая расположена в пределах территории Российской Федерации и централизованное оперативно-диспетчерское управление которой осуществляется системным оператором Единой энергетической системы России. Электроэнергетическая система - совокупность объектов электроэнергетики и энергопринимающих установок потребителей электрической энергии, связанных общим режимом работы в едином технологическом процессе производства, передачи и потребления электрической энергии в условиях централизованного оперативно-диспетчерского управления в электроэнергетике. ЕЭС России охватывает практически всю обжитую территорию страны и является крупнейшим в мире централизованно управляемым энергообъединением. В настоящее время ЕЭС России включает в себя 70 энергосистем на территории 81 субъектов Российской Федерации, работающих в составе шести работающих параллельно ОЭС — ОЭС Центра, Юга, Северо-Запада, Средней Волги, Урала и Сибири и ОЭС Востока, работающей изолированно от ЕЭС России. Кроме того, ЕЭС России осуществляет параллельную работу с ОЭС Украины, ОЭС Казахстана, ОЭС Белоруссии, энергосистемами Эстонии, Латвии, Литвы, Грузии и Азербайджана, а также с NORDEL (связь с Финляндией через вставку постоянного тока в Выборге). Энергосистемы Белоруссии, России, Эстонии, Латвии и Литвы образуют так называемое «Электрическое кольцо БРЭЛЛ», работа которого координируется в рамках подписанного в 2001 году Соглашения о параллельной работе энергосистем БРЭЛЛ. Эстония, Латвия и Литва провели ряд консультаций и в сентябре 2017 года приняли решение о выходе из БРЭЛЛ к 2025 году. Системный оператор выделяет три крупных независимых энергообъединения в Европе — Северную (NORDEL), Западную (UCTE) и Восточную (ЕЭС/ОЭС) синхронные зоны (NORDEL и UCTE в июле 2009 года вошли в состав нового европейского объединения — ENTSO-E). Под ЕЭС/ОЭС понимается ЕЭС России в совокупности с энергосистемами стран СНГ, Прибалтики и Монголии. Параллельная работа электростанций в масштабе Единой энергосистемы позволяет реализовать следующие преимущества: снижение суммарного максимума нагрузки ЕЭС России на 5 ГВт; сокращение потребности в установленной мощности электростанций на 10-12 ГВт; оптимизация распределения нагрузки между электростанциями в целях сокращения расхода топлива; применение высокоэффективного крупноблочного генерирующего оборудования; поддержание высокого уровня надёжности и отказоустойчивости энергетических объединений. Совместная работа электростанций в Единой энергосистеме обеспечивает возможность установки на электростанциях агрегатов наибольшей единичной мощности, которая может быть изготовлена промышленностью, и укрупнения электростанций. Увеличение единичной мощности агрегатов и установленной мощности электростанций имеет значительный экономический эффект. 2-3. Топливо. Классификация, элементарный состав Органическое ископаемое топливо (твердое, жидкое, газообразное) является в настоящее время и будет, по прогнозам специалистов, в ближайшие десятилетия основным источником энергии (теплоты) для промышленного использования, а также основным источником энергии для транспортных и стационарных двигателей. Классификация топлив. Под топливом понимают вещества, выделяющие в результате тех или иных преобразований тепловую энергию, которая используется в технических целях. По принципу выделения энергии различают две группы топлив: химическое, выделяющее энергию в результате окисления горючих элементов, и ядерное, выделяющее энергию при делении ядер. В настоящее время в мире преимущественно используется химическое, или органическое, топливо, являющееся источником около 70% всей вырабатываемой энергии. При использовании топлив находят применение как выделяемая энергия — теплота, так и химические свойства топлив. Поэтому последние могут быть разделены на энергетические и технологические. Энергетическое топливо предназначено для сжигания с целью непосредственного получения тепловой энергии или ее преобразования в механическую и (или) электрическую энергию. Технологическое топливо используется для ведения высокотемпературных технологических процессов (нагрев, обжиг, плавление и др.) и химической переработки для получения искусственного топлива (кокс) и технических продуктов (например, при сжигании кокса в доменных печах используются восстановительные свойства углерода). По агрегатному состоянию все топлива делятся на твердые, жидкие и газообразные, а по способу получения или добычи — на природные и производные (искусственные). Кроме древесины, все виды природных топлив представляют собой горючие ископаемые. Искусственное топливо получают путем переработки природного. Методы переработки весьма разнообразны и зависят от характеристики и назначения конечного продукта. В основе методов переработки лежат физико-механические воздействия на исходный продукт: дробление, помол, нагрев, перегонка и т.д. Элементарный состав топлив. При проведении химического анализа топлива определяются доли различных химических элементов и веществ, его составляющих, т.е. элементарный состав. Органическое топливо состоит из сложных соединений различных элементов: углерода (С), водорода (Н), кислорода (О), азота (N), серы (S) и др., а также балласта в виде минеральных компонентов (Л), не участвующих в процессе горения и способствующих образованию золы, и влаги ( W). Все виды топлив состоят из горючей и негорючей частей (балласта). К горючим элементам относится углерод, водород и горючая сера, к негорючей части — кислород, азот, влага, зола и негорючая сера. Углерод (С) является главной горючей составляющей всех топлив. При полном сгорании углерода тепловыделение составляет 33,5 * 103 кДж/кг. Тепловая ценность топлива определяется содержанием в нем углерода. Так, в древесине и торфе доля углерода достигает 58%, в угле и мазуте — до 90%. При термохимической переработке топлив углерод служит основой для образования вторичных органических веществ и составляет основную часть важного искусственного технологического топлива — кокса. Водород (Н) — вторая важнейшая горючая составляющая любого топлива. Тепловыделение при его сгорании зависит от агрегатного состояния (жидкое или парообразное) конечного продукта горения водорода — воды — и может достигать 142-103 кДж/кг. С увеличением возраста твердого топлива содержание в нем водорода падает. Кислород (О) — является балластной примесью в топливе, так как снижает его тепловую ценность. Кроме того, он связывает в топливе водород, обесценивая и его. В твердых топливах с небольшим химическим возрастом содержание кислорода может достигать 30% и выше, а в большинстве жидких моторных топлив оно не превышает 1,5%. Азот (N) также балластирует топливо, снижая содержание в нем горючих веществ. В составе твердого топлива его содержится до 1,5%, в жидких — менее 1%. Сера (S) входит в топливо в трех видах: • сера органическая (Sopr), входящая в состав органических соединений, содержащихся в топливе; • сера колчеданная (SK), входящая в состав сульфидов, главным образом пирита и марказита (FeS2); • сера сульфатная (Sc), входящая в состав сульфатов, например CaS04, MgS04, FeS04 и др. Сульфатная сера в горении топлива не участвует, так как уже находится в соединении с кислородом. В связи с этим она включается во внешний негорючий остаток — золу. Сера является вредной составляющей топлива, так как при ее сгорании образуются оксиды: сернистый ангидрид (S02) и серный ангидрид (S03). Выбросы S02 и S03 в атмосферу оказывают негативное влияние на окружающую среду. Особенно вреден оксид серы S03, который, соединяясь с влагой, дает в качестве конечного продукта серную кислоту. Она вызывает интенсивную коррозию металла котельных агрегатов, двигателей внутреннего сгорания, строительных конструкций и т.д. Минеральные (негорючие) компоненты {А) являются главной балластной составляющей топлива, входящей в состав остаточного продукта полного сгорания топлива — золы. В состав золы входят как вещества, образующие минеральную часть топлива, так и продукты их разложения и окисления. Содержание минеральных компонентов в твердых топливах колеблется в очень широких пределах: от 1—2% в древесине до 70% в сланцах, в жидких топливах — до 1%. Количество минеральных компонентов в топливе определяет его зольность, т.е. способность образовывать в процессе сжигания золу. Основной характеристикой золы является температура плавления, зависящая от ее состава. Топлива с большим содержанием минеральных компонентов нецелесообразно перевозить на большие расстояния. Влага (И7), так же как минеральные компоненты, — балласт, снижающий тепловую ценность топлива и определяющий целесообразность его транспортировки на большие расстояния. На испарение влаги тратится часть теплоты, выделяющейся при сгорании топлива, что понижает температурный уровень процесса горения. При этом снижается значение температуры точки росы водяных паров, содержащихся в продуктах сгорания, и увеличивается опасность низкотемпературной коррозии. Доля влаги в составе топлива колеблется в широких пределах: от 0,3—1,5% в мазуте до 5% в каменных углях и до 5—20% в торфах и бурых углях. Элементарный состав горючих газов можно представить так же, как и элементарный состав твердых и жидких топлив. Однако для удобства анализа и расчетов процесса горения газов их состав обычно представляют в виде суммы объемных долей горючих компонентов и балластных примесей в процентах, определяемых при нормальных условиях без учета водяных паров, т.е. на сухую массу топлива. В состав природных газов в качестве горючих элементов входят метан (СН4) — до 98,9%, углеводороды метанового ряда (от 0,3 до 10%) — этан (С9Н6), пропан (С3Н8), бутан (С4Н10) и др., а также, в виде следов, сероводород (H2S). Балластом являются азот (N2), углекислый газ (С02) и водяные пары (Н20). В попутных газах нефтяных месторождений содержание метана ниже (до 45%), однако возрастает доля тяжелых углеводородов (до 40%). Искусственные газы в качестве горючих компонентов содержат водород, метан, оксид углерода (СО) и небольшое количество тяжелых углеводородов (в коксовом газе). Балластными примесями в искусственных газах являются С02, N2, водяные пары и пыль. Влагосодержание газообразных топлив W, кг/м3, колеблется в зависимости от состояния топлива. Состояния топлива. Содержание химических элементов и других составляющих топлива исчисляется в процентах от единицы массы или объема исходя из определенной части (массы) топлива. В зависимости от состояния топлива различают рабочую, аналитическую (воздушно-сухую), сухую и другие массы топлива. Каждой массе присваивается соответствующий индекс: рабочей — «р», аналитической — «а», сухой — «с», горючей - «г», органической — «о». Для твердых топлив применимы все пять масс. 4. Тепловые эффекты реакции горения Энтальпией горения (DНгор, кДж/моль) вещества называется тепловой эффект реакции окисления 1 моль горючего вещества с образованием высших оксидов. Теплота горения (Qгор) численно равна энтальпии горения, но противоположна по знаку. Для индивидуальных веществ тепловой эффект реакции может быть рассчитан по I следствию закона Гесса.
1. Запишем уравнение реакции горения бутана. С4Н10 + 6,5(О2 +3,76 N2) = 4СО2 + 5Н2О + 6,5×3,76 N2 2. Выражение для теплового эффекта этой реакции по I следствию закона Гесса DН0р-и = 4DН0(СО2) + 5DН0(Н2О) - DН0(С4Н10). 3. По таблице 1 приложения находим значения энтальпий образования углекислого газа, воды (газообразной) и бутана. DН0(СО2) = -393,5 кДж/моль; DН0(Н2О) = - 241,8 кДж/моль; DН0(С4Н10) = - 126, 2 кДж/моль. Подставляем эти значения в выражение для теплового эффекта реакции DН0р-и = 4×(–393,5) + 5×(–241,8) – (- 126,2) = - 2656,8 кДж DН0р-и = DН0гор = - 1656,8 кДж/моль или Qгор = + 2656,8 кДж/моль. Таким образом, при сгорании 1 моля бутана выделяется 2656,8 кДж тепла. В пожарно-технических расчетах часто пользуются понятием удельной теплоты горения. Удельная теплота горения – это количество теплоты, которое выделяется при полном сгорании единицы массы или объема горючего вещества. Размерность удельной теплоты горения – кДж/кг или кДж/м3. В зависимости от агрегатного состояния воды в продуктах горения различают низшую и высшую теплоту горения. Если вода находится в парообразном состоянии, то теплоту горения называют низшей теплотой горения Qн. Если пары воды конденсируются в жидкость, то теплота горения – высшая Qв. Температура пламени достигает 100 К и выше, а вода кипит при 373 К, поэтому в продуктах горения на пожаре вода всегда находится в парообразном состоянии, и для расчетов в пожарном деле используется низшая теплота горения Qн. Низшая теплота горения индивидуальных веществ может быть определена переводом значения DНгор, кДж/моль в Qн, кДж/кг или кДж/м3. Для веществ сложного элементного состава низшая теплота горения может быть определена по формуле Д.И. Менделеева. Кроме того, для многих веществ значения низшей теплоты горения приведены в справочной литературе [ ], некоторые данные представлены в приложении 2.
Значение DНгор = - 2256,3 кДж/моль показывает, что при сгорании 1 моля этилацетата выделяется 2256,3 кДж тепла, т.е. Qгор= + 2256,3 кДж/моль. 1 моль СН3СООС2Н5 имеет массу 88 г. Можно составить пропорцию М (СН3СООС2Н5) = 88 г/моль ¾ Qгор= 2256,3 кДж/моль 1 кг = 1000 г ¾ Qн кДж/кг В общем виде формула для перевода из размерности кДж/моль в кДж/кг выглядит следующим образом: 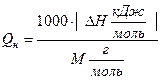 ; кДж/кг (2) ; кДж/кг (2)Если необходимо осуществить перевод из размерности кДж/моль в кДж/м3, то можно воспользоваться формулой 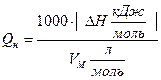 , кДж/м3. (3) , кДж/м3. (3)
Значения низшей теплоты сгорания веществ и материалов могут быть рассчитаны по формуле Д.И.Менделеева. Данная формула может быть использована для расчетов Qн веществ сложного элементного состава, а также для любых индивидуальных веществ, если предварительно рассчитать массовую долю каждого элемента в соединении (w). QН = 339,4×w(C) + 1257×w(H) - 108,9 [(w(O) +w(N)) -w(S)] - 25,1[9×w(H) +w(W)], кДж/кг, (4) где w (С), w (Н), w (S), w (О),w (N) – – массовые доли элементов в веществе, %; w (W) – содержание влаги в веществе, %. 1. Для того, чтобы воспользоваться данной формулой, необходим расчет процентного состава каждого элемента в веществе (массовой доли). Молярная масса сульфадимезина С12Н14О2N4S составляет 278 г/моль. w(C) = (12×12)/278 = 144/278 = 0,518 ×100 = 51,8 % w(H) = (1×14)/278 = 14/278 = 0,05 ×100 = 5,0 % w(O) = (16×2)/278 = 32/278 = 0,115 ×100 = 11,5 % w(N) = (14×4)/278 = 56/278 = 0,202 ×100 = 20,2 % w(S) = 100 – (51,8 + 5,0 + 11,5 + 20,2) = 11,5 % 2. Подставляем найденные значения в формулу Д.И. Менделеева. QН = 339,4×51,8+1257×5,0-108,9×(11,5+20,2-11,5)-25,1×9×5,0 = 22741 кДж/кг. Теплота горения смеси газов и паров определяется как сумма произведений теплот горения каждого горючего компонента (Qн = Qгор) на его объемную долю в смеси (jоб): Qн= Можно воспользоваться эмпирической формулой для расчета Qн для газовой смеси: Qн = 126,5×j(СО) + 107,7×j(Н2) + 358,2×j(СН4) + 590,8×j(С2Н4) + 636,9×j(С2Н6) + + 913,4×j(С3Н8) + 1185,8×j(С4Н10) + 1462,3×j(С5Н12) + 234,6×j(Н2S), кДж/м3 (6) 5. Теория теплообмена Теория теплопередачи рассматривает процессы передачи тепла из одной части пространства в другую. Процесс теплообмена наблюдается тогда, когда тепло передается от одного, более нагретого тела, к другому, менее нагретому. Поток энергии, передаваемый частицами более нагретого тела частицам менее нагретого, называется тепловым потоком. Таким образом, для того чтобы происходил процесс передачи тепла от одного тела к другому, совершенно необходима разность температур тел, участвующих в теплообмене. Следовательно, тепловой поток всегда направлен в сторону меньших температур и, являясь величиной векторной, характеризуется не только абсолютной величиной, но и направлением. Температура, являясь величиной скалярной, не зависит от направления и характеризуется лишь абсолютной величиной. Температура характеризует степень нагретости тела и измеряется в градусах стоградусной или абсолютной температурной шкалы. Процесс передачи тепла развивается как во времени, так и в пространстве. Практически часто бывает необходимо знать температуру в различных точках изучаемого пространства в один и тот же момент времени. Подобное распределение температур называется полем температур или температурным полем. Кроме изменения в пространстве, температурное поле и поле тепловых потоков может изменяться также и во времени. Таким образом, в общем случае температура Т может являться функцией координат х, у, г и времени т, т. е. Т=f(х, у, г, т). Если температура (тепловой поток) с течением времени не претерпевает никаких изменении, то говорят о «стационарном тепловом состоянии». Если же температура изменяется со временем, то такой процесс называется нестационарным. Различают полный и удельный тепловые потоки. Полный тепловой поток Q обычно относится к единице времени и измеряется в ваттах (Вт). Тепловой поток, отнесенный к единице поверхности, называется плотностью теплового потока q (Вт/м2). Таким образом, если F теплопередающая поверхность (м2), то Q = q F. (25) Иногда Q обозначает полное количество переданного тепла и выражается в джоулях (Дж) и тогда Q =qτF. (26) где τ — время, с. Различают три основных вида передачи тепла: конвекцию, теплопроводность, тепловое излучение. Конвективным теплообменом называют такой процесс, когда движущаяся жидкость или газ переносит тепло из более нагретых областей в менее нагретые. В технике чаще всего рассматривают конвективный теплообмен жидкости или газа с поверхностью твердых тел, при котором тепло транспортируется к поверхности (или от нее) движущимися объемами жидкости или газа. Если нет движения жидкости (газа), то нет и передачи тепла конвекцией. Теплопроводность — передача тепла от одних частей тела к другим без заметного перемещения частиц. Передача тепла теплопроводностью наиболее характерно осуществляется в гомогенных непрозрачных твердых телах. В металлургической практике процессы передачи тепла теплопроводностью лежат в основе теории и практики нагрева металла. Передача тепла теплопроводностью возможна как при стационарном состоянии, так и при нестационарном. При стационарном состоянии передача тепла от одной точки пространства к другой происходит без изменения их температуры во времени. При нестационарном состоянии происходит изменение температуры тела во времени, т. е. тело или нагревается, или остывает. При этом его энтальпия или растет, или убывает, причем тело тем быстрее нагревается, чем выше его теплопроводность. Однако на интенсивность изменения энтальпии тела наряду с теплопроводностью тела оказывает влияние и величина теплоемкости тела. Но влияние это обратное. Чем выше теплоемкость тела, тем медленнее оно изменяет энтальпию и температуру. Таким образом, энтальпия тела изменяется тем быстрее, чем выше способность материала проводить тепло, т. е. чем больше коэффициент теплопроводности λ. Вместе с тем скорость изменения энтальпии тела обратно пропорциональна его аккумулирующей способности, которая определяется массовой теплоемкостью ρс. Таким образом, в общем, скорость изменения энтальпии тела определяется соотношением величин λ и ρс, совместное влияние которых на нагрев или охлаждение тела выражается изменением коэффициента температуропроводности а = λ /(ρс) м2/с, имеющим важное значение для нестационарных процессов передачи тепла теплопроводностью. Природа теплового излучения принципиально отличается от передачи тепла конвекцией и теплопроводностью, при которых переход тепла связан с передачей энергии молекулами, образующими твердую, жидкую или газообразную среду. При тепловом излучении энергия передается электромагнитными волнами определенной длины (инфракрасные лучи). Тепловое излучение возможно даже в вакууме; оно не зависит от температуры окружающей среды. Чтобы решить дифференциальные уравнения для конкретного случая, необходимо, кроме основного дифференциального уравнения, сформулировать дополнительные условия, характерные только для этого случая, которые называют краевыми условиями. Начальные краевые условия показывают температурное состояние тела перед тем, как начался процесс нагрева. Это температурное состояние может быть различным, но оно обязательно должно быть задано в виде уравнения (в общем виде), дающего распределение температуры в теле по трем осям координат, т.е. при τ = 0 и Тнач=f(х, у, г). Наиболее простые и часто встречающиеся на практике временные условия показывают, что температура во всех точках тела в начальный момент времени одинакова, т. е. при τ = 0 Тнач=const. В 1807 году французский ученый Фурье доказал экспериментально, что во всякой точке тела (вещества) в процессе теплопроводности присуща однозначная взаимосвязь между тепловым потоком и градиентом температуры: где Q – тепловой поток, выражается в Вт; grad(T) – градиент температурного поля (совокупности числовых значений температуры в разнообразных местах системы в выбранный момент времени), единицы измерения К/м; S – площадь поверхности теплообмена, м2; λ – коэффициент теплопроводности, Вт/(м К). Градиент температуры получится характеризовать в виде векторной суммы составляющих по осям декартовых координат: 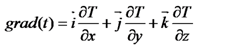 , ,где i, j, k – ортогональные между собой единичные векторы, нацеленные по координатным осям. Значит, данный закон устанавливает величину теплового потока при переносе тепла посредством теплопроводности. Закон Фурье для поверхностной плотности теплового потока принимает вид: Знак «минус» обозначает, что векторы теплового потока и градиента температуры разнонаправленные. Следует понимать, что теплота передается в направлении спада температуры. И все же не лишним будет указать, что закон Фурье не принимает в расчет инерционность процесса теплопроводности, иначе говоря, в представленной модели колебание температуры в любой точке мгновенно распространяется на всё тело. Закон Фурье некорректно применять для характеристики высокочастотных процессов таких как, к примеру, распространение ультразвука, ударной волны. 6. Вывод основного уравнения теплопроводности Рассмотрим однородный стержень (под стержнем в механике понимается тело с одним превалирующим линейным размером, например, столб можно рассматривать как стержень с переменным сечением) постоянного поперечного сечения S и длины l, теплоизолированный с боков, ось которого примем за ось Ох (рис. 4.3). Обозначим через U(x,t) Пусть 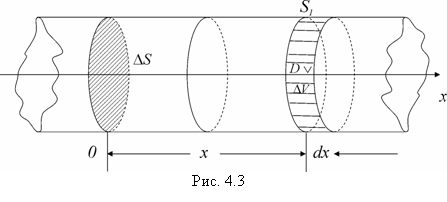 Тепловой режим на концах стержня может быть весьма разнообразен, т.е. температура может быть и постоянной, и изменяться, например, по законам: 1) концы стержня поддерживаются при постоянной нулевой температуре: |
