практика. Патофизиологии. Предмет и задачи
 Скачать 104.66 Kb. Скачать 104.66 Kb.
|
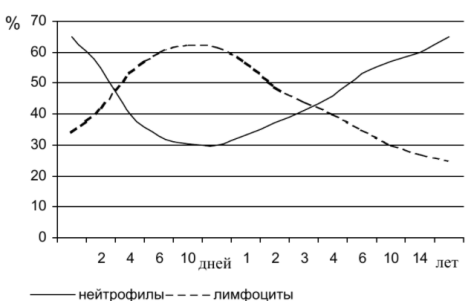 нейтрофилов приходится 68%, а на долю лимфоцитов — 25%; на 5-6-й день после рождения возникает, так называемый, «первый перекрест» — нейтрофилов становится меньше (до 45%), а лимфоцитов — больше (до 40%) (рис. 8). Такое соотношение сохраняется примерно до 5-б лет («второй перекрест»). Например, на 2—3 месяц доля нейтрофилов составляет 25— 27%, а доля лимфоцитов — 60—63%. Это указывает на существенное повышение интенсивности специфического иммунитета у детей первых 5—6 лет. Малым содержанием нейтрофилов, а также недостаточной их зрелостью и фагоцитарной активностью отчасти объясняется большая восприимчивость детей младших возрастов к инфекционным заболеваниям. После 5—6 лет постепенно, к 15 годам, соотношение, характерное для взрослых, восстанавливается. 8.врожденные формы нейтропении Врожденные нейтропении – это группа наследственных патологий, которые передаются по аутосомно-доминантному или аутосомно-рецессивному типу и проявляются уменьшением количества нейтрофилов в периферической крови. Синдром Костмана. В основе заболевания лежит ранний апоптоз и отсутствие в периферической крови зрелых форм нейтрофильных лейкоцитов. В костном мозге определяются пролиферирующие клетки до миелоцитов. Характеризуется тяжелой клинической картиной уже на первых месяцах жизни. Циклическая нейтропения. Данная форма врожденной нейтропении проявляется недостаточным гранулоцитопоэзом, который имеет повторяющийся характер. Клинические симптомы возникают одновременно с эпизодами агранулоцитоза. Семейная доброкачественная нейтропения. В основе этой формы врожденной нейтропении лежит нарушение дозревания нейтрофильных гранулоцитов. Клинически проявляется редко. Специфического лечения не требует. Синдром «ленивых лейкоцитов». Суть заболевания заключается в нарушении хемотаксиса нейтрофилов. Проявляется частыми воспалительными заболеваниями уже с младенчества. 9. особенности системы гемостаза 1 В первые минуты и часы жизни ребенка преобладают прокоагулянтные и проагрегантные влияния. 2 В раннем неонатальном периоде новорожденные склонны как к тромботическим, так и к геморрагическим осложнениям. 3 Сосудисто-тромбоцитарное звено гемостаза у здоровых доношенных характеризуется повышенной проницаемостью и хрупкостью сосудистой стенки, нормальным количеством тромбоцитов и их активацией при рождении, с последующим (к концу первых суток жизни) снижением их количества и функциональной активности. 4 Коагуляционное звено гемостаза характеризуется тенденцией к гиперкоагуляции при наличии транзиторной (в пределах первого часа жизни) резко повышенной активности фибринолиза, существенными различиями между показателями пуповинной и венозной крови в первые сутки жизни, разнонаправленностью тромбоцитарного и плазменного компонентов гемостаза, сочетающихся с повышенной свертываемостью цельной крови. 5 Вариабельность большинства гемостатических параметров у одного и того же здорового доношенного новорожденного в раннем неонатальном периоде является физиологическим явлением, обеспечивающим адаптацию всех систем к внеутробной жизни. 6 Наибольшей напряженностью системы гемостаза с выраженной склонностью к гипокоагуляции (как плазменного, так и клеточного звена) характеризуются третьи сутки жизни ребенка, что является биологически целесообразным явлением, так как обеспечивает микроциркуляцию в условиях гемодинамической адаптации. 7 На состояние системы гемостаза у новорожденных влияют сроки перевязки пуповины и прикладывания ребенка к груди. Поздняя (после перекачивания крови из плацентарных сосудов в кровоток ребенка) перевязка пуповины и раннее прикладывание к груди (в первые 2 часа после родов) уменьшают послеродовую депрессию компонентов свертывающей системы крови. 8 Недоношенные новорожденные склонны к кровоточивости как во внутриутробном, так и в интранатальном периодах, причем эта тенденция продолжает нарастать сразу же после рождения ребенка и первые дни его жизни, с усугублением на фоне различных патологических состояний, развивающихся у этих новорожденных в результате действия перинатальной гипоксии. При этом у части таких детей из-за низкой активности фибринолиза и антикоагулянтов, а также развития декомпенсированного ДВС-синдрома возможно сочетание ковоточивости с тромбозами. 10. Гемолитическая болезнь новорождённых Гемолитическая болезнь новорождённых (ГБН) — заболевание, в основе которого лежит гемолиз эритроцитов плода и новорождённого, связанный с несовместимостью крови матери и плода по эритроцитарным антигенам (Аг). Этиология ГБН развивается преимущественно в результате несовместимости крови матери и плода по резус-фактору (Rh-фактору) или групповым Аг, реже — по другим антигенным системам из-за их меньшей иммуногенности. − Rh-конфликт возникает, если у Rh-отрицательной женщины плод имеет Rh- положительную кровь. − АВ0-конфликт развивается при наличии 0 (I) группы крови у женщины, а у плода — А (II) (в 2/3 случаев) или B (III) (в 1/3 случаев). Патогенез. Резус-фактор, антиген А или В эритроцитов плода, попадая через плаценту в кровь матери, вызывают образование антител. Антитела проникают через плацентарный барьер и фиксируются на эритроцитах ребенка (рис. 26). Разрушение эритроцитов приводит к развитию гипербилиру- бинемии и анемии. Образовавшийся вследствие распада эритроцитов неконъюгированный (свободный) билирубин (НБ) в обычных условиях превращается в печени в конъюгированный (связанный) билирубин и выделяется в кишечник. Если скорость разрушения эритроцитов превышает способность печени обезвреживать токсичный НБ, он накапливается в кровеносном русле и приводит к развитию желтухи. НБ является нейротоксичным ядом и, достигая критического уровня (свыше 310-340 мкмоль/л у доношенных и свыше 200 мкмоль/л у недоношенных), проходит через гематоэнцефалический барьер Различают три формы заболевания: отечную (2%), желтушную (88%) и анемическую (10%). Отечная форма - самая тяжелая. Плод погибает внутриутробно или рождается недоношенным. Дети маложизнеспособны. Отмечаются выраженные отеки всех тканей, бледность кожных покровов и слизистых оболочек. В серозных полостях выявляют скопление транссудата. Печень и селезенка резко увеличены,В анализе крови - значительное снижение гемоглобина и эритроцитов. Плацента обычно увеличена, отечна. Желтушная форма заболевания встречается наиболее часто. Основными ее симптомами являются ранняя желтуха, анемия, увеличение печени и селезенки, в тяжелых случаях - геморрагический синдром и поражение ЦНС.: вялости, сонливости, угнетению физиологических рефлексов, снижению тонуса мышц. Появляются симптомы ядерной желтухи: ригидность затылочных мышц, тонические судороги, напряжение большого родничка, пронзительный крик, симптом «заходящего солнца». Иногда развиваются лихорадка центрального происхождения, расстройства дыхания и нарушения сердечной деятельности. Моча ребенка окрашивается в интенсивный темный цвет, окраска стула не изменяется. Иногда к концу 1-й недели у больных может нарушиться выделение желчи в кишечник - развивается холестаз (синдром сгущения желчи). Кожа приобретает зеленоватый оттенок, кал обесцвечивается, моча темнеет, в крови повышается содержание прямого билирубина. Анемическая форма по течению наиболее доброкачественная. Клинически проявляется сразу после рождения или в течение 1-3-й недель жизни. Отмечаются бледность кожных покровов, иногда с легкой иктеричностью, небольшое увеличение печени, реже селезенки. Дети вялые, плохо сосут грудь.В крови выявляется снижение гемоглобина и эритроцитов с увеличением незрелых форм. Уровень билирубина повышен незначительно. 11.особенности наследственных коагулопатий Наследственные коагулопатии у новорожденных диагностируют редко. Характер геморрагического синдрома, проявляющийся при гемофилии в периоде новорожденности, существенных отличий от других коагулопатий новорожденных не имеет. Самые распространенные наследственные коагулопатии — гемофилии. Гемофилия А (85% от всех форм гемофилий) — аномалия VIII фактора (антигемофильный глобулин А). Наследуется рецессивно, сцеплено с Х-хромосомой, болеют мужчины, а женщины являются носительницами патологического гена. При данной патологии формируется нарушение внутреннего механизма образования протромбиназы. Проявления: подкожные, внутримышечные и внутрисуставные кровоизлияния. Гемофилия В (болезнь Кристмаса, 10% от всех форм гемофилий) — дефицит IX фактора. Наследуется рецессивно, сцеплено с Х-хромосомой. Также приводит к нарушению внуттреннего пути образования протромбиназы. Проявления те же, что и при гемофилии А. 12.геморрагическая болезнь Геморрагическая болезнь новорожденных Геморрагическая болезнь новорожденных — К-витаминодефицитный геморрагический синдром, развивающийся у 0,25-0,5% детей. Умеренное уменьшение факторов II, VII, IX и X обычно характерно для большинства новорожденных в возрасте 48- 72 ч. Постепенно эти факторы достигают исходных уровней к 7-10-му дню жизни. Такой транзиторный дефицит К-витаминзависимых факторов формируется при отсутствии свободного витамина К у беременной, незрелости печени новорожденного и отсутствии бактериальной кишечной флоры, синтезирующей этот витамин. Иногда у доношенных, а чаще у недоношенных, новорожденных уровень витамина К продолжает снижаться и усиливается его дефицит на 2-5-й день жизни, что приводит к спонтанным и длительным кровотечениям. Поскольку в грудном молоке содержится меньше, чем в коровьем, витамина К, то геморрагии чаще наблюдаются у детей, находящихся на грудном вскармливании. Геморрагическая болезнь новорожденных вследствие острого транзиторного дефицита К-витаминзависимых факторов проявляется кровотечениями из желудочнокишечного тракта, носа, а так же внутричерепными кровотечениями или начинающимися после обрезания. При этом протромбиновое время, время свертывания крови и рекальцификации плазмы удлинено, а уровни протромбина и факторов VII, IX и X значительно снижены. 13.Двс синдром Синдром диссеминированного внутрисосудистого свертывания крови (синдром ДВС) является частым и тяжелым осложнением разнообразных патологических процессов перинатального периода и периода новорожденности. Он наблюдается в 36-50% всех случаев перинатальной смерти. Этиология У доношенных новорожденных его развитию могут способствовать следующие условия: − недоразвитость РЭС, приводящая к не полному удалению промежуточных продуктов коагуляции; − недостаточность микроциркуляторного русла; − недостаточный синтез печеночных факторов свертывания, противосвертывания, фибринолиза (фибриногена, витамин-К-зависимых факторов, антитромбина III, плазминогена) вследствие незрелости бслково-синтетической функции печени. Факторы риска развития ДВС-синдрома у новорожденных: − заболевания матери (нефрит, диабет, пороки сердца); − токсикоз беременных; − длительная асфиксия плода; − патология родов (отслойка плаценты, обвитие пуповины); − недоношенность; − тяжелый резус-конфликт, сопровождающийся гемолизом; − инфекции, особенно вызванные граммотрицательной микрофлорой; − синдром дыхательных расстройств (болезнь гиалиновых мембран; гиалиновые мембраны образованы сгустками фибрина, следовательно, развивается гипокоагуляция). Патогенез У недоношенных детей, детей с задержкой внутриутробного развития плода, у детей, развивавшихся внутриутробно на фоне хронической гипоксии, при рождении выявляются: − более низкие величины активности как прокоагулянтов, так и антикоагулянтов; − более активный фибринолиз при более низком уровне плазминогена; − повышенная агрегационная активность тромбоцитов; − большая проницаемость и хрупкость сосудистой стенки. Эти дети склонны как к повышенной кровоточивости, так и тромбозам из-за быстрого истощения фибринолиза и антикоагулянтов в первые же часы и дни жизни. Гипоксия, которая сопровождается ацидозом и снижением периферической перфузии, приводит к развитию синдрома ДВС путем высвобождения тканевого фактора из поврежденных лейкоцитов и клеток эндотелия. Этот механизм играет в данном случае более важную роль, чем тромбоцитарное звено гемостаза или внутренний путь активации свертывания, при гипоксии имеет значение также снижение синтеза факторов свертывания крови печенью из-за ее гипоксического повреждения. ДВС возникает на фоне гемолиза эритроцитов с освобождением тромбопластина, а также под влиянием образования непрямого билирубина, способствующего нарушению обменных и окислительных процессов в тканях и нарушению сосудистой проницаемости. У новорожденных от матерей с различными формами гестозов, родившихся в асфиксии, у новорожденных с полицитемическим синдромом обычно формируется гипервязкость крови, гиперкоагуляция, гиперагрегабельность тромбоцитов, которые предрасполагают к тромбозам. Следовательно, особенности состояния системы гемостаза у новорожденных очень тесно зависят от течения перинатального периода, в том числе от фармакотерапии матери. При ДВС-синдроме у новорожденных обнаружено наличие чисто фибриновых или эритроцитарных тромбов в системе микроциркуляции. Чаще поражаются легкие (у взрослых - почки). Возможен тромбоз крупных сосудов синусов твердой мозговой оболочки, артериального протока. 14. Дистресс-синдром респираторный новорожденных Респираторный дистресс-синдром (РДС) или синдром дыхательных расстройств (СДР) или болезнь гиалиновых мембран (БГМ) – неинфекционный патологический процесс в лёгких, развивающийся у детей в первые часы или дни жизни с проявлением острой дыхательной недостаточности, обусловленной первичной недостаточностью сурфактантной системы, несостоятельностью легочной ткани, патологическими процессами происходящими в лёгких на фоне значительного угнетения жизненно важных функций организма. Респираторный дистресс-синдром, является одной из основных причин заболеваемости и смерти недоношенных и доношенных детей. К группе риска по развитию дыхательных расстройств можно отнести недоношенных детей с гестационным возрастом менее 35 недель; новорожденных с морфофункциональной незрелостью; детей перенесших хроническую или острую гипоксию; младенцев, родившихся от матерей с сахарным диабетом, гипотиреозом и другими эндокринными заболеваниями; детей от многоплодной беременности; новорожденных, родившихся путем операции кесарева сечения; роды, осложнившиеся отслойкой плаценты с кровотечением; наличие врождённых и наследственные заболеваний бронхолёгочной системы у родителей; новорожденных с родовой травмой ЦНС. У недоношенных детей имеется ряд особенностей дыхательной системы, способствующих развитию дыхательных расстройств. К ним относится незрелость дыхательного центра, узкий просвет бронхов, усиленное кровоснабжение слизистой бронхов, незрелость сурфактантной системы, горизонтальное расположение ребер, слабое развитие межреберной мускулатуры, низкая растяжимость легочной ткани. Причинами респираторной патологии могут быть также легочные и внелегочные причины. К легочным причинам РСД относятся врожденные пороки развития с обструкцией дыхательных путей (атрезия и гипоплазия хоан, микрогнатия, макроглоссия, врожденные стенозы гортани и бронхов); приобретенные заболевания (отеки слизистой носа, ОРВИ, бактериальные инфекции верхних дыхательных путей и др.); патологию паренхимы лёгких или альвеол (первичные ателектазы лёгких, болезнь гиалиновых мембран, аспирационный синдром меконием, транзиторное тахипноэ (влажные легкие), отек лёгких, кровоизлияния в легкие, синдромы, сопровождаемые выходом воздуха в полость грудной клетки, бронхолегочная дисплазия (БЛД), синдром Вильсона–Микити). К внелегочным причинам относятся врожденные пороки сердца, повреждения головного и спинного мозга, метаболические нарушения, гиповолемический или септический шок, миопатии. |
