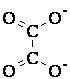срс. СРС3.ОВР.ПЯ.ДС (1). Периодический закон и периодическая система химических элементов Электронная оболочка атома Движение электрона в атоме носит вероятностный характер
 Скачать 159.03 Kb. Скачать 159.03 Kb.
|
|
CРС 3. Часть1. Строение вещества. Строение атомов. Периодический закон и периодическая система химических элементов Электронная оболочка атома Движение электрона в атоме носит вероятностный характер. Околоядерное пространство, в котором с наибольшей вероятностью (0,90 - 0,95) может находиться электрон, называется атомной орбиталью (АО). Атомная орбиталь, как любая геометрическая фигура, характеризуется тремя параметрами (координатами), получившими название квантовых чисел (n, l , ml , ms). Квантовые числа принимают не любые, а определенные, дискретные (прерывные) значения. Соседние значения квантовых чисел различаются на единицу. Квантовые числа определяют размеры ( n ), форму ( l ), ориентацию ( ml ) атомной орбитали в пространстве. Атомные орбитали, которым отвечают значения l, равные 0, 1, 2, 3 называются соответственно s-, p-, d- и f-орбиталями. В электронно-графических формулах атомов каждая атомная орбиталь обозначается квадратом ( ).Занимая ту или иную атомную орбиталь, электрон образует электронное облако, которое у электронов одного и того же атома может иметь различную форму. Электронное облако характеризуется четырьмя квантовыми числами (n, l, ml, ms). Эти квантовые числа связаны с физическими свойствами электрона: число n (главное квантовое число) характеризует энергетический (квантовый) уровень электрона; число l (орбитальное) – момент количества движения (энергетический подуровень); число ml (магнитное) - магнитный момент; ms - спин. Спин возникает за счет вращения электрона вокруг собственной оси. Согласно принципу Паули: в атоме не может быть двух электронов, характеризующихся одинаковым набором 4х- квантовых чисел. Поэтому в атомной орбитали могут находиться не более двух электронов, отличающихся своими спинами (ms = ± 1/2). В табл. 1 приведены значения и обозначения квантовых чисел, а также число электронов на соответствующем энергетическом уровне и подуровне. Устойчивому (невозбужденному) состоянию многоэлектронного атома отвечает такое распределение электронов по атомным орбиталям, при котором энергия атома минимальна. Поэтому они заполняются в порядке последовательного возрастания их энергий. Этот порядок заполнения определяется правилом Клечковского (правило n+ l ): - заполнение электронных подуровней с увеличением порядкового номера атома элемента происходит от меньшего значения (n + l ) к большему значению (n + l ); - при равных значениях (n + l ) заполняются сначала энергетические подуровни с меньшим значением n. Последовательность заполнения энергетических уровней и подуровней следующая: 1s→ 2s→2p→ 3s→3p→ 4s→ 3d→ 4p→5s→ 4d→5p→ 6s→ (5d1) → 4f →5d→ 6p →7s→ (6d1) →5f→6d→7p. Электронная структура атома может быть изображена также в виде схем размещения электронов в квантовых (энергетических) ячейках, которые являются схематическим изображением атомных орбиталей. Размещение электронов по атомным орбиталям в пределах одного энергетического уровня определяется правилом Хунда (Гунда): электроны в пределах энергетического подуровня располагаются сначала по одному, а затем, если электронов больше, чем орбиталей, то они заполняются уже двумя электронами; или чтобы суммарный спин был максимальным. П р и м е р 1. Составьте электронные и электронно-графические формулы атомов элементов с порядковыми номерами 16 и 22. Решение: Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д. И. Менделеева, то для серы - Z = 16, титана - Z = 22. Электронные формулы имеют вид: 16S 1s22s22p63s23p4; 22Ti 1s22s22p63s23p64s23d2. Электронно-графические формулы этих атомов: 16S
22Ti
1. Значения квантовых чисел и максимальное число электронов на квантовых уровнях и подуровнях
П р и м е р 2. Какой энергетический подуровень будет заполняться раньше 3d или 4s? Решение: В соответствии с принципом наименьшей энергии (правило Клечковского) энергетическому подуровню 3d соответствует сумма n+ l = 3 + 2 = 5, а 4s соответствует сумма 4 + 0 = 4. Следовательно, сначала заполнится подуровень 4s, а затем 3d. П р и м е р 3. Составьте электронную и электронно-графическую формулы атома кремния в нормальном и возбужденном состояниях. Решение: Для Si число электронов равно 14, электронная формула имеет вид: 1s22s22p63s23p2. Электронно-графическая формула атома кремния: 14Si
При затрате некоторой энергии (h)один из 3s-электронов атома кремния может быть переведен на вакантную 3р-орбиталь; при этом энергия атома возрастает, так как возникающая электронная конфигурация (1s22s22p63s13p3) соответствует возбужденному состоянию атома кремния (Si* ): 14Si*
П р и м е р 4. На каком основании хлор и марганец помещают в одной группе периодической системы элементов Д.И. Менделеева? Почему их помещают в разных подгруппах? Решение: Так как число электронов в атоме элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для хлора - Z = 17, марганца - Z = 25. Электронные формулы имеют вид: 17Сl 1s22s22p63s23p5; 25Mn 1s22s22p63s23p64s23d5. Электронно-графические формулы этих атомов: 17Cl
25Mn
Валентные электроны хлора - 3s23p5, а марганца - 4s23d5. Таким образом, эти элементы не являются электронными аналогами и не должны размещаться в одной и той же подгруппе. Но на валентных орбиталях атомов этих элементов находится одинаковое число электронов - 7. Поэтому оба элемента помещают в одну и ту же группу периодической системы Д. И. Менделеева. Периодический закон и периодическая система элементов Д. И. Менделеева П р и м е р 5. Какую высшую и низшую степень окисления проявляют мышьяк, селен и бром? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления. Решение: Высшую степень окисления элемента определяет номер группы периодической системы Д. И. Менделеева, в которой он находится. Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того количества электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (ns2np6). Данные элементы находятся соответственно в главных подгруппах V, VI, VII-групп и имеют структуру внешнего энергетического уровня s2р3, s2p4, s2p5. Следовательно, степени окисления мышьяка, селена, брома в соединениях таковы: Аs +5 (высшая), -3 (низшая) --- As2O5, AsH3; Se +6 (высшая), -2 (низшая) --- SeO3, Na2Se; Br +7 (высшая), -1 (низшая) --- КВrO4, KBr. П р и м е р 6. У какого из элементов четвертого периода марганца или брома сильнее выражены металлические свойства? Решение: Электронные формулы данных элементов: 25Mn 1s22s22p63s23p64s23d5 35Br 1s22s22p63s23p64s23d104p5. Марганец - d-элемент VII-группы побочной подгруппы, а бром - p-элемент VII-группы главной подгруппы. На внешнем энергетичеcком уровне у атома марганца два электрона, а у атома брома - семь. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а следовательно, тенденцией терять эти электроны. Они обладают только восстановительными свойствами и не образуют отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трех электронов, обладают определенным сродством к электрону, а следовательно, приобретают отрицательную степень окисления и образуют отрицательные ионы. Таким образом, марганец, как и все металлы, обладает только восстановительными свойствами, тогда как для брома, проявляющего слабые восстановительные свойства более свойственны окислительные функции. Следовательно, металлические свойства более выражены у марганца. Химическая связь Ковалентная связь Описание химической связи в любой молекуле есть по существу описание распределения в ней электронной плотности. Основным типом химической связи является ковалентная. Ковалентная связь - химическая связь между двумя атомами, осуществляемая общей для этих атомов парой электронов, перекрыванием электронных облаков взаимодействующих атомов. В зависимости от природы взаимодействующих атомов электронная пара, область максимального перекрывания электронных облаков может одинаково принадлежать взаимодействующим частицам или смещаться в ту или другую сторону. Для оценки способности атома данного элемента смещать электронную плотность, осуществляющую связь, пользуются значением относительной электроотрицательности (Х). Чем больше электроотрицательность атома, тем сильнее притягивает он обобществленные электроны. Иными словами, при образовании ковалентной связи между двумя атомами разных элементов общее электронное облако смещается к более электроотрицательному атому, и в тем большей степени, чем больше разность электроотрицательностей (ΔХ) взаимодействующих атомов. Поэтому с ростом ΔХ степень ионности связи возрастает. Значения электроотрицательности атомов некоторых элементов приведены в табл. 2. Таблица 2 Относительная электроотрицательность атомов
П р и м е р 7. Вычислите разность относительных электроотрицательностей атомов для связей H-O и O-Э в соединениях Э(OH)2, где Э - Mg, Сa или Sr, и определите: а) какая из связей H-O или O-Э характеризуется в каждой молекуле большей степенью ионности; б) каков характер диссоциации этих молекул в водном растворе? Решение: По данным табл. 2 вычисляем разность электроотрицательностей для связей О-Э: ΔХMg-O = 3,5 - 1,2 = 2,3; ΔХCa-O = 3,5 - 1,0 = 2,5; ΔХSr-O = 3,5 - 1,0 = 2,5. Разность электроотрицательностей для связи H-О составляет 1,4. Таким образом: а) во всех рассмотренных молекулах связь Э-О более полярна, т.е. характеризуется большей степенью ионности; б) диссоциация на ионы в водных растворах будет осуществляться по наиболее ионной связи в соответствии со схемой: Э(OH)2 = Э2+ + 2OH- . Следовательно, все рассматриваемые соединения будут диссоциировать по типу гидроксидов. При образовании полярной ковалентной связи происходит смещение общего электронного облака от менее к более электроотрицательному атому. В результате один из атомов приобретает избыточный отрицательный заряд, а другой - такой же по абсолютной величине избыточный положительный заряд. Систему из двух равных по абсолютной величине и противоположных по знаку зарядов, расположенных на определенном расстоянии друг от друга, называют электрическим диполем. Напряженность поля, создаваемая диполем, пропорциональна электрическому дипольному моменту диполя, представляющему собой произведение абсолютного значения заряда электрона q (1,60•10-19 Кл) на расстояние l между центрами положительного и отрицательного зарядов в диполе (длиной диполя): = ql. Величина молекулы служит количественной мерой ее полярности и измеряется в Дебаях (D): 1D = 3,33•10-30 Кл•м. П р и м е р 8. Длина диполя молекулы НСl равна 0,22•10-8 см. Вычислите электрический момент диполя. Решение: q = 1,60•10-19 Кл; l = 2,2•10-11 м; μ = q l = 1,60•10-19 •2,2•10-11 = 3,52•10-30 Кл•м = = 3,52•10-30/(3,33•10-30) = 1,06 D. П р и м е р 9. Какую валентность, обусловленную неспаренными электронами (спинвалентность), может проявлять фосфор в нормальном и возбужденном (*) состояниях? Решение: Распределение электронов внешнего энергетического уровня фосфора 3s23p3 (учитывая правило Хунда, 3s2 3px 3py 3pz) по квантовым ячейкам имеет вид: 15Р
3s 3px 3py 3pz 3d Атомы фосфора имеют свободные d-орбитали, поэтому возможен переход одного 3s-электрона в 3d-состояние: 15Р
3s 3px 3py 3pz 3dxy Отсюда валентность (спинвалентность) фосфора в нормальном состоянии равна трем, а в возбужденном - пяти. П р и м е р 10. Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа AВn , если связь в них образуется за счет sp-, sp2-, sp3-гибридных орбиталей атома А? Решение: Теория валентных связей (ВС) предполагает участие в образовании ковалентных связей не только "чистых" АО, но и "смешанных", так называемых гибридных, АО. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой одинаковой формы и одинаковой энергии. Число гибридных орбиталей (q) равно числу исходных. Ответ на поставленный вопрос отражен в табл. 3. Таблица 3 Гибридизация орбиталей и пространственная конфигурация молекул
Если в гибридизации участвуют одна s- и одна p-орбитали (sp-гибриди-зация), то образуются две равноценные sp-орбитали; из одной s- и двух p-орбиталей (sp2-гибридизация) образуются три sp2-орбитали и т.д. Гибридные облака, соответствующие данному типу гибридизации, располагаются в атоме так, чтобы взаимодействие между электронами было минимальным, т.е. как можно дальше друг от друга. Поэтому при sp-гибридизации электронные облака ориентируются в противоположных направлениях, при sp2-гибридизации - в направлениях, лежащих в одной плоскости и составляющих друг с другом углы в 120° (т.е. в направлениях к вершинам правильного треугольника), при sp3-гибридизации – к вершинам тетраэдра (угол между этими направлениями составляет 109°28'), при sp3d2-гибридизации – к вершинам октаэдра (т.е. по взаимно перпендикулярным направлениям). 3. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Ионы некоторых элементов способны присоединять к себе другие ионы или нейтральные молекулы (например, NH3), образуя более сложные комплексные ионы. При их связывании с ионами противоположного знака получаются различные комплексные соединения. Наиболее полно свойства и строение комплексных соединений объясняет координационная теория, предложенная в 1893 г. А. Вернером. Основные положения координационной теории. В молекуле любого комплексного соединения один из ионов, обычно положительно заряженный, занимает центральное место и называется комплексообразователем (центральным ионом). Вокруг него в непосредственной близости расположено (координировано) некоторое число противоположно заряженных ионов или нейтральных молекул, называемых лигандами и образующих внутреннюю координационную сферу. Остальные ионы находятся на более далеком расстоянии от центрального иона и составляют внешнюю координационную сферу. Количество лигандов, окружающих центральный ион, называется координационным числом. Внутренняя сфера комплекса в значительной степени сохраняет стабильность в растворе (ее границы в формуле показывают квадратными скобками). Ионы внешней сферы в растворе легко отщепляются. При взаимодействии солей PtCl4 и KСl образуется комплексное соединение: PtCl4 + 2 KCl = K2[PtCl6] (или PtCl4∙2KCl) Здесь внутренняя сфера состоит из комплексообразователя Pt4+, лигандов Cl–, а внешняя сфера – из ионов K+. Координационное число (КЧ) равно 6. Диссоциация * такой соли происходит по уравнению: K2[PtCl6] → 2 K+ + [PtCl6]2– Для установления принадлежности ионов к внешней или внутренней сфере часто пользуются реакциями ионного обмена. Например, при взаимодействии 1 моля PtCl4∙4NH3 c AgNO3 осаждаются 2 моля AgCl: PtCl4∙4NH3 + 2 AgNO3 = PtCl2(NO3)2∙4NH3 + 2 AgCl Следовательно, два иона Cl– принадлежат к внешней, а два других – к внутренней сфере комплекса, и формула соли имеет вид: [PtCl2(NH3)4]Cl2. Анализируя координационные числа многих комплексных соединений, А. Вернер пришел к выводу, что степень окисления * центрального атома является основным фактором, влияющим на координационное число. Наиболее характерные координационные числа приведены в таблице:
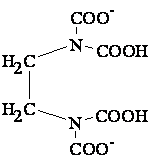
Например, координационное число 6 встречается в комплексных соединениях Pt4+, Cr3+, Co3+, Fe3+, координационное число 4 – в комплексах Cu2+, Zn2+, Pd2+, Pt2+, координационное число 2 – в комплексах Ag+, Cu+. Координационное число не является неизменной величиной для данного комплексообразователя, а обусловлено также природой лиганда, в частности, его дентатностью. Лиганды, занимающие во внутренней сфере одно место, называются монодентатными. Существуют лиганды, занимающие во внутренней сфере два или несколько мест. Такие лиганды называются бидентатными или полидентатными. Например:
ОСНОВНЫЕ ТИПЫ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Аммиакаты – комплексы, в которых лигандами * служат молекулы аммиака, например [Cu(NH3)4]SO4, [Co(NH3)6]Cl3. Аквакомплексы – лигандами являются молекулы воды: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3. Ацидокомплексы – лигандами являются анионы. Ацидокомплексы можно представить как продукты сочетания двух солей. Например: PtCl4∙2KCl или K2[PtCl6], Fe(CN)2∙4KCN или K4[Fe(CN)6] (желтая кровяная соль), Fe(CN)3∙3KCN или K3[Fe(CN)6] (красная кровяная соль). Циклические, или хелатные соединения. Они содержат бидентатный лиганд или лиганд с более высокой дентатностью *, который захватывает центральный ион подобно клешням: 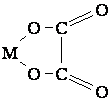 Хелатные соединения отличаются особой прочностью. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ В химии под номенклатурой понимают систему правил составления названий соединений. Правила номенклатуры разрабатываются Международным союзом чистой и прикладной химии (IUPAC). Согласно номенклатуре комплексных соединений, название комплексного аниона начинают с указания состава внутренней сферы *. Во внутренней сфере прежде всего называют анионы, прибавляя к их названию окончание -о. Например: Cl– (хлоро-), CN– (циано-), OH– (гидроксо-) и т.д. Далее называют нейтральные лиганды *. При этом для аммиака используют название “аммин”, для воды – “аква”. Количество лигандов указывают греческими числительными: 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса. Затем называют комплексообразователь *, используя для него латинское название и окончание -ат, после чего римскими цифрами в скобках указывают степень окисления * комплексообразователя. После обозначения состава внутренней сферы называют внешнесферные катионы. Если комплексообразователь входит в состав катиона, то название внутренней сферы составляют так же, как в случае комплексного аниона, но используют русское название комплексообразователя и в скобках указывают степень его окисления. Примеры: K[Fe(NH3)2(CN)4] – тетрацианодиамминферрат (III) калия K4[Fe(CN)6] – гексацианоферрат (II) калия Na2[PtCl6] – гексахлороплатинат (IV) калия (NH4)2[Pt(OH)2Cl4] – тетрахлородигидроксоплатинат (IV) аммония [Pt(NH3)4Cl2]Cl2 – хлорид дихлоротетраамминплатины (IV) [Ag(NH3)2]Cl – хлорид диамминсеребра (I) Если комплексное соединение является неэлектролитом, т.е. не содержит ионов во внешней сфере, то степень окисления центрального атома не указывается, т.к. она однозначно определяется из условия электронейтральности комплекса. Например: [RhI3(NH3)3)] – трииодотриамминродий [Co(NO2)3(H2O)3] – тринитротриаквакобальт [Cu(CNS)2(NH3)2] – дироданодиамминмедь. ПРИРОДА ХИМИЧЕСКОЙ СВЯЗИ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ. ВТОРИЧНАЯ ДИССОЦИАЦИЯ КОМПЛЕКСОВ. КОНСТАНТА НЕСТОЙКОСТИ Согласно методу валентных связей *, образование комплексных соединений * осуществляется за счет донорно-акцепторного * взаимодействия между комплексообразователем * и лигандами *. Обычно центральный атом имеет свободные орбитали *, а лиганды имеют неподеленные электронные пары. В образовании такой координационной связи могут участвовать ns-, np-, nd- или (n–1)d- орбитали, где n – номер внешнего электронного слоя комплексообразователя. Координационное число * определяется гибридизацией * орбиталей центрального атома:
Для примера рассмотрим образование координационных связей в ионе [Zn(NH3)4]2+. Здесь акцептором является ион Zn2+, имеющий вакантные орбитали на четвертом электронном слое и полностью занятый третий электронный слой. Четыре ковалентных связи * образуются с участием одной 4s- и трех 4p-орбиталей, которые перекрываются с орбиталями молекул аммиака (донор), содержащими неподеленные электронные пары: 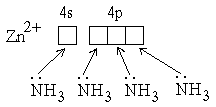 Валентные орбитали цинка подвергаются sp3-гибридизации, поэтому лиганды (NH3) расположены в вершинах тетраэдра, в центре которого находится ион Zn2+. Донорно-акцепторная связь в комплексных соединениях является весьма прочной, однако наряду с диссоциацией, в которой отщепляются ионы внешней сферы, в очень незначительной степени разрушается также внутренняя сфера комплекса *: [Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl– (первичная диссоциация). Первичной называется диссоциация, в которой отщепляются ионы внешней сферы. Внутренняя сфера при этом не разрушается.) [Ag(NH3)2]+ Вторичная диссоциация подчиняется закону действия масс * и характеризуется соответствующей константой равновесия *, которая называется константой нестойкости комплексного иона: 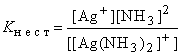 Наиболее устойчивые комплексные соединения имеют наименьшие константы нестойкости. С помощью этих величин можно предсказать течение реакций между комплексными соединениями. Реакция протекает в сторону продуктов с меньшими константами нестойкости. Например, для иона [Ag(NH3)2]+ Kнест=6,8∙10–8, а для иона аммония NH4+ Kнест=5,4∙10–10, поэтому под действием кислот аммиакат серебра разрушается с образованием ионов Ag+ и NH4+: [Ag(NH3)2]+ + 2 H+ Для комплекса [Pt(NH3)4]2+ Kнест=5∙10–34, поэтому он не разрушается даже в концентрированной соляной кислоте. Иногда вместо константы нестойкости используют обратную ей величину, называемую константой устойчивости: Kуст=1/Kнест. Значения этих констант можно найти в справочнике. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||