Первый московский государственный медицинский
 Скачать 0.49 Mb. Скачать 0.49 Mb.
|
Лабораторная работа 6.1Определение рН раствора фотоэлектроколориметрическим методом.Цель работы. Научиться определять рН растворов с помощью фотоэлектроколориметрического метода. Задание: определить рН одного-двух растворов по указанию преподавателя; сопоставить полученный результат с расчетным для данной протолитической системы. Оборудование и реактивы: колориметр КФК-2 с набором кювет, штатив с пробирками, бюретки, воронки, пипетки градуированные. Водный р-р карбоната натрия (с=0,1 моль/л), набор индикаторов по Михаэлису, универсальный индикатор, исследуемые растворы, дистиллированная вода. Сущность работы. Метод основан на использовании кислотно-основных индикаторов, представляющих собой слабые кислоты или основания, изменяющие характер или интенсивность окраски в обратимых реакциях протонирования - депротонирования. У одноцветных индикаторов молекулярная форма бесцветна, а ионная - окрашена. Пример одноцветного индикатора – n-нитрофенол: 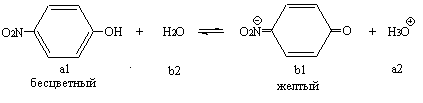 При прибавлении к водному раствору n-нитрофенола небольшого количества сильной кислоты сопряженное основание (Ind-) переходит в соответствующую бесцветную кислоту (HInd); интенсивность окраски уменьшается или она исчезает вовсе. Наоборот, прибавление небольшого количества сильного основания вызывает смещение равновесия в противоположном направлении: концентрация окрашенной формы индикатора (Ind-) возрастает, интенсивность окраски усиливается. Изменение соотношения HInd и Ind- сопровождается визуальными изменениями в определенном диапазоне значений pH, что позволяет судить о положения равновесия и, следовательно, определять pH: c(Ind-) pH= pKa+lg ----------- c(HInd), где рКа- силовой показатель индикатора. Сущность фотоэлектроколориметрического метода определения рН заключается в измерении оптической плотности (Ах) испытуемого раствора с индикатором и раствора, в котором добавленный индикатор полностью ионизирован и имеет максимальную интенсивность окраски, т.е. максимальную оптическую плотность (Аmax). Выполнение эксперимента: 1. Выбирают одноцветный индикатор для измерения рН. 2. Готовят колориметр КФК-2 к работе. 3. Готовят растворы для фотометрирования. 4. Измеряют оптическую плотность анализируемого раствора. 5. Измеряют оптическую плотность раствора индикатора, в котором он полностью ионизирован. 6. Рассчитывают степень ионизации индикатора в исследуемом растворе. 7. Рассчитывают рН исследуемого раствора. Экспериментальные данныеПриблизительное значение рН _____________ Выбранный индикатор ____________________________ Светофильтр ___________________ Значения оптической плотности: Ах = ______________ Аmax = ________________ Обработка результатов эксперимента. 1. Рассчитывают степень ионизации индикатора α в исследуемом растворе, для чего используют соотношение: α =Ах/Аmax. 2. Для расчета рН используют уравнение: рКа+ lg α рН= ----------- 1- α Расчеты: *В Выводе указывают значение рН исследуемого раствора, относительную ошибку. Выводы Дата __________ Занятие ___________ МОДУЛЬ 06. Гетерогенные равновесия и процессы. Задания для самостоятельной работы 6.27; 6.29;6.50; 6.54 Дата _______Лабораторная работа 6.5Гетерогенные равновесия в растворах электролитов Цель работы: Получить системные знания по теории гетерогенных процессов в приложении к биологическим системам; определить термодинамические условия образования и растворения осадков; изучить влияние различных факторов на растворимость малорастворимых электролитов. Задание: Изучить: а) условия образования осадков, б) влияние одноименного иона на растворимость малорастворимого электролита; в) конкуренцию гетерогенных процессов; г) влияние природы растворителя на образование осадка; д) провести групповые и характерные реакции на ионы с образованием осадков. Оборудование и реактивы: Набор пробирок в штативе; бюретки вместимостью 25 мл, воронки диаметром 30 мм, капельницы с растворами. Растворы хлорида кальция (0,01 моль/л и 0,1 моль/л), оксалата натрия, сульфата натрия (концентрация растворов 0,01 моль/л); гидрофосфата натрия, дигидрофосфата натрия (концентрация растворов 0,1 моль/л), соляная кислота (0,1 моль/л), гидроксид натрия (0,1 моль/л), хлорида натрия (0,2 моль/л), сульфат натрия, хромат натрия (1 моль/л), нитрата свинца(0,1 моль/л). Сущность работы: визуальное наблюдение за изменениями в пробирках при сливании растворов солей, способных образовать осадки. Выполнение эксперимента: Опыт 1. Условия образования осадков. Уравнения реакций: Наблюдения записывают в таблицу 1. Экспериментальные данные Таблица 1
|
