Первый московский государственный медицинский
 Скачать 0.49 Mb. Скачать 0.49 Mb.
|
Расчет ПС:* В выводе указывают термодинамические условия образования и растворения осадков. Вывод: Дата:_________ Занятие №___ МОДУЛЬ 07. Лигандообменные равновесия и процессы Задания для самостоятельной работы 7.9;7.10; 7.45; 7.53 Дата _______ Лабораторная работа 6.6 Изучение реакций комплексообразования с неорганическими лигандами. Цель: Изучить реакции ионов-биометаллов и ионов-токсикантов с неорганическими лигандами на примере образования аммино- и гидроксокомплексов. Задание: выполнить серию опытов , связанных с изучением возможности образования аммин- и гидроксокомплексов. Оборудование и реактивы: Штатив с пробирками. Растворы растворимых солей железа(Ш), кобальта (П), никеля(П), меди (П), цинка, алюминия, свинца(П) (с=0,1моль/л); раствор гидроксида натрия (с=0,1моль/л) и концентрированный; раствор аммиака концентрированный, тиоцианида калия (с=0,1моль/л). Сущность работы: визуальное наблюдение за изменениями, происходящими в пробирках. На первом этапе получают гидроксиды изучаемых ионов металлов. К полученным гидроксидам добавляют концентрированные растворы щелочи и аммиака. Об образовании прочного комплексного соединения судят по растворению осадка гидроксида. Выполнить опыт по изучению влияния природы растворителя на устойчивость комплексов. Выполнение эксперимента: Опыт 1. Получают нерастворимые гидроксиды. Изучают возможность образования гидроксокомплексов. Уравнения реакций: Опыт 2. Изучают возможность образования амминокомоплексов Уравнения реакций: Экспериментальные данные:
Вывод оформляют в виде перечисления: - ионы, образующие прочные и аммино- и гидроксокомплексы…………………….. - ионы, образующие прочные только амминокомплексы ……………………………. - ионы, образующие прочные только гидроксокомплексы ……………………….… - ионы, не образующие прочные ни аммино- ни гидроксокомплексы ……………………… Дата ______ Занятие ________ Задания для самостоятельной работы 7.39; 7.657.70; 7.72 Дата _______ Лабораторная работа 6.7 Тема: Простые и совмещенные лигандообменные равновесия Цель: Изучить реакции ионов биометаллов и ионов токсикантов с органическими лигандами, а также совмещенные лигандообменные равновесия. Задание: Выполнить одну или несколько реакций ионов-биометаллов или ионов-токсикантов со специфическими органическими лигандами. Выполнить опыты по изучению влияния рН среды на устойчивость и строение комплексов. Выполнить опыт по совмещенным лигандообменным равновесиям. Оборудование и реактивы: Штатив с пробирками, пипетки, фильтровальная бумага. Растворы, содержащие ионы алюминия, меди(П), кобальта (П), никеля (П), цинка, железа (Ш), кальция (с=0,2 моль/л); насыщенные водные растворы фторид-иона, тартрат-иона, тиоцианата -иона, ализарина, 0,01% р-р дитизона в четыреххлористом углероде, 0,2% р-р 1-нитрозо2-нафтола в 50% уксусной кислоте, 1% р-р диметилглиоксима в этаноле. Водные р-ры ЭДТА натрия , глицина, салицилата натрия. Эриохром черный Т. Буферные р-ры со значениями рН 1; 2,5; 7,4. Аммиачный буферный р-р с рН=9. Сущность работы: По изменению цвета, возникающего в ходе взаимодействия судят о: 1) возможности образования хелатных соединений (опыт1); 2) преобладающем направлении лигандообменного процесса в случае совмещения нескольких равновесий (опыт 3); 3) зависимости структуры комплекса от рН среды (опыт 4). Выполнение эксперимента: Опыт 1. Изучение образования внутрикомплексных соединении ионов металлов с органическими лигандами 1а. Взаимодействие ионов алюминия с ализарином 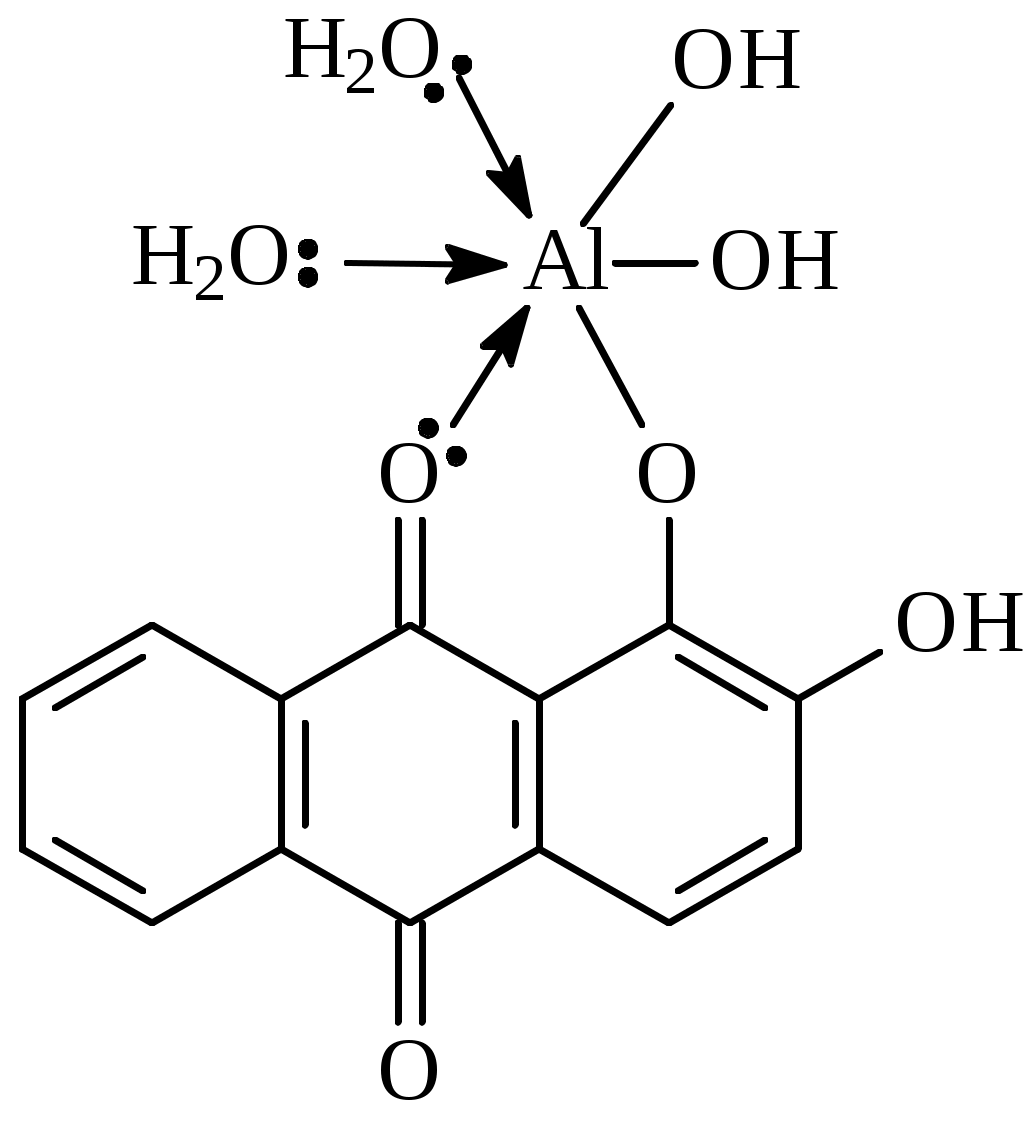 16. Взаимодействие ионов цинка с дитизоном 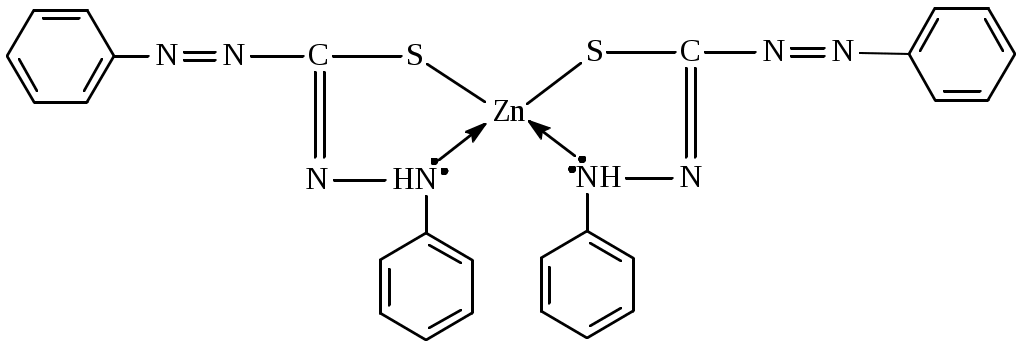 1в. Взаимодействие ионов кобальта с 1-нитрозо -2- нафтолом. : 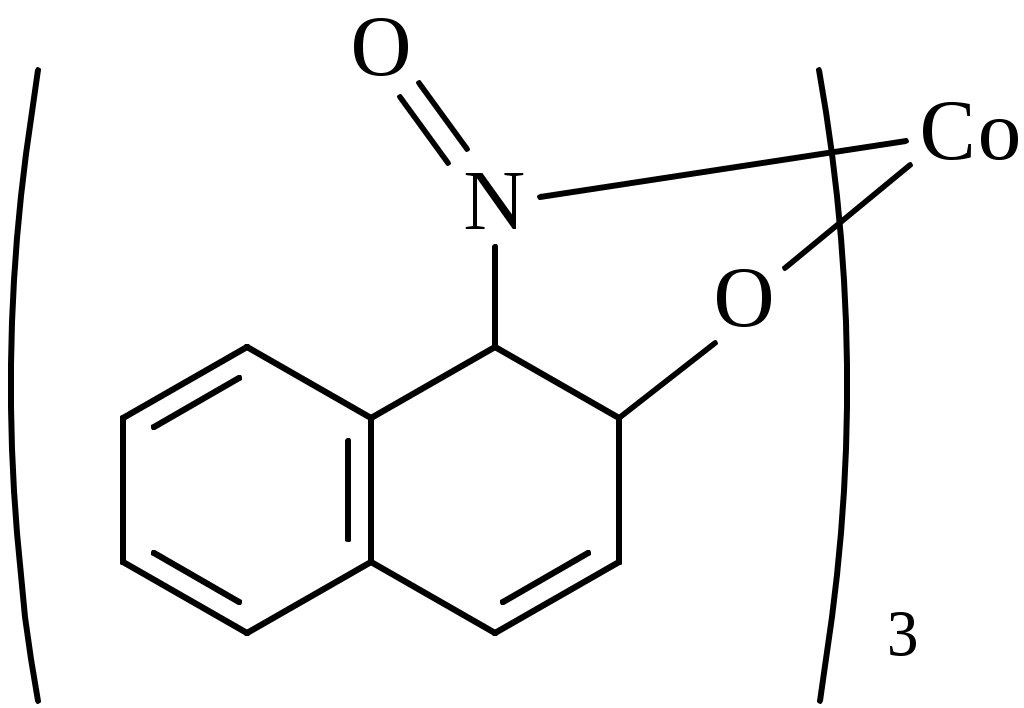 1е. Взаимодействие ионов никеля с диметилглиоксимом. 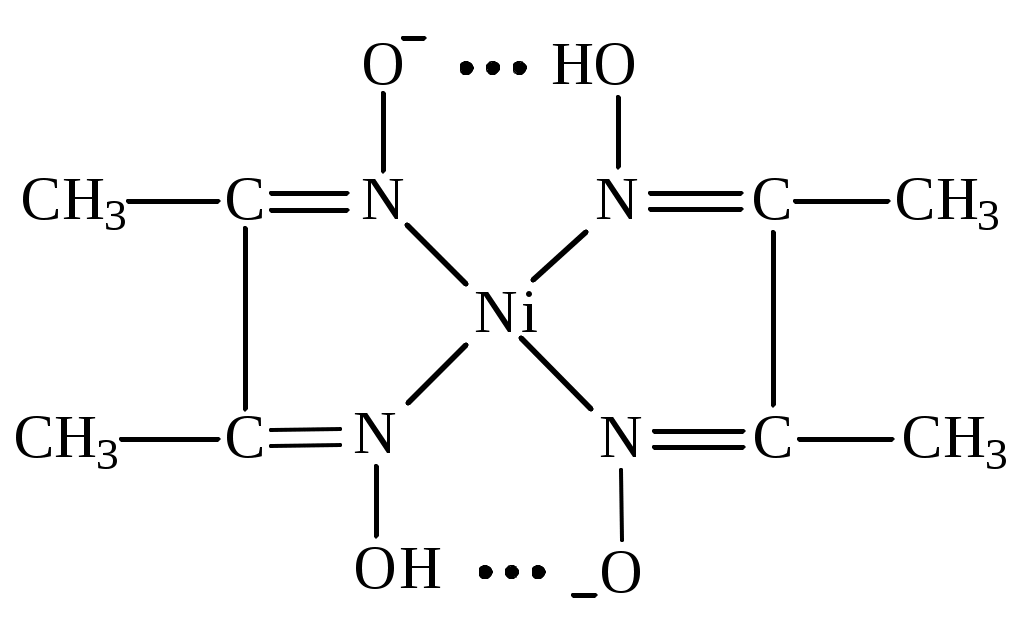 Опыт 3б. Конкуренция за ион кальция 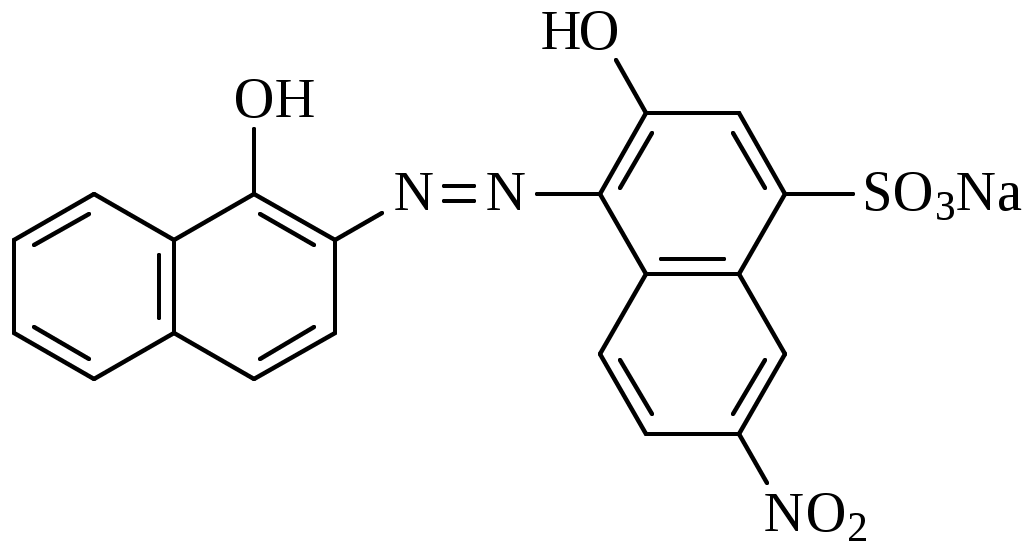 Эриохром черный Т Схематично взаимодействие иона металла с металлиндикатором и с ЭДТА можно представить следующим образом: С металлиндикатором : Са2+ + Ind ↔ CaInd- + 2H+ С ЭДТА натрия: CaInd- + H2ЭДТА2- ↔ CaЭДТА2- + H2Ind- Наблюдения: В выводе к опыту 3б указывают: а) объект конкуренции……………….., б) конкурирующие частицы…………………………………., в) конкурирующие процессы…………………………………………………. ………………………………………………………………………………….. г) преобладающий процесс…………………………………………………….. Дата ________ Занятие _________ МОДУЛЬ 08. Редокс-равновесия и редокс-процессы Задания для самостоятельной работы 8.18; 8.48; 8,58; 8.73; 8.82; 8.98 Дата ________ Лабораторная работа 6.8 Определение направления редокс-процессов. Сущность работы: Для определения направления самопроизвольного протекания редокс -процесса необходимо сравнить величины редокс - потенциалов двух редокс - систем. Окисленная форма той редокс-системы, потенциал которой больше, и будет выполнять роль окислителя в данном процессе. Разность потенциалов = (ox) (red) >0 свидетельствует, что процесс будет протекать самопроизвольно в прямом направлении. Выполнение эксперимента: Опыт. Определение направления редокс-процесса. Уравнения реакций: Справочные данные: r(Fe3+/Fe2+) = ____________ r( Br2 /Br) = ______________ r( I2/I) = _____________ Расчеты: Наблюдения: * В выводе указывают величину, по значению которой можно определить направление редокс-процессов. Вывод: Лабораторная работа 6.9 Изучение зависимости редокс-потенциала от соотношения концентраций окисленной и восстановленной форм Цель: Изучить зависимость величины редокс-потенциала от соотношения концентраций окисленной и восстановленной форм. Задание: Определить величины редокс-потенциала системы гексацианоферрат (Ш)/ гексацианоферрат (П) при соотношении концентраций 1:1; 10:1; 1:10. Оборудование и реактивы: Иономер ЭВ-74, электроды платиновый и хлорсеребряный; химические стаканы, бюретка. Водные р-ры гексацианоферрата (Ш) калия, гексацианоферрата(П) калия, хлорида калия. Термометр. Сущность работы: Для определения редокс-потенциалов собирают гальваническую цепь, состоящую из редокс-электрода и хлорсеребря║ного электрода. По измеренным величинам ЭДС рассчитываеют величины редокс-потенциалов. Изменяя соотношение концентраций окисленной и восстановленной форм, определяют величины редокс-потенциалов и выявляют зависимость их от этого фактора. Выполнение эксперимента: 1.Готовят иономер ЭВ-74 к работе. 2. Рассчитывают, какие требуются объемы растворов 3.Измеряют ЭДС гальванической цепи. Схема гальванической цепи: Ag , AgCl │KCl║K3[Fe(CN)6] , K4[Fe(CN)6] │ Pt 4. Рассчитывают величину редокс-потенциала. Найденные значения записывают в таблицу:
Обработка результатов эксперимента: Значение редокс-потенциалов рассчитывают по уравнению: φr = Е + φ срав после чего записывают в таблицу. Рассчитывают значения редокс-потенциалов для изученных систем по уравнению Нернста. Для расчетов можно применять уравнение: 2,303 RT a(ox) φr = φr° + ---------- lg ------- nF a(red) Расчёты: *В выводе отмечают зависимость редокс-потенциала от соотношения концентраций компонентов. Объясняют причины отклонений экспериментально найденных значений потенциалов от рассчитанных. Сравнивают полученное значение φr° с теоретическим (см. табл. 20 приложения практикума). Вывод: Дата ___________ Занятие __________ Задания для самостоятельной работы 8.106; 8.111; 8.113;8.115 Дата ________ Лабораторная работа 6.11 Изучение влияния рН на редокс-потенциал. Цель: Изучить зависимость редокс-потенциала от рН среды. Задание: Изучить зависимость редокс-потенциала от рН среды на примере системы хинон-гидрохинон; определить значениие стандартного и формального редокс-потенциала для этой системы. Оборудование и реактивы:Иономер ЭВ-74, электроды платиновый и хлорсеребряный, химический стакан вместимостью 25 мл, стеклянная палочка. Термометр. Раствор хин-гидрон насыщенный в этаноле. Сущность работы: При растворении в воде хингидрона (соединение n-бензохинона и гидрохинона) быстро устанавливается равновесие 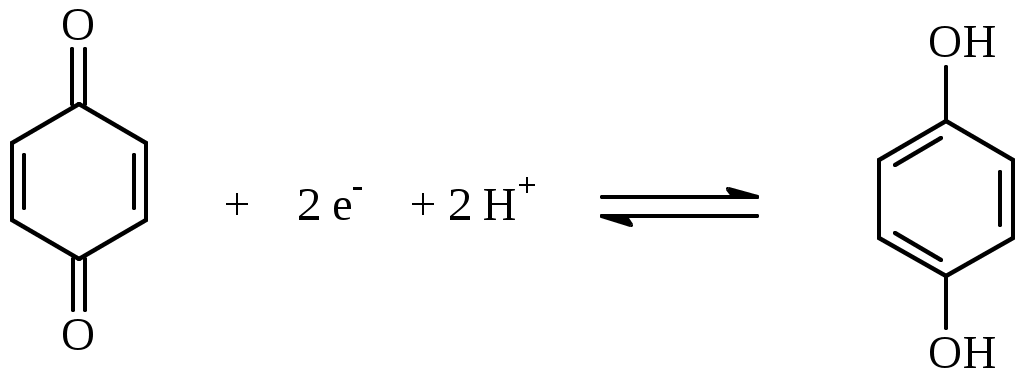 хинон гидрохинон Увеличение в растворе концентрации ионов водорода приводит к смещению равновесия влево, а ее уменьшение – вправо. Т.О, изменение рН раствора приводит к изменению концентраций окисленной и восстановленной форм, т.е. к изменению редокс-потенциала. Выполнение эксперимента: 1. Готовят иономер ЭВ-74 к работе. 2. Готовят растворы, содержащие изучаемые редокс-системы. 3. Измеряют ЭДС гальванической цепи. Схема гальванической цепи: Ag , AgCl │KCl║хинон, гидрохинон │ Pt 4. Рассчитывают величину редокс-потенциала. Найденные значения записывают в таблицу:
Обработка результатов эксперимента: Значения редокс-потенциалов рассчитывают по уравнению: φr = Е + φ срав Строят график зависимости φr = f (рН) *В выводах отмечают зависимость редокс-потенциала системы от рН и приводят определенные графическим способом значения стандартного и формального редокс-потенциала системы хинон-гидрохинон. Вывод: Дата _________ Занятие _________ МОДУЛЬ09. Совмещенные равновесия и конкурирующие процессы разных типов Задания для самостоятельной работы 9.21; 9.29;9.36 Дата _________ Лабораторная работа 6.12 Изучение совмещенных равновесий и конкурирующих процессов разного типа Цель: Научиться прогнозировать направление конкурирующих процессов различных типов и характеризовать состояние равновесия в виде общей константы равновесия, рассчитанной по частным константам равновесия. Задание: Выполнить серию опытов и определить для каждого случая: 1) типы совмещенных равновесий;2) объект конкуренции и конкурирующие частицы ; 3) частицу, выигрывающую конкуренцию. Рассчитать общую константу равновесия через частные и спрогнозировать направление процесса. Оборудование и реактивы: Штатив с пробирками. Водные р-ры хлорида бария, хлорида магния, иодида калия, нитрата свинца, оксалата натрия, хлорида железа (Ш), тартрата калия, сульфата меди, тиосульфата натрия, хлорида кальция, карбоната натрия, сульфата железа (П), гидрофосфата натрия, дигидрофосфата натрия(с=0,1 моль/л), соляная кислота (с=0,1 моль/л), серная кислота (с=0,2 моль/л), гидроксид натрия (2 моль/л и 6 моль/л), ЭДТА натрия (с=0,01 моль/л), гексацианоферрат (П) калия (с=0,5 моль/л), иодид калия кристаллический, хлорид аммония кристаллический. Сущность работы: Преобладание того или иного процесса определяется величиной общей константы равновесия, которая рассчитывается через частные константы равновесия как правило диссоциативного типа ( константы кислотности для протолитических равновесий, константы растворимости для гетерогенных, константы нестойкости для лигандообменных). Общая константа равновесия равна отношению произведения частных констант диссоциативного типа веществ в левой части уравнения, к произведению частных констант диссоциативного типа веществ, стоящих в правой части уравнения, возведенных в степени стехиометрических коэффициентов. Выполнение эксперимента: Опыт 1. Изучение совмещенных протолитических и гетерогенных равновесий. Уравнения реакций: Mg(OH)2 + HCl → Mg(OH)2 + NH4Cl → Наблюдения: 1 пробирка: 2 пробирка: Расчет: 1. 2. Вывод: 1. 2. Опыт 2. Изучение совмещенных гетерогенных и лигандообменных равновесий. 2а. Уравнения реакций: Наблюдения: Расчет: Вывод: Дата _________ Занятие _________ МОДУЛЬ 10. Физическая химия поверхностных явлений Задания для самостоятельной работы 10.31; 10.35; 10.40; 10.46,10.52; 10.54 Дата _________ Лабораторная работа 9.3 Влияние различных факторов на адсорбцию из растворов Цель: Определить влияние удельной поверхности адсорбента, природы адсорбента, адсорбтива и растворителя на адсорбцию красителей из растворов. Задание: Выяснить влияние на величину адсорбции перечисленных выше факторов. Оборудование и реактивы: Штатив с пробирками, воронки. Водные р-ры метиленового синего, фуксина, эозина, р-р метиленового синего в этаноле, уголь активированный, каолин, кремниевая кислота, фильтровальная бумага. Сущность работы: Визуальное наблюдение: 1) окраски адсорбента; 2) окраски фильтратов после проведения адсорбции. Выполнение эксперимента: Определениие знака заряда окрашенных ионов красителей капиллярным методом на фильтровальной бумаге. Перед проведением основных опытов устанавливают по степени растекания пятна водного раствора красителя, к каким классам (кислотным или основным красителям) относятся объекты анализа Метиленовый синий – Эозин – Фуксин – Наблюдения: Вывод: Опыт 1. Влияние природы адсорбента и адсорбтива на адсорбцию. Адсорбент – Адсорбтив – Растворитель – Наблюдения: Вывод: Опыт 2. Влияние природы растворителя на адсорбцию. Адсорбент – Адсорбент – Адсорбтив – Адсорбтив – Растворитель- Растворитель – Наблюдения: Наблюдения: Вывод: Опыт 3. Влияние удельной поверхности адсорбента на адсорбцию. Адсорбент – Адсорбтив – Растворитель – Наблюдения: Вывод: Растворитель- Растворитель – Наблюдения: Наблюдения: Вывод: Опыт 3. Влияние удельной поверхности адсорбента на адсорбцию. Адсорбент – Адсорбтив – Растворитель – Наблюдения: Вывод: | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
