Задачи 1 часть. Первый санктпетербургский государственный медицинский университет имени академика и. П. Павлова кафедра биологической химии
 Скачать 339.5 Kb. Скачать 339.5 Kb.
|
|
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РФ ПЕРВЫЙ САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМЕНИ АКАДЕМИКА И.П. ПАВЛОВА КАФЕДРА БИОЛОГИЧЕСКОЙ ХИМИИ ЗАДАЧИ И ЗАДАНИЯ ПО БИОЛОГИЧЕСКОЙ ХИМИИ Часть 1 Санкт-Петербург 2014 Авторы: Профессор Л.В.Галебская Доцент В.П.Фаенкова Доцент П.П.Бельтюков Доцент Д.А.Танянский Ассистент Л.А.Андреева Ассистент М.А.Соловьева Под общей редакцией профессора Е.Д.Суглобовой Рецензент: Доцент кафедры общей и биоорганической химии Л.В.Дульнева, к.х.н. Оглавление Энзимология Задачи и задания Темы рефератов Обмен белков Задачи и задания Темы рефератов Энзимология. Задачи и задания. Для выполнения заданий и решения задач в качестве источников информации следует использовать рекомендуемую литературу: Щербак И.Г. Биологическая химия: Учебник. – СПб.: Изд-во СПбГМУ, 2005. – 480 с. Галебская Л.В., Немировский В.С. Ферменты и ферментативные препараты: Учебно-справочное пособие. – СПб.: Изд-во СПбГМУ, 2001. – 84 с. Галебская Л.В. Неферментативные реакции живого организма: Указания для самостоятельной работы студентов. – СПб: Изд-во СПбГМУ, 2004. – 22 с. Галебская Л.В., Соловцова И.Л., Рюмина Е.В., Субботина Т.Ф. и др. Биохимия специализированных клеток: Учебное пособие. – СПб.: Изд-во СПбГМУ, 2003. – 128 с. Дайте определение понятию «термолабильность». Приведите примеры термолабильных ферментов. Как можно использовать термолабильность ферментов при проведении биохимического анализа? Опишите условия определения активности ферментов. Какие измерения и с помощью каких методов необходимо осуществить, чтобы рассчитать скорость химической реакции в присутствии фермента? Приведите примеры методов определения активности ферментов. В каких единицах выражается активность ферментов? Опишите строение активных центров ферментов. Дайте определение понятиям: «каталитический участок», «адсорбционный участок»? Их функциональная роль. Дайте определение понятию «изоферменты». Приведите примеры изоферментов. Как можно разделить изоферменты и/или определить активность разных изоферментов? Перечислите принципы номенклатуры и индексации ферментов. Какие уникальные особенности белков не учитываются при наименовании ферментов и присвоении им индекса? Какие конкретные задачи могут быть решены при проведении медицинских диагностических исследований с помощью очищенных ферментных препаратов? Приведите примеры. Известно, что для эффективной работы ферментов необходимо, чтобы реакция протекала при таком значении pH, которое соответствует оптимуму. Дайте подробное объяснение причинам снижения активности ферментов при увеличении или уменьшении pH среды по сравнению с оптимумом. Какое практическое значение в медицине может иметь определение активности ферментов в биологических жидкостях, например, в сыворотке крови или в моче пациента? Что должен знать врач для правильной трактовки результатов биохимического анализа? Известно, что при анализе кинетики ферментативного катализа в присутствии конкурентных ингибиторов наблюдают увеличение значения константы Михаэлиса (КМ ). Объясните, что происходит при одновременном взаимодействии молекул конкурентного ингибитора и субстрата с ферментом? Почему величина максимальной скорости ферментативной реакции (Vmax ) при конкурентном ингибировании не меняется? Как на практике могут быть использованы ингибиторы ферментов в качестве лекарственных средств? Приведите примеры лекарственных препаратов, способных угнетать активность ферментов человека (1) и активность ферментов микроорганизмов (2). При постепенном увеличении концентраций специфического необратимого ингибитора можно достигнуть полного угнетения фермента. Что можно определить, зная минимальную концентрацию такого ингибитора, которая ведет к полному угнетению фермента, если известно, что фермент и ингибитор взаимодействуют в эквимолярном соотношении, а молекула фермента содержит один активный центр? Приведите график, иллюстрирующий зависимость скорости реакции от концентрации специфического необратимого ингибитора при неизменной концентрации субстрата. Как доказать, что ингибитор, действующий на фермент, является обратимым неконкурентным? Какие исследования и расчеты следует провести для ответа на вопрос о механизме ингибирования? Какие общие признаки и отличия в изменениях кинетических параметров ферментативной реакции проявляются в действии неконкурентных и специфических необратимых ингибиторов на фермент? Проиллюстрируйте ответ графическим изображением. Как проявляется закон действующих масс в ферментативном катализе? Докажите, что измеряя скорость ферментативной реакции в присутствии большого избытка субстрата, можно определить количество фермента в исследуемом биоматериале. Что нужно знать для примерного расчета количества молекул фермента в исследуемом образце? Почему для работы некоторых ферментов требуются коферменты? Какие функции они выполняют в ходе ферментативного катализа? Как доказать необходимость участия кофермента в ферментативной реакции? Приведите примеры коферментов и реакций, в которых они участвуют. Уравнение Михаэлиса-Ментен используется не только для описания кинетики ферментативного катализа, но и для описания процессов специфического взаимодействия любых лигандов с белками, что позволяет использовать данное уравнение при разработке и изучении эффективности лекарственных средств. В чем заключается общность механизмов взаимодействия фермента с субстратом и лиганда с рецептором? Что показывает величина константы Михаэлиса? Какие способы её определения Вам известны? Аллостерические эффекторы могут изменять скорость ферментативных реакций. Опишите механизм взаимодействия аллостерического ингибитора (активатора). Что происходит в молекуле фермента после образования комплекса фермент-аллостерический эффектор? Почему это может приводить к разнонаправленным изменениям активности фермента? Как можно доказать, что исследуемое вещество воздействует на фермент аллостерически? Известно, что некоторые вещества, используемые в качестве лекарственных препаратов, оказывают влияние на активность отдельных ферментов. Опишите возможные механизмы таких изменений на примере ингибиторов моноаминооксидазы (1), ингибиторов ангиотензин-превращающего фермента (АПФ) (2), ингибиторов ГМГ-КоА редуктазы (3). Во многих биологических системах в регуляции физиологических процессов реализуется принцип «обратной связи». Как механизмы регуляции по принципу «обратной связи» реализуются в ферментативных процессах (в том числе в мультиферментных системах)? Используя учебную и научную литературу, опишите примеры отрицательной аллостерической обратной связи в моно- и мультиферментных процессах. Назовите аллостерические эффекторы и ферменты, участвующие в процессе. Как можно доказать, что изменения скорости ферментативного процесса, происходящего в организме, связаны с регуляцией на генетическом уровне? Концентрация каких молекул в биоматериале должна быть для этого определена? Что означает термин «зимоген»? Как осуществляется его превращение в активный фермент? Ферменты какого класса и подкласса обеспечивают такое превращение? Что можно сказать об их субстратной специфичности? Какие причины могут приводить к развитию врожденной патологии, связанной с нарушением работы ферментов? Приведите примеры таких заболеваний, опишите молекулярные механизмы развития патологии, её последствия с точки зрения метаболизма и поддержания постоянства внутренней среды организма в целом. Какова роль витаминов в реализации функций некоторых ферментов? Составьте таблицу, содержащую информацию о строении водорастворимых витаминов и жирорастворимого витамина K, их природных источниках, конкретной роли в биохимических процессах. Какие патологические состояния связаны с недостаточным поступлением витаминов в организм? Приведите примеры. В случае аллостерической регуляции по механизму прямой положительной связи, кривая начальной скорости реакции от концентрации субстрата имеет сигмоидальный характер. Объясните, с чем это связано? Что происходит с молекулой фермента при таком механизме регуляции в ходе взаимодействия с субстратом? При каких условиях скорость ферментативной реакции будет прямо пропорциональна концентрации фермента? Каким образом на практике используется эта особенность ферментативного катализа при биохимическом анализе биоматериала? Почему двухвалентные катионы металлов нередко играют роль кофакторов ферментов? Приведите примеры кофакторной функции двухвалентных катионов. Приведите примеры участия катионов Zn2+, Ca2+, Mg2+ и других в работе ферментов. Укажите способы выражения ферментативной активности в биологическом материале. Что означает утверждение: «активность фермента в сыворотке крови составляет 46 Ед/л»? Известно, что в обратимых процессах ферменты ускоряют как прямую, так и обратную реакцию. Какие условия необходимо создать, чтобы зарегистрировать активность фермента, катализирующего обратимую реакцию с константой равновесия близкой к 1? Приведите конкретные примеры практического использования ферментов для исследовательских целей и для решения задач диагностики и лечения в медицине, для быстрого достижения практических целей в медицинской промышленности и в хозяйственной деятельности. В чем заключаются сходства и различия ферментов, входящих в один класс (подкласс, подподкласс)? Рассмотрите на примере класса «гидролазы» (3), подкласса – «эстеразы» (3.1), подподкласса – «фосфомоноэстеразы» (3.1.3). В названии ряда ферментов, катализирующих реакцию карбоксилирования, содержится слово «карбоксилаза». Среди карбоксилаз встречаются ферменты классов 1, 4 и 6. Объясните, почему реакция, ведущая к сходным химическим превращениям, катализируется ферментами разных классов? Некоторые фрукты становятся коричневыми на разрезе (например, такое явление наблюдается при разрезании яблока). Это связано с действием фермента катехолазы на бесцветное вещество катехол. В результате реакции получается бензохинон, который образует коричневый пигмент. Поварам известно, что, если дольки фруктов обрызгать соком лимона, пигмент не образуется. Объясните, почему? Два фермента катализируют одну и ту же реакцию, но обладают разными кинетическими характеристиками. Фермент Е1 имеет константу Михаэлиса (Км1) 10 ммоль/л и максимальную скорость (Vmax1) 150 ммоль/мин, а фермент E2 имеет Км2=0,02 ммоль/л и Vmax2=150 ммоль/мин. Используя уравнение Михаэлиса-Ментен, докажите, что при равных концентрациях субстрата ферментативный катализ будет эффективнее протекать в присутствии E1. Рассчитайте соотношение скоростей V1/V2 при концентрации субстрата 10 ммоль/л и 50 ммоль/л., Во сколько раз изменится скорость ферментативной реакции при изменении концентрации субстрата от 10 ммоль/л ДО 50 ммоль/л? При испытании нового лекарственного препарата, предназначенного для контроля над процессами биосинтеза гликогена в печени, использовали очищенный препарат фермента гликоген-синтетазы. Однако оказалось, что очищенный фермент сам по себе не проявляет достаточной активности, а начинает эффективно работать только в присутствии АТФ и фермента протеинкиназы. На какую особенность гликоген-синтетазы указывает описанный факт? Опишите данный механизм регуляции активности ферментов. При сравнении методами электрофоретического анализа молекулярных масс двух иммунологически сходных белков (т.е. обладающих значительным антигенным сходством), полученных из культуры клеток поджелудочной железы, было показано, что они имеют молекулярные массы 21,6 и 25,6 кДа. При этом белок, имеющий меньшую молекулярную массу, обладает способностью катализировать гидролиз пептидных связей, а второй белок такой активности не проявляет. Какой механизм модификации белка, лежащий в основе образования активных форм ферментов из неактивного предшественника, сопровождается уменьшением молекулярной массы? При исследовании фермента, полученного из гепатоцитов и катализирующего превращение фосфорибозилпирофосфата в фосфорибозиламин были определены его кинетические свойства (константа Михаэлиса Kм=0,3 ммоль/л, максимальная скорость Vmax=0,02 ммоль/мин*мг). При детальном анализе препарата фермента было обнаружено, что в среде присутствует довольно много АМФ. После дополнительной очистки препарата фермента от АМФ повторное определение кинетических параметров привело к следующим результатам: Kм=0,3 ммоль/л, Vmax=1,4 ммоль/мин*мг. Объясните, как АМФ влияет на активность исследуемого фермента. Объясните, почему ковалентная модификация фермента, обеспечивающая повышение его активности, происходит значительно быстрее, чем индукция фермента, обеспечивающая в количественном выражении такое же увеличение его активности? В классе трансфераз имеются ферменты протеинкиназы, катализирующие перенос фосфата из молекулы АТФ на остатки аминокислот, содержащие гидроксо-группы. Как Вы думаете, эта реакция обратима? Почему? Белок лактатдегидрогеназа (ЛДГ) является тетрамером, в котором встречаются два типа субъединиц (M-muscle и H-heart). Какое количество вариантов данного белка может образоваться? Как название используется для обозначения разных по составу, но обладающих одинаковой ферментативной активностью белков? По приведенным результатам исследования фермента определите максимальную скорость, константу Михаэлиса, начальную скорость при концентрации субстрата 100 ммоль/л. Какое количество продукта образуется за первые 5 минут реакции при концентрации субстрата 2 ммоль/л? При концентрации субстрата 0,002 ммоль/л? Чему будут равны Kм и Vmax, если концентрацию фермента увеличить в 4 раза?
Для 1 мг белка в препарате фермента рассчитана величины: максимальная скорость 150 мкмоль/мин, константа Михаэлиса 1,5 ммоль/л. Какова будет начальная скорость реакции, если концентрация субстрата 0,5 ммоль/л, 3 ммоль/л и 15 ммоль/л? Для фермента определены KM=0,1 ммоль/л и Vmax=0,01 ммоль/с. Исходя из того, что кинетика катализа для данного фермента подчиняется механизму, описанному Михаэлисом, ответьте на вопросы: а) При какой концентрации субстрата начальная скорость реакции составит 1 мкмоль/с? б) Какая доля от общего количества фермента (в процентах) находится в составе фермент-субстратного комплекса, если начальная скорость составляет 8 мкмоль/c? По приведенным результатам исследования действия ингибитора на процесс ферментативного катализа определите Vmax и Kм в присутствии и в отсутствии ингибитора. Какой тип ингибирования наблюдается?
При исследовании ферментативных превращений одного субстрата под действие двух разных ферментов (E1 и E2) получены следующие результаты:
Рассмотрите зависимости скорости от концентрации субстрата и ответьте на вопрос: какой механизм регуляции характерен для фермента E2? Известно, что фермент гексокиназа, катализирующий превращение глюкозы в глюкозо-6-фосфат, является аллостерическим ферментом, который угнетается продуктом реакции. Объясните, с какой целью при определении активности гексокиназы в инкубационную смесь помимо подходящего буфера, глюкозы и АТФ добавляют фермент глюкозо-6-фосфат дегидрогеназу и его кофермент - акцептор водорода НАДФ+ ? При исследовании гидролиза пара-нитрофенилацетата под действием химотрипсина была построена кинетическая кривая, при анализе которой можно сделать вывод о постепенном снижении прироста концентрации продукта в ходе реакции: 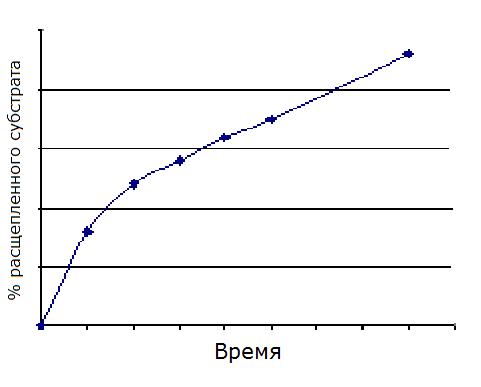 Опишите причины этого явления, основываясь на представлениях о кинетике ферментативного катализа. Одним из эффектов ацетилсалициловой кислоты (аспирина) является снижение свертывания крови вследствие угнетения активности фермента циклооксигеназы в тромбоцитах. Скорость снижения этого эффекта аспирина находится в обратной зависимости от скорости обновления тромбоцитов в крови. О каком механизме ингибирования циклооксигеназы говорит этот факт? Для достижения эффекта при лечении ВИЧ-инфекции используют ингибиторы протеазы вируса иммунодефицита человека. При анализе нового лекарственного средства было обнаружено, что вновь разработанный ингибитор в присутствии избытка субстрата протеазы ограничивает ферментативную активность протеазы ВИЧ на 50%, при этом сродство субстрата к ферменту не изменяется. После диализа смеси протеазы и ингибитора активность фермента полностью восстанавливается. Какой механизм ингибирования наблюдается в данном случае? В результате последовательных превращений вещество А превращается в вещество D (см. рисунок). Как будут изменяться концентрации A,B,C и D, если на фермент E2 действует специфический необратимый ингибитор? 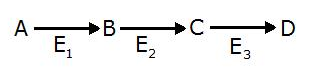 Фермент уреаза при температуре 200С и pH 8,0 повышает скорость гидролиза мочевины в 1014 раз. Если при некотором количестве уреазы полный гидролиз 50 мг мочевины при 200С и pH 8,0 произойдет за 5 минут, сколько времени понадобится для спонтанного гидролиза такого же количества мочевины при этих же условиях в отсутствие фермента? Известно, что полный гидролиз 50 г мочевины в присутствии уреазы при рН 8,0 протекает за 5 мин. Определите время, необходимое для полного гидролиза такого же количества мочевины в таких же условиях в отсутствие фермента. В восемь пробирок, помеченных номерами, поместили одинаковые количества фермента и субстрата в буферном растворе. Одновременно поместили все пробирки в водяной термостат при оптимальной температуре. Затем через каждые пять минут вынимали из термостата по одной пробирке, останавливали реакцию и по количеству оставшегося в пробирке субстрата рассчитывали скорость реакции для соответствующего промежутка времени. Полученные результаты представлены в таблице:
В чем причина различий рассчитанных скоростей реакции? Что необходимо сделать, чтобы обеспечить одинаковые скорости на протяжении всего периода инкубации? В начале инкубации концентрация субстрата в инкубационной смеси, содержащей фермент, расщепляющий данный субстрат, составляла 480 мг/мл, а через 10 минут инкубации концентрация составила 420 мг/мл. Рассчитайте скорость реакции и выразите активность фермента в данной реакции в единицах ферментативной активности (катал, юнит), если относительная молекулярная масса субстрата равна 180. При исследовании культуры клеток гепатоцитов было показано, что активность фермента глюкокиназы в субклеточной фракции, полученной после инкубации клеток в присутствии инсулина в течение трех часов, повышается примерно в 30 раз по сравнению с исходной величиной. В то же время инсулин, добавленный в субклеточную фракцию, на активность глюкокиназы не влияет. На что указывают такие наблюдения? Что происходит в гепатоцитах в процессе инкубации клеток с инсулином? При исследовании влияния необратимого специфического ингибитора регистрировали активность фермента и получили кривую зависимости скорости реакции от концентрации ингибитора при постоянной начальной концентрации фермента и субстрата: 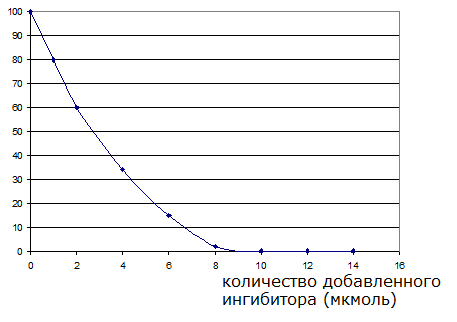 Как по приведенным данным можно определить количество молекул фермента в инкубационной смеси, если известно, что он содержит один активный центр и взаимодействует с ингибитором в эквивалентных соотношениях (1:1), а молекулярная масса фермента составляет 20 кДа? При добавлении пероксида водорода в раствор, содержащий разрушенные эритроциты (гемолизат), наблюдается быстрое образование газа, который выделяется из раствора. Напишите уравнение реакции и объясните, почему константы скоростей спонтанной реакции и реакции в присутствии гемолизата различаются более чем в 1010 раз? При исследовании ацетилхолинэстеразы (АХЭ) – фермента, катализирующего гидролиз ацетилхолина, было обнаружено, что вещество, схожее по структуре с ацетилхолином – сукцинилхолин, снижает способность АХЭ гидролизовать свой природный субстрат, но сам сукцинилхолин при этом гидролизу не подвергается. При добавлении дополнительного количества субстрата (ацетилхолина) скорость реакции возрастала. Какой механизм ингибирования в данном случае наблюдается? Опишите эксперимент, с помощью которого можно подтвердить ваше решение. Фермент ацетилхолинэстераза (АХЭ) работает с большой эффективностью. Число оборотов, т.е. количество молекул субстрата, которое превращается с участием фермента в единицу времени, для АХЭ составляет 25000 с-1. Сколько времени требуется ферменту, чтобы осуществить гидролиз одной молекулы ацетилхолина? Для одного из ферментов известна величина константы Михаэлиса: КМ =0,06 моль/л. При концентрации субстрата 0,18 моль/л скорость реакции составила 2,4×10-5 моль/л*с. Рассчитайте величину максимальной скорости этой реакции. При исследовании продуктов двух последовательных этапов очистки фермента из гомогената ткани получили следующие результаты определения активности фермента:
Почему при равных концентрациях субстрата значения скорости в расчете на мг белка увеличились? Как определить значения константы Михаэлиса (KM) и максимальной скорости (Vmax) ? Рассчитайте их. Малоновая кислота HOOC-CH2-COOH при добавлении к взвеси митохондрий замедляет реакции цикла трикарбоновых кислот. Учитывая конкурентный характер ингибирования процесса, найдите фермент-мишень для действия ингибитора. Напишите ингибируемую малонатом реакцию. Транскрипционный фактор, индуцируемый гипоксией (HIF, hypoxia inducible factor), играет важную роль в механизмах выживания в условиях гипоксии, стимулируя экспрессию белков, необходимых для образования сосудов, утилизации глюкозы, регуляции механизмов апоптоза. HIF синтезируется клетками с постоянной скоростью. Белок разрушается протеасомами после гидроксилирования 1-2 остатков пролина в реакции, катализируемой пролил-4-гидроксилазой. Фумарат и сукцинат являются сильными ингибиторами пролил-4-гидроксилазы. Опишите механизм кислород-сенсорной регуляции внутриклеточной концентрации HIF. В таблице представлена активность кислой фосфатазы в плазме крови человека при разных величинах pH:
Определите pH-оптимум фермента. У пациентки 67 лет активность кислой фосфатазы (КФ) плазмы крови составила 6 Ед/л (при норме до 5,5 Ед/л). В присутствии тартрата натрия активность кислой фосфатазы снизилась до 1, 5 Ед/л (при норме до 0,8 Ед/л). Какая причина является наиболее вероятной для объяснения полученных результатов? Приведите схему реакции, отражающей механизм катализа гистидиндекарбоксилазы. Завершающую реакцию синтеза гема катализирует фермент феррохелатаза. Укажите: а) источник железа, используемого ферментом, б) степень окисления железа, внедряемого в протопорфирин IX, в) локализацию феррохелатазы, г) аллостерические свойства фермента. Фермент гемооксигеназа катализирует начальную реакцию катаболизма гема. Укажите: а) кофермент гемооксигеназы, б) характер реакции (аэробная или анаэробная), в) продукты реакции, катализируемой ферментом. |
