Задачи 1 часть. Первый санктпетербургский государственный медицинский университет имени академика и. П. Павлова кафедра биологической химии
 Скачать 339.5 Kb. Скачать 339.5 Kb.
|
|
Темы рефератов. Оксидоредуктазы и их коферменты. Роль витаминов в образовании коферментов оксидоредуктаз. http://www.piboc.dvo.ru/structure/ext_labs/met/classification.php Кольман Я., Рём К.-Г. Наглядная биохимия, пер. с нем., М. Мир, 2000. 469 с, ил. (стр.108-109) http://biokhimija.ru Биохимия: Учеб. для вузов, Под ред. Е.С. Северина., 2003. 779 с. Ашмарин И.П. Алкогольдегидрогеназа млекопитающих – объект молекулярной медицины // Успехи биологической химии. – 2003. - Т.43. - С.3-18 (полнотекстовая версия в интернете – http://www.inbi.ras.ru/ubkh/43/ashmarin.pdf ) Использование ферментов для создания диагностических и аналитических инструментов (ELISA, иммобилизованные ферменты и т.п.) Самуилов В.Д. Иммуноферментный анализ// Соросовский образовательный журнал, Биология, 1999, http://www.pereplet.ru/obrazovanie/stsoros/896.html Шеховцова Т.Н Ферменты: их использование в химическом анализе// Соросовский образовательный журнал, Химия, 2000 Карбоангидраза. Строение, свойства, биологическая роль карбоангидразы в организмах растений и животных. Куприянова Е.В., Пронина Н.А. Карбоангидраза – фермент, преобразивший биосферу// Физиология растений. - 2011. - Т. 58, № 2. - С. 163-176 Петрович Ю.А., Подорожная Р.П., Киченко С.М. Значение системы карбонат-бикарбонат-карбоангидраза для минерализованных тканей//Российский стоматологический журнал. - 2004. - № 2. - С. 38-41 Аспартильные протеиназы. Строение и механизм действия. Журнал Биоорганическая химия. - 1999. - Т.25, №6. - С.366 Журнал Биоорганическая химия. - 1999. - Т.25, №6. - С.371 Журнал Биоорганическая химия. - 1999. - Т.25, №8. - С.532 Абзимы – антитела, обладающие ферментативной активностью. Биохимия. – 2006. - Т.71, №11.- С.1488-1504* Невинский Г.А. Особенности абзимов из крови и молока здоровых доноров и пациентов с аутоиммунными и вирусными заболеваниями // Биохимия.- 2009. - Т. 74, №9. - С. 1165-1183 Наградова Н.К.Каталитические антитела//Соросовский образовательный журнал Биология, 1996 – (http://www.pereplet.ru/obrazovanie/stsoros/146.html ) Использование ферментов для создания биосенсоров. Варфоломеев С.Д. Биосенсоры // Соросовский образовательный журнал, Химия, 1997. http://www.pereplet.ru/obrazovanie/stsoros/240.html Дзядевич С.В. Кондуктометрические ферментные биосенсоры: теория, технология, применение.// Biopolymers and cell (предыдущие названия: Биополимеры и клетка, Біополімери і клітина). - 2005. - Т. 21. № 2, - С. 91-106. Преснова Г.В., Рубцова М.Ю., Егоров А.М. Электрохимические биосенсоры на основе пероксидазы хрена// Российский химический журнал. - 2008. - Т. LII. № 2, - С. 60-65. Карякин А.А. Биосенсоры и биомолекулярная электроника// Нано- и микросистемная техника. - 2001. - № 8. - С. 1. Карякин А.А. Электрохимические биосенсоры для определения ключевых метаболитов крови // Клиническая лабораторная диагностика. - 2005. - № 10, - С. 5. Каскадные ферментные системы. Атауллаханов Ф.И. Каскады ферментативных реакций и их роль в биологии // Соросовский образовательный журнал, Биология, 2000 http://www.pereplet.ru/nauka/Soros/pdf/0007_002.pdf Бутылин А.А., Пантелеев М.А., Атауллаханов Ф.И. Пространственная динамика свертывания крови // Журнал Российского химического общества им. Д.И.Менделеева. – 2007. - Т. 51, №1. - С.45-50. http://www.chem.msu.su/rus/jvho/2007-1/45.pdf Алкогольдегидрогеназа – «первый» фермент из класса оксидоредуктаз (КФ 1.1.1.1). Механизм действия и роль в метаболизме различных организмов. Зимин Ю.В., Уланова А.А., Соловьева А.Г. Алкогольдегидрогеназа. Молекулярная и надмолекулярная регуляция// Фундаментальные исследования. - 2012. - № 3. - С. 527-530. Уланова А.А., Крылов В.Н., Зимин Ю.В. Кинетические свойства митохондриальной алкогольдегидрогеназы клеток печени при токсическом гепатите // Вестник Нижегородского университета им. Н.И. Лобачевского. - 2011. - № 2-2. - С. 222-224 Ашмарин И.П. Алкогольдегидрогеназа млекопитающих - объект молекулярной медицины//Успехи биологической химии. - 2003. -Т. 43. - С. 3-18. Фосфатазы сыворотки крови. Способы определения активности и исследования изоферментов кислой и щелочной фосфатаз. Любимова Н.В., Пашков М.В., Тюляндин С.А., Гольдберг В.Е., Кушлинский Н.Е. Тартратрезистентная кислая фосфатаза – биохимический критерий костного метастазирования // Сибирский онкологический журнал. - 2004. - № 4. - С. 22-25. Пашинцева Л.П., Козырева Е.А., Хайленко В.А., Давыдов М.И., Комов Д.В. Плацентарная щелочная фосфатаза убольных с опухолевыми и неопухолевыми заболеваниями легких // Вестник РОНЦ им. Н. Н. Блохина РАМН.- 1991. - Т. 2, № 2. - С. 35-36. Сухарев А.Е., Булах Н.А., Ахушкова Л.М. Плацентарная щелочная фосфатаза – маркер эмбриональных малигнизированных тканей // Успехи современного естествознания. - 2011. - № 4. - С. 41-46. Сухарев А.Е., Булах Н.А., Ермолаева Т.Н., Николаев А.А. Щелочная фосфатаза в смешенной слюне при воспалительных заболеваниях брюшной полости и гестозах // Клиническая лабораторная диагностика. - 2011. - № 6. - С. 16-18. Рунова Н.Б., Дурново Е.А., Казаков А.В. Критерии интенсивности процессов регенерации костной ткани челюстей при лечении воспалительно-деструктивных процессов // Стоматология. - 2010. - Т. 89, № 2. - С. 32-35. Коханов А.В., Мусатов О.В., Мяснянкин А.А., Асфандияров Р.И., Ямпольская И.С. Разработка тест-системы для количественного определения плацентарной щелочной фосфатазы //Астраханский медицинский журнал. - 2011. - Т. 6, № 3. - С. 229-230. Изоферменты цитохрома P450. Биологические функции и способы дифференциального определения активности. Кантемирова Б.И., Тимофеева Н.В., Григанов В.И., Шилова А.А. Изоферменты цитохрома Р450// Астраханский медицинский журнал. - 2011. - Т. 6, № 3. - С. 15-18. (http://elibrary.ru/download/51655709.pdf) Раменская Г.В., Савченко А.Ю., Бубольц А.А., Смирнов В.В. Выбор маркерного препарата для оценки активности изофермента CYP3А4 у людей. Клиническая лабораторная диагностика. - 2008. - № 9. - С. 50-56. Апполонова С.А., Родченков Г.М., Бубольц А.А.Величина концентрации гидроксилированных метаболитов преднизолона как показатель активности изофермента ЗА4 цитохрома Р-450// Клиническая лабораторная диагностика. - 2008. - № 9. - С. 35-50. Кукес В., Сычев Д., Раменская В., Савченко А., Семенов Н., Чилова Р., Родченков Г., Апполонова С., Бубольц А., Новиков А., Сивков А., Хаджиева Б. Оценка активности изофермента цитохрома Р450 3А4 (CYP3A4) как реальная возможность персонализации фармакотерапии // Врач. - 2008. - № 3. - С. 13-19. Чаукина С.В. Особенности метаболизма лекарственных средств под действием изоферментов цитохрома Р-450// Фармация. - 2008. - № 3. - С. 47-48. Структура и функции мембранных белков. Гринштейн C.В., Кост О.А. Структурно–функциональные особенности мембранных белков// Успехи биологической химии. - 2001. -Т. 41. - С.77-104. http://www.inbi.ras.ru/ubkh/41/grinshtein.pdf Владимиров Ю.А. Биологические мембраны. Строение, свойства, функции. http://foroff.phys.msu.ru/phys/med/cell/Cell_01bi.pdf Артюхов В. Биологические мембраны: структурная организация, функции, модификация физико-химическими агентами. Изд-во Воронежского гос. ун-та, 2000. Огурцов А.Н. Биологические мембраны: учебное пособие. Изд-во НТУ ХПИ, 2012. 368 с. http://bib.convdocs.org/v758/?cc=1&view=pdf Виды гемоглобинов. Топунов А.Ф., Петрова Н.Э. Гемоглобины: эволюция, распространение и гетерогенность // Успехи биологической химии. - 2001. - Т. 41. - С.199-228. http://www.inbi.ras.ru/ubkh/41/topunov.pdf Космачевская О.Ф., Топунов А.Ф. Гемоглобины – разнообразие структур и функций (обзор)// Прикладная биохимия и микробиология. - 2009. - Т.45, №6. - С.627-653. http://144.206.159.178/ft/7955/645939/12952222.pdf Космачевская О.Ф., Топунов А.Ф. Гемоглобины – единство в многообразии// Химия и жизнь. - 2007. - №10. - С.28-33. http://files.school-collection.edu.ru/dlrstore/3b64e0fd-0d39-7fba-c8e2-10261ac33f6d/28-33_10_2007.pdf Кривенцев Ю.А., Бисалиева Р.А., Носков А.И. Гемоглобины человека. //Вестник Астраханского государственного технического университета. – 2007. - №6. - С.34-41. http://elibrary.ru/download/86894357.pdf Десатуразы жирных кислот. Лось Д. А. Структура, регуляция экспрессии и функционирование десатураз жирных кислот// Успехи биологической химии. - 2001. -Т. 41, - С.163-198. http://www.inbi.ras.ru/ubkh/41/los.pdf Назаров П.Е., Мягкова Г.И., Гроза Н.В. Полиненасыщенные жирные кислоты как универсальные эндогенные биорегуляторы. //Вестник МИТХТ. - 2009. - Том.4, №5. - С. 3-19. http://mitht.ru/files/Vestnik/2009_4_5/2009_4_5_3-19.pdf Строение и функции митохондриального комплекса I. Гривенникова В.Г., Виноградов А.Д. Митохондриальный комплекс I// Успехи биологической химии. - 2003. - Т. 43. - С.19-58. http://www.inbi.ras.ru/ubkh/43/grivennikova.pdf Виноградов А.Д. Преобразование энергии в митохондриях. // Соросовский образовательный журнал. – 1999. - Том 5, №9. - С.12-19. http://www.pereplet.ru/nauka/Soros/pdf/9909_011.pdf Шапероны и шаперонины - белки теплового шока. Панасенко О.О., Ким М.В., Гусев Н.Б. Структура и свойства малых белков теплового шока// Успехи биологической химии. - 2003. - Т. 43. - С.59-98. http://www.inbi.ras.ru/ubkh/43/panasenko.pdf Марченков В.В., Марченко Н.Ю., Марченкова С.Ю., Семисотнов Г.В. Молекулярные шаперонины прокариотических и эукариотических клеток.// Успехи биологической химии. - 2006.-Т. 46. - С.279-302. http://www.inbi.ras.ru/ubkh/46/marchenkov.pdf Биокаталитическая деструкция фосфорорганических соединений. Ефременко Е.Н., Варфоломеев С.Д. Ферменты деструкции фосфорорганических нейротоксинов// Успехи биологической химии. - 2004. -Т. 44. - С. 307-340. http://www.inbi.ras.ru/ubkh/44/efremenko.pdf Антохин А.М., Гайнуллина Э.Т., Таранченко В.Ф., Рыжиков С.Б., Яваева Д.К. Холинэстеразы: структура активного центра и механизм влияния блокаторов холинорецепторов на скорость взаимодействия с лигандами // Успехи химии. - 2010. - Том 79, № 8. - С.780-795. http://144.206.159.178/ft/7581/866964/15124326.pdf Старостина В.К., Дёгтева С.А. Холинэстераза: методы анализа и диагностическое значение: информационно-методическое пособие // Новосибирск: «Вектор-Бест», 2008. 35 с. http://asld.baikal.ru/asld/docs/Obzor/14/%20(1).pdf Ca-АТФазы. Биологическая роль, строение и регуляция активности. Рубцов А.М. Са-ATPаза саркоплазматического ретикулума: молекулярная организация, механизм функционирования и особенности регуляции активности// Успехи биологической химии. - 2005. - Т.45. - С.235-268. http://www.inbi.ras.ru/ubkh/45/rubtsov.pdf Владимиров Ю.А. Кальциевые насосы живой клетки.// Соросовский образовательный журнал. – 1998. - №3. - С.20-27. http://www.pereplet.ru/nauka/Soros/pdf/9803_020.pdf Информационный ресурс Преподаватель он-лайн (Юрий Андреевич Владимиров) http://medbiophysics.professorjournal.ru/c/document_library/get_file?uuid=8003b257-5570-4f41-984f-6d06107fb6ce&groupId=456458 Строение и биологические функции белка p53. Чумаков П.М. Белок р53 и его универсальные функции в многоклеточном организме// Успехи биологической химии. - 2007. - Т.47. - С.3-52. http://www.inbi.ras.ru/ubkh/47/Chumakov.pdf Желтухин А.О., Чумаков П.М. Повседневные и индуцируемые функции гена р53// Успехи биологической химии. - 2010. - Т.50. - С.447-516. http://www.inbi.ras.ru/ubkh/50/Zheltukhin.pdf Протеасомы. Роль в катаболизме белковых молекул. Механизмы протеасомного протеолиза. Сорокин А.В., Ким Е.Р., Овчинников Л.П. Протеасомная система деградации и процессинга белков// Успехи биологической химии. - 2009. -Т.49. - С. 3-76. http://www.inbi.ras.ru/ubkh/49/Sorokin.pdf Цимоха А.С. Протеасомы: участие в клеточных процессах.// Цитология. - 2010. – Т. 52, № 4. - С.277-300. http://www.tsitologiya.cytspb.rssi.ru/52_4/tsimokha.pdf Молекулярный механизм мышечного сокращения. Структура и функции регуляторных и сократительных белков саркомера. Кубасова Н.А., Цатурян А.К. Молекулярный механизм работы актин-миозинового мотора в мышце.// Успехи биологической химии. – 2011. - Т.51. - С.233-282. http://www.inbi.ras.ru/ubkh/51/Koubassova.pdf Невзоров И.А., Левицкий Д. И. Тропомиозин: двойная спираль из мира белков// Успехи биологической химии. - 2011. - Т.51. - С.283-334. http://www.inbi.ras.ru/ubkh/51/Nevzorov.pdf Наглядная биохимия. http://yanko.lib.ru/books/biolog/nagl_biochem Мембранный фермент Na+/K+-АТФаза – строение, свойства и биологическая роль. Болдырев А. А. Na/K-ATФаза - свойства и биологическая роль //Соросовский образовательный журнал Биология. 1998 http://www.pereplet.ru/obrazovanie/stsoros/522.html Протеинкиназы и их роль в регуляции физиологических эффектов в клетках. Гусев Н.Б. Протеинкиназы: строение, классификация, свойства и биологическая роль // Соросовский образовательный журнал Биология, 2000 http://www.pereplet.ru/obrazovanie/stsoros/1125.html Молекулярные механизмы функционирования актомиозиновых систем. Левицкий Д.И. Применение метода дифференциальной сканирующей калориметрии для структурно-функциональных исследований мышечных белков (обзор). // Успехи биологической химии. – 2004. - Т. 44. - С. 133-170. Левицкий Д.И. Актомиозиновые системы биологической подвижности (обзор). // Биохимия. – 2004. - Т. 69, № 11. - С. 1447-1462. Матриксные протеиназы соединительной ткани человека; их классификация, субстратная специфичность и физиологические функции. Соловьева. Н.И. Матриксные металлопротеиназы и их биологические функции. // Ж. Биоорганической химии - 1998. - Т. 24. - С. 217-226. Березов Т.Т., Назаренко А.Ю., Крюк Ю.В., Терешкина И.В. Матриксные металлопротеиназы и их ингибиторы при раке молочной железы. // Вопросы биологической, медицинской и фармацевтической химии. - 2011. - №12. - С. 37-46. Изоферменты супероксиддисмутазы человека. Дубинина Е. Е. Продукты метаболизма кислорода в функциональной активности клеток (жизнь и смерть, созидание и разрушение). – 2006. – СПб: Изд-во «Медицинская пресса». 2006, 397 с. Аминоацилтрансферазы; строение, механизм каталитической и неканонических функций. Смирнова В.Е., Лакунина В.А., Тарасов И.А., Крашенинников И.А., Каменский П.А. Неканонические функции аминоацил-т-РНК-синтетаз. // Биохимия. - 2012, № 1. - С. 15-21 Мембранные протеиназы кишечника человека: особенности строения и роль. Замолодчикова Т.С. Сериновые протеиназы слизистой тонкого кишечника – локализация, функциональные свойства, физиологическая роль. Обзор. // Биохимия. - 2012. - Т. 77, №8. - С. 989-1001. Система теломераза – теломеразная РНК: строение и биологическая функция. Смекалова Е.М., Зверева М.Э., Громенко Е.В.,ШубернецкаяО.С., Рубцова М.П.,Донцова О.А. Биосинтез и созревание теломеразной РНК // Биохимия. - 2012. – 77, №10. – С. 1337-1349. Особенности метаболизма Helicobacter Pilori. Молекулярные механизмы иррадикации возбудителя. Кудрявцева Л.В., Щербаков П.Л., Иваников И.О., Говорун В.Н. HELICOBACTER PYLORY- инфекция: современные аспекты диагностики и терапии (пособие для врачей). – 2004. - М.: Пособие для врачей. - 41 с. Обмен белков Задачи и задания. С помощью справочника, содержащего описание лекарственных препаратов (например, ежегодного реестра лекарственных средств России «Энциклопедия лекарств»), найдите десять лекарственных веществ белковой природы, выпишите их названия и область их применения. Ответьте на следующие вопросы. А) С помощью какой химической реакции можно доказать белковую природу препарата? Б) Можно ли стерилизовать препарат методом кипячения? В) В чем заключаются особенности хранения таких препаратов? Лекарственный препарат инсулин является белком. Опишите особенности первичной и высших структур инсулина и ответьте на вопросы. А) Содержатся ли в молекуле инсулина остатки цистеина? Б) В чем заключается роль боковых цепей инсулина? В) Какая цветная реакция может выявить остатки цистеина в белке? Заполните таблицу «Лиганды и физиологические функции некоторых белков». Таблица 1. «Лиганды и физиологические функции некоторых белков».
Опишите механизм переходов: а) нативный белок ------------- денатурированный белок; б) нативный белок ------------ аминокислоты Многие белки содержат на своем N-конце аминокислотные последовательности (5-30 аминокислотных остатков), именуемые сигнальными пептидами. Эти участки молекулы играют роль своего рода адреса для доставки белка к своему месту функционирования (ЭПР, аппарату Гольджи, митохондриям, эндосомам, плазматической мембране или «на экспорт»). После доставки сигнальный пептид гидролитически отщепляется от предшественника с образованием зрелой формы. Сигнальный пептид предшественника белка трипсиногена (15 из 247 аминокислотных остатков) имеет следующую аминокислотную последовательность: мет-асн-про-лей-лей-иле-лей-тре- фен- вал- ала- ала- ала- лей- ала-………… Напишите формулу N-концевого фрагмента предшественника трипсиногена; приведите характеристику его физико-химических свойств; объясните связь между свойствами и функцией сигнального пептида. Заполните таблицу «Характеристика протеолитических ферментов желудочно-кишечного тракта».
* Написать в виде формулы 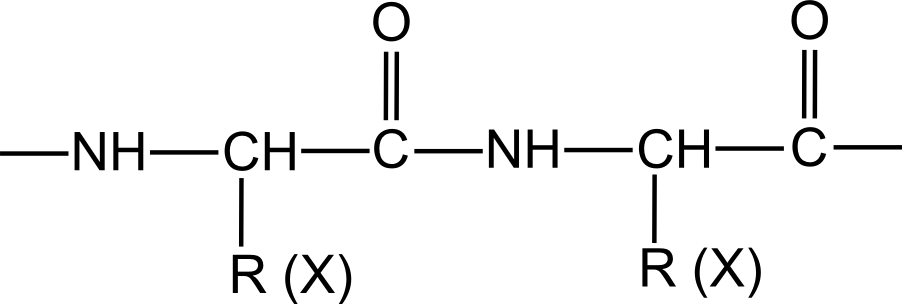 , указав принадлежность боковых радикалов R аминокислотам, участвующим в образовании атакуемой пептидной связи (например, в случае аланина – Ala, Х – любая аминокислота). , указав принадлежность боковых радикалов R аминокислотам, участвующим в образовании атакуемой пептидной связи (например, в случае аланина – Ala, Х – любая аминокислота).Заполните таблицу «Эндогенные ингибиторы протеиназ плазмы крови и их биологические эффекты»
Составьте схему каскада свертывания крови, показав регуляторные взаимосвязи между факторами внутреннего и внешнего пути. Отразите на схеме участие ингибиторов свертывания крови. Составьте схему каскада фибринолиза, показав участие активаторов и ингибиторов фибринолиза. Составьте схему каскада классического и альтернативного путей активации комплемента, показав участие ингибиторов комплемента, эффекты активированных компонентов системы комплемента. Составьте схему каскада ренин-ангиотензиновой системы, показав ее связь с калликреин-кининовой системой. Заполните таблицу «Аминокислоты как предшественники биологически активных веществ непептидной природы». В первой графе укажите название и формулу аминокислоты, во второй – название и формулу продуцируемого регулятора (гормона, нейромедиатора, локального регулятора), в третьей – название фермента, катализирующего реакцию образования конечного продукта, и его коферментов, в четвертой – биологические эффекты регулятора.
На схеме общего пути катаболизма (образование пирувата и ацетил-КоА, цикл трикарбоновых кислот) покажите участие аминокислот в восполнении субстратов и промежуточных продуктов данных реакций. Составьте схему синтеза серина из глюкозы. Укажите ферменты. Составьте схему метаболизма метионина: укажите продукты трансметилирования активированной формой метионина, опишите участие витаминов B6, B9, B12 и серина в реметилировании гомоцистеина. Составьте схему метаболизма фенилаланина. Укажите продуцируемые биологически активные вещества, ферменты и коферменты реакций. Укажите реакции, для которых описаны энзимопатии. При остром панкреатите (воспалении поджелудочной железы) вследствие спазма и отёка выводных протоков поджелудочной железы высвобождение проферментов и их активация происходит в самой ткани железы. Какие ферменты активируются в этом случае и каковы последствия их активации? Какими препаратами можно снизить активность протеиназ? Какие биохимические тесты Вы предложите для диагностики панкреатита? В какую сторону изменится азотистый баланс при недостаточном поступлении с пищей одной из незаменимых аминокислот? Ответ поясните. Для каких протеолитических ферментов желудочно-кишечного тракта не характерна активация путём ограниченного протеолиза? Чем отличаются продукты тотального и ограниченного протеолиза? Приведите примеры ферментов, катализирующих протеолиз того и другого типа. Какова их биологическая роль? Каковая роль витамина К в свёртывании крови? Перечислить витамин К-зависимые факторы свёртывания и антикоагулянты. Что их объединяет? Почему после забора крови, если не добавить в пробирку антикоагулянты, кровь начинает сворачиваться? Какие факторы свертывания принимают в этом участие? Перечислить механизмы защиты организма от чрезмерной гемокоагуляции. Каков механизм действия гепарина? Одним из факторов риска тромбозов является повышение концентрации в крови липопротеина (а), который в своем белковом фрагменте содержит последовательность аминокислот, имеющую высокое сходство с плазминогеном. Каков возможный механизм протромботического действия липопротеина (а)? Перечислить биологические эффекты активированных компонентов комплемента. Каковы механизмы защиты организма от чрезмерной активации системы комплемента? Для лечения артериальной гипертензии (стойкого повышения артериального давления) пациенту назначили препарат из класса ингибиторов ангиотензин-превращающего фермента. Уровень артериального давления снизился, однако у пациента на фоне лечения развился сухой кашель и отек в области лица. Каков возможный механизм побочного действия данного препарата? Чему равны суточная экскреция мочевины и аммиака в норме? Каково их молярное соотношение в крови? Каковы механизмы токсического действия аммиака? При каком синдроме концентрация мочевины в крови резко возрастает, как называется состояние повышения уровня данного метаболита в крови и каковы его последствия? Напишите реакции трансаминирования между аспартатом и альфа-кетоглутаратом, между глутаматом и пируватом. Дайте названия ферментам по прямой и обратной реакциям. Присутствие какого кофермента требуется для данных реакций? При каких патологиях наблюдается повышение в крови активности указанных ферментов? Напишите реакцию трансаминирования между фенилаланином и альфа-кетоглутаровой кислотой. Какова активность данной реакции в норме? При каком нарушении её скорость заметно повышена? Активность аланин-аминотрансферазы часто определяют путём добавления в инкубационную смесь лактат-дегидрогеназы (для определения аспартат-аминотрансферазы используют малат-дегидрогеназу) и НАДН, концентрацию которого можно детектировать спектрофотометрически при длине волны 340 нм. Объясните, как работает этот метод. Составьте уравнения реакций. Сравнить, сколько образуется АТФ при полном распаде аланина и лактата с учётом энергозатрат на утилизацию азота. При дефекте одного из ферментов цикла мочевины, аргининосукцинатлиазы, повышается концентрация в крови аммиака, при этом в моче определяется аргининосукцинат. Назначение малобелковой диеты и высоких доз аргинина снижает гипераммониемию. Объясните механизмы лечебного действия аргинина. На следующий день после употребления алкоголя в большом количестве у мужчины в моче было выявлено повышенное содержание аммиака. Концентрация аммиака в крови не превышала нормальных значений. Чем можно объяснить повышение содержания аммиака в моче у данного пациента? У детей с дефектом пируватдегидрогеназного комплекса развивается тяжелая неврологическая симптоматика и лактат-ацидоз. Присутствие в рационе каких аминокислот не приведёт к усугублению лактат-ацидоза? Для синтеза каких аминокислот обязательно поступление в организм других аминокислот? При стеатогепатозе (накоплении триглицеридов в гепатоцитах) нередко назначают препарат гептрал, который в своей основе содержит S-аденозилметионин. На чём основано терапевтическое действие данного препарата? Написать уравнение реакции. Повышение концентрации в крови гомоцистеина (гипергомоцистеинемия) является фактором риска развития тромбозов и острых сердечно-сосудистых событий (инфаркт, инсульт). Предположите, при дефекте каких ферментов и недостатке каких витаминов развивается гипергомоцистеинемия. Поясните Ваши рассуждения написанием уравнений реакций. У пациента с гипергомоцистеинемией в моче обнаружили повышенное количество метилмалоновой кислоты. Какова предполагаемая причина гипергомоцистеинемии у данного больного? Перечислите аминокислоты, для метаболизма которых требуется фолиевая кислота. Напишите уравнения реакций метаболизма аминокислот с участием данного витамина. Перечислите аминокислоты, для метаболизма которых требуется витамин В12. Напишите уравнения реакций метаболизма аминокислот с участием данного витамина. В каких реакциях принимает участие витамин В6? Напишите схемы реакций каждого типа. Концентрация каких биогенных аминов снижается при дефекте дигидробиоптеринредуктазы? Развивается ли при этом фенилкетонурия? Ответ поясните, написав уравнения реакций. Выпишите биогенные амины, принимающие участие в функции тромбоцитов, укажите их роль. Напишите уравнения ключевых реакций их синтеза с указанием коферментов. Заменимая аминокислота цистеин синтезируется из незаменимой аминокислоты метионина. Возможна регенерация использованного для реакции трансметилирования активированного метионина из продукта его обмена гомоцистеина. Напишите реакцию превращения гомоцистеина в метионин. Укажите фермент и витамины, принимающие участие в этом процессе. Напишите формулу 3’-фосфоаденозин-5’-фосфосульфата (ФАФС). Укажите аминокислоты, участвующие в его синтезе. Перечислите метаболические процессы, в которых принимает участие это вещество. Калликреин катализирует реакции ограниченного протеолиза ряда белков. Напишите не менее пяти реакций, катализируемых плазменным калликреином. Для выделения индивидуального белка из смеси белков используют метод аффинной хроматографии. Для этого необходимо получить аффинный сорбент. Какие лиганды можно использовать в создании сорбента для выделения из смеси плазменных белков α-2-макроглобулина? В ходе посттрансляционной модификации α-цепей коллагена аминокислотные остатки пролина и лизина подвергаются гидроксилированию под действием следующих ферментов: пролил-3-оксидаза, пролил-4-оксидаза, лизил-5-оксидаза. Напишите фрагмент первичной структуры α-цепи коллагена, содержащий полученные модифицированные остатки. Изобразите схемы: а) внутриклеточного этапа синтеза коллагена; б) внеклеточного этапа синтеза коллагена. В костной ткани человека процессы остеобласт-зависимого костеобразования уравновешены процессом остеокласт-зависимой резорбции кости. Внесите в таблицу названия внутриклеточных и секретируемых компонентов остеокласта, участвующих в резорбции кости.
В синтезе сложных биомолекул используются предварительно активированные мономеры. Составьте соответствующую таблицу.
|
