расчёт материального и теплового балансов. Первое высшее техническое учебное заведение россии санктпетербургский горный университет к афедра химических технологий и переработки энергоносителей
 Скачать 225.67 Kb. Скачать 225.67 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ «САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ» К
УЧЕБНО-МЕТОДИЧЕСКИЕ РАЗРАБОТКИ для проведения практических занятий по учебной дисциплине «РАСЧЁТ МАТЕРИАЛЬНОГО И ТЕПЛОГО БАЛАНСОВ В ТЕХНОЛОГИИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ» Специальность (направление подготовки):18.03.01. «Химическая технология» Специализация (профиль): Химическая технология природных энергоносителей и углеродных материалов Разработал: доцент С.К.Цветков Обсуждены и одобрены на заседании кафедры Протокол № 12 от 31 мая 2018 г. САНКТ-ПЕТЕРБУРГ 2018 Практическая работа 1. РАСЧЁТ ОСНОВНЫХ ТЕХНОЛОГИЧЕСКИХ ПОКАЗАТЕЛЕЙ 1. ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ Производительность – количество целевого продукта, производимое в единицу времени. Единицы измерения - кг/час, т/сут, т/год и т.п. 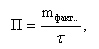 (1) где mфакт. - фактически полученная масса целевого продукта, τ - время его получения. Производительность установки зависит от объема реактора. Для того, чтобы сравнивать эффективность работы разных по объему реакторов, используют понятие «интенсивность». Интенсивность – количество целевого продукта, производимое в единицу времени с единицы объема реактора ( в случае гомогенных процессов, когда реакция протекает во всем объеме реактора) или с единицы поверхности катализатора (когда реакция протекает на поверхности катализатора). 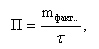 (2) 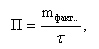 где Vреакт. - работающий объем реактора; τ - поверхность, на которой протекает реакция. Часто в технологической практике используются понятия «пропускная способность установки» и «мощность установки». Пропускная способность (производительность по сырью) – количество сырья, пропускаемое через установку в единицу времени. Единицы измерения - кг/час, т/сут, м3/час и т.п. Большая величина пропускной способности установки не является критерием ее эффективной работы. Мощность - это максимально возможная производительность установки. Мощность установки закладывается при ее проектировании и может быть изменена лишь в результате повышения эффективности проведения химико-технологического процесса или модернизации оборудования. Пример В колонну для окисления твёрдого парафина загружают 40 тонн парафина, который занимает 75% объёма колонны (высота 10 метров, диаметр 2,5 метра). Процесс окисления длится в среднем 18 часов. Рассчитайте производительность колонны и интенсивность процесса окисления парафина. Решение. Объём окислительной колонны:  (3) V=3,14·2,52/4·10=49 м3 Полезный объём колонны составит: Vпол = 0,75·49 = 36,8 м3 Производительность колонны: 40·1000 кг/18 ч = 2222, 2 кг/ч Интенсивность процесса окисления парафина: I=П/Vпол = =2222, 2 кг/ч / 36,8 м3 = 60,4 кг/м3·ч Задание 1. Производительность фабрики 10 000 т/сутки. Фабрика перерабатывает мерную руду с массовой долей меди 2 %; в медном концентрате массовая доля меди 20 %, в хвостах - 0,1 %.Определить извлечение меди в концентрат, хвосты, выходы этих продуктов и массу продуктов. Задание 2. Производительность фабрики 10 000 т/сутки, выход медного концентрата 5 %, цинкового-3 %.Сколько тонн меди и цинка теряется в сутки с хвостами, если массовая доля цинка и меди в хвостах, соответственно, 0,1 и 0,2 %. Задание 3. Вычислить, сколько тонн свинцового концентрата в сутки выдаст обогатительная фабрика, если её суточная производительность по руде 5 000 т, содержание свинца в руде 1,8 %, а в концентрате 60 %. Извлечение свинца в концентрат 92 %. Задание 4. Производительность фабрики 10 000 т/сутки. Определить массовую долю металла в исходной руде, если фабрика отгружает концентрат с массовой долей металла в нем 20 % в количестве 100 т/сутки и получает хвосты с массовой долей 0,1 %. Задание 5. Определить годовую производительность реактора по готовому продукту - уксусной кислоте СН3СООН. В реактор поступает 37000 м3/ч альдегидо-воздушной смеси с объёмной долей ацетальдегида СН3СНО 25%. Степень конверсии ацетальдегида 13,8%. селективность 95%. Задание 6. В колонну для окисления твёрдого парафина объёмом 50 м3 загружают 40 т парафина, который занимает 75% объёма реактора. Процесс окисления длится 18 часов. Рассчитайте часовую производительность колонны и интенсивность процесса окисления парафина. Практическая работа 2. РАСЧЁТ РАСХОДНЫХ КОЭФФИЦИЕНТОВ 1. ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ Расходные коэффициенты - величины, характеризующие расход различных видов сырья, воды, топлива, электроэнергии, пара на единицу вырабатываемой продукции. При конструировании аппаратов и определении параметров технологического режима задаются также условия, при которых рационально сочетаются высокая интенсивность и производительность процесса с высоким качеством продукции и возможно более низкой себестоимостью. Пример Определить расходные коэффициенты в производстве карбида кальция (технического), содержащего [% (масс.)]: CaC2 -78; CaO -15; C-3; прочие примеси- 4. Известь содержит 96,5% CaO. Содержание (%) в коксе: золы- 4, летучих - 4, влаги- 3. Расчёт вести на 1 т технического продукта. Молекулярная масса: CaC2- 64, CaO- 56. Решение. Карбид кальция получают по уравнению: CaO +3C = CaC2 +CO. В 1 т продукта содержится 0,78 т CaC2. Расход (т) извести CaO: по стехиометрическому соотношению 0,78·56/64 = 0,675 непрореагировавшей 1·0,15 = 0,15 суммарный 0,675 + 0,15 = 0,825 технической 0,825/0,965 = 0,85 Расход (т) углерода: На образование CaC2 0,78·3·12/64 = 0,44 Непрореагировавшего 1·0,03 = 0,03 суммарный 0,44 + 0,03 = 0,47 Содержание углерода в коксе составляет 100 - (4 + 4 + 3) = 89%, откуда расход кокса: 0,47/0,89 = 0,53 т. Задание 1. Рассчитать расходный коэффициент природного газа, содержащего 97% (об.) метана, в производстве уксусной кислоты (на 1 т) из ацетальдегида. Выход ацетилена из метана составляет 15% от теоретически возможного, ацетальдегида из ацетилена - 60%, а уксусной кислоты из ацетальдегида - 90% (масс.). Задание 2. Определить теоретические расходные коэффициенты для следующих железных руд в процессе выплавки чугуна, содержащего 92% Fe, при условии, что руды не содержат пустой породы и примесей. Задание 3. Определить расходные коэффициенты для сырья при производстве простого суперфосфата из 100 кг апатитового концентрата. Исходные данные: апатитовый концентрат с массовой долей P2O5 (в пересчёте на сухое вещество) 0,394 и воды 0,01; раствор серной кислоты с массовой долей H2SO4 0,76; для варки суперфосфата используется раствор серной кислоты с массовой долей H2SO4 0,68; норма кислоты 68 кг моногидрата на 100 кг апатитового концентрата; камерный суперфосфат с массовой долей: P2O5 общ. 0,208, P2O5 усв. 0,176, P2O5 своб. 0,11. Готовый суперфосфат содержит P2O5 общ. 21%. Задание 4. Вычислить расходный коэффициент колчедана с массовой долей серы 0,48 для получения раствора серной кислоты с массовой долей H2SO4 0,92. Массовая доля производственных потерь 0,08. Задание 5. Вычислить теоретические расходные коэффициенты для шпатового железняка, лимонита и магнитного железняка. Из этих руд выплавляется чугун с массовой долей железа 0,92. (Допускаем, что пустая порода в рудах отсутствует.) Задание 6. Определить расходные коэффициенты песка, мела, кальцинированной соды и сульфата натрия для варки простого стекла, учитывая, что на 100 кг стекла расходуется (без учёта производственных потерь) 74 кг песка, 18 - мела, 26 - соды и 1 кг сульфата натрия. Состав шихты (в массовых долях): кремнезема 0,74; CaO 0,10; Na2O 0,16; из них 0,155 массовой доли вводится за счёт соды и 0,005 за счёт сульфата натрия. Массовая доля потерь в процессе производства составляет 0,05. Практическая работа 3. РАСЧЁТ МАТЕРИАЛЬНОГО БАЛАНСА ПОЛУЧЕНИЯ СЕРНОЙ КИСЛОТЫ 1. ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ Для расчета материального баланса необходимо знать ряд фундаментальных понятий. Количество вещества (N) определяется совокупностью структурных элементов (атомов молекул, ионов и т.п.). Количество вещества измеряют в молях. Молем называет такое количество вещества, в котором содержится столько же структурных элементов (или их групп), сколько в 12 граммах (точно) изотопа углерода С12. Это число называют постоянной Авагадро. Постоянная Авагадро равна приблизительно 6,02252·1023 моль-1 (или 6,02252·1026 киломолъ) структурных элементов. В промышленных крупнотоннажных производствах количество вещества часто предпочитают измерять не в молях, а в киломолях. Киломоль в тысячу раз больше, чем моль. Молярной массой (М) называют отношение массы вещества к количеству вещества. Иначе говоря, молярная масса — это масса одного моля или киломоля и ее несложно рассчитать с помощью таблицы Д.И.Менделеева. Молярная масса измеряется в г/моль или кг/кмоль. Молярный объем (Vm) - это отношение объема вещества к количеству вещества. Иначе говоря, молярный объем - это объем одного моля или киломоля газообразного вещества, взятый при нормальных условиях. Для идеального газа при н. у. молярный объем составляет 22,4 л/моль или м3/кмоль. Используя молярную массу и молярный объем можно пересчитать количество молей соответственно в массу или объем вещества по формулам: Gi = Mi-Ni (1) Vi = Vm-Ni, (2) где Gi - масса i-ro вещества (кг); Vi - объем (м3); Mi - молярная масса (кг/кмоль); Vm - молярный объем (м3/кмоль). В химико-технологических расчетах используют различные способы выражения концентрации веществ, перечислим наиболее распространенные из них. Мольная доля (Zмольн.) - это отношение количества молей одного из компонентов смеси (Ni ) к общему количеству молей всей смеси (∑Ni): Zмольн. = Ni/∑Ni. (3) Объемная доля (Zoб.) - это отношение объема одного из компонентов смеси (Vi)к общему объему всей смеси (∑Vi): Zоб.=Vi/∑Vi. (4) Для идеальных газов при нормальных условиях мольные и объемные доли численно совпадают. Массовая доля (Zмасс.) - это отношение массы одного из компонентов смеси (Gi ) к общей массе всей смеси (∑Gi): Zмасс.= Gi /∑Gi (5) Численно мольные, объемные и массовые доли выражаются в долях единицы, при умножении их на 100% можно получить мольные, объемные и массовые проценты, соответственно. Пример Рассчитать материальный баланс реактора окисления оксида серы (IV). Степень превращения диоксида серы 0,93. На окисление диоксида серы пошло 5500 м3/ч кислорода. Концентрации компонентов в исходной смеси (объемные доли): оксид серы (IV) 0,13; кислород 0,07; оксид серы (VI) 0,01. Решение Составим уравнение реакции в обычном виде с учетом стехиомет-рических коэффициентов. 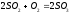 Кратко обозначим вещества латинскими буквами 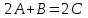 МА=64 [кг/кмоль] МВ=32 [кг/кмоль] МС=80 [кг/кмоль] Инертное вещество – азот N2 – I MI=28 [кг/кмоль] Объемные доли: ZA1=0,13 ZB1=0,07 ZC1=0,01 VB,1=5500 [м3/ч] Обозначим за Y количество вещества вступившего в реакцию кислорода. Составим балансовые уравнения по каждому веществу и суммарное уравнение мольных потоков. NA1 – 2Y = NA2 NB1 – Y = NB2 NC1 + 2Y = NC2 NI1=NI2 Суммируем потоки NA1 + NB1 + NC1 + NI1 - Y = NA2 + NB2 + NC2 + NI2 Или N01 –Y=N02 Рассчитаем значение Y: Так как известна степень превращения SO2, то 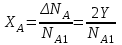 2Y=XA∙ZA1∙N01 VB1=ZB1∙V01 V01=VB1 / ZB1 N01=V01 / Vm = VB1 / (ZB1∙Vm) 2Y=XA∙ZA1∙ VB1 / (ZB1∙Vm) Y= XA∙ZA1∙ VB1 / (2∙ZB1∙Vm) Y= 0,93∙0,13∙5500/(2∙0,07∙22,4)=212,038 кмоль/ч Определим суммарный поток исходной смеси N01=V01 / Vm = VB1 / (ZB1∙Vm) N01 = 5500/(0.07∙22.4)= 3507.653 кмоль/ч N02 = N01 – Y = 3507,653 – 212,038 = 3295,615 кмоль/ч Находим количество молей каждого вещества в конечной и исходной смеси NA1 =N01∙ZA1 = 3507,653∙0,13=455,995 кмоль/ч NA2 = NA1 – 2Y = 455,995 – 2∙212,038 = 31,919 кмоль/ч NB1 = ZB1∙N01 = 0,07∙3507,653 = 245,536 кмоль/ч NB2 = NB1 - Y = 245.536 – 212,038 = 33,498 кмоль/ч NC1 = ZC1∙N01 = 0,01∙3507,653 = 35,077 кмоль/ч NC2 = NC1 + 2Y = 35,077 + 2∙212,038 = 459,153 кмоль/ч NI1 = N01 – NA1 - NB1 - NC1 =3507,653 – 455,995 – 245,536 – 35,077 = 2771,045 кмоль/ч NI1=NI2=2771,045 кмоль/ч Теперь известны количества всех веществ в начальной и конечной смеси. Рассчитаем массы, объемы и мольные доли и запишем в таблицу полученные данные. Gi = Mi ∙Ni Vi = Vm ∙ Ni Zi = Ni / N0 Материальный баланс
Задание 1. Рассчитать материальный баланс реактора окисления оксида серы (4). Степень превращения диоксида серы 0,9. Производительность 12000 м3/ч оксида серы (6). Концентрации компонентов в исходной смеси (объемные доли): оксид серы (4) 0,13: кислород 0,07: оксид серы (6) 0,01: остальное азот. Задание 2. Рассчитать материальный баланс реактора окисления оксида серы (4). Степень превращения диоксида серы 0,88. Производительность 8000 м3/ч оксида серы (6). Концентрации компонентов в исходной смеси (объемные доли): оксид серы (4) 0,13: кислород 0,07: оксид серы (6) 0,01: остальное азот. Задание 3. Рассчитать материальный баланс реактора окисления оксида серы (4). Степень превращения диоксида серы 0,94 Производительность 10500 м3/ч оксида серы (6). Концентрации компонентов в исходной смеси (объемные доли): оксид серы (4) 0,13: кислород 0,07: оксид серы (6) 0,01: остальное азот. Задание 4. Рассчитать материальный баланс реактора окисления оксида серы (4). Степень превращения диоксида серы 0,9. На окисление диоксида серы пошло 5000 м3/ч кислорода. Концентрации компонентов в исходной смеси (объемные доли): оксид серы (4) 0,12: кислород 0,07: оксид серы (6) 0,01. Задание 5. Рассчитать материальный баланс реактора окисления оксида серы (4). Степень превращения диоксида серы 0,92. На окисление диоксида серы пошло 4500 м3/ч кислорода. Концентрации компонентов в исходной смеси (объемные доли): оксид серы (4) 0,11; кислород 0,1: остальное азот. Задание 6. Рассчитать материальный баланс реактора окисления оксида серы (4). Степень превращения диоксида серы 0,89. На окисление диоксида серы пошло 4400 м3/ч кислорода. Концентрации компонентов в исходной смеси (объемные доли): оксид серы (4) 0,11: кислород 0,1; остальное азот. Практическая работа 4. РАСЧЁТ МАТЕРИАЛЬНОГО БАЛАНСА ПОЛУЧЕНИЯ АММОФОСА 1. ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ Аммофос получают нейтрализацией аммиаком экстракционной или термической фосфорной кислоты Образовавшуюся пульпу, твердая фаза которой состоит из NH4H3PО4, (NH4)3HPО4 и продуктов нейтрализации примесей фосфорной кислоты, упаривают, гранулируют, а затем сушат в аппаратах БГС — барабанном грануляторе-сушилке — в смеси с ретуром готового продукта. Пример Определить, какое количество ретура готового продукта — аммофоса, содержащего 2,5% Н2О, необходимо смешать с аммофосной пульпой, содержащей 40% Н2О, чтобы получить шихту с влажностью 10%. Расчет ведем на 1000 кг пульпы. Решение. Обозначим через х необходимое количество ретура. Очевидно, что 0,40-1000 + 0,025x = 0,1 (1000 –x), откуда х = 4000 кг. Задание 1. Составить материальный баланс сатуратора для нейтрализации кислоты в производстве аммофоса (на 1000 кг фосфорной кислоты). Состав экстракционной фосфорной кислоты: 25% Р2О6; 3,75% SO3; 3,6% MgO; 0,2% CaO; 1,3% А12О3; 1,3% Fe2О3; 1,86% F. Состав жидкого аммиака: 99% NH3; 1% Н2О. В процессе насыщения кислоты аммиаком испаряется 78 кг воды на 1000 кг кислоты. Содержание аммиака в нейтрализованной пульпе составляет 27% от общего количества Р2О6,. Задание 2. Определить количество воды, удаляемой в 1 ч при сушке аммофосной пульпы от начальной влажности 40% до конечного влагосодержания, равного 2,5%, для завода производительностью 640 000 т продукта в год, если из 1000 кг фосфорной кислоты (32% Р2О6) получается 588,7 кг сухих солей, а соответствующее им количество пульпы равно 990 кг. Задание 3. Определить количество термической фосфорной кислоты (52% Р2О5) и аммиака, необходимых для получения фосфатов аммония цеха нитроаммофоски производительностью 31,4, т/ч, содержащей 16,6% Р2О5. До аммонизации кислоту разбавляют до концентрации 47% Р2О5. Аммонизацию кислоты проводят до мольного отношения NH3/Н3PO4 = 0,7. В поступающем аммиаке содержится 99 % NH3 и 1 % влаги. Задание 4. Определить, какое количество ретура готового продукта — аммофоса, содержащего 2,6% Н2О, необходимо смешать с аммофосной пульпой, содержащей 41% Н2О, чтобы получить шихту с влажностью 12%. Расчет ведем на 1000 кг пульпы. Задание 5. Определить количество воды, удаляемой в 2 ч при сушке аммофосной пульпы от начальной влажности 42% до конечного влагосодержания, равного 2,6%, для завода производительностью 740 000 т продукта в год, если из 1000 кг фосфорной кислоты (31% Р2О6) получается 588,7 кг сухих солей, а соответствующее им количество пульпы равно 1000 кг. Задание 6. Составить материальный баланс сатуратора для нейтрализации кислоты в производстве аммофоса (на 2000 кг фосфорной кислоты). Состав экстракционной фосфорной кислоты: 26% Р2О6; 3,79% SO3; 3,5% MgO; 0,23% CaO; 1,35% А12О3; 1,38% Fe2О3; 1,9% F. Состав жидкого аммиака: 99% NH3; 1% Н2О. В процессе насыщения кислоты аммиаком испаряется 79 кг воды на 1000 кг кислоты. Содержание аммиака в нейтрализованной пульпе составляет 28% от общего количества Р2О6,. Практическая работа 5. РАСЧЁТ ТЕПЛОВОГО БАЛАНСА КОНТАКТНОГО ОКИСЛЕНИЯ СЕРНИСТОГО ГАЗА 1. ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ Энергетический (тепловой) баланс любого аппарата может быть представлен в виде уравнения, связывающего приход и расход энергии процесса. Энергетический баланс составляется на основе закона сохранения энергии, в соответствии с которым в замкнутой системе сумма всех видов энергии постоянна. Обычно для химико-технологических процессов составляется тепловой баланс. Для аппаратов непрерывного действия тепловой баланс составляют на единицу времени, а для аппаратов периодического действия - на время цикла обработки. Применительно к тепловому балансу закон сохранения энергии формулируется следующим образом: приход теплоты в данном аппарате должен быть равен расходу теплоты в том же аппарате. т.е. тепловые потоки, увеличивающие количество тепла внутри системы, берутся со знаком плюс и относятся к статьям прихода. Соответственно тепловые потоки, которые уменьшают количество тепла внутри системы, относятся к статьям расхода. При составлении теплового баланса учитывается теплота, поступающая с потоком исходного сырья Q01 теплота химической реакции Qx.p: теплота подводимая или отводимая с помощью теплообменных устройств Qт.о.: теплота, уходящая с потоком продуктов Q02: теплота фазовых переходов Q02: потери тепла в окружающую среду Qп: положительное или отрицательное накопление теплоты в объеме аппарата Qнак. Для стационарного режима работы аппарата Qнак. равно нулю. т.е. уравнение теплового баланса можно записать следующим образом: Теплоту, поступающую с потоком сырья и уходящую с потоком продуктов, рассчитывают следующим образом: где N01, N02 - суммарные мольные потоки на входе и выходе из реактора (кмоль/ч): Cp1, Ср2 - средняя мольная теплоемкость смеси на входе и выходе из реактора (кДж/(кмоль-К): Т1 , Т2 - температура смеси на входе и выходе из реактора (К). Среднюю теплоемкость для реакции можно рассчитать по уравнениям: где ZА1, ZВ1, ZС1, ZD1, ZI1 и ZА2, ZВ2, ZС2, ZD2, ZI2 - мольные доли веществ в начальной и конечной смеси, соответственно: СрА, СрB, СрC, СрD, CpI - мольные теплоемкости веществ, приведены в справочниках термодинамических величин. Пример Составить тепловой баланс контактного аппарата для частичного окисления SO2 производительностью 25000 м3/час, если состав газовой смеси: SO2 - 9% (об.); О2 - 11% (об.); N2 - 80% (об.). Степень окисления - 88%. Температура входящего газа 460оС. Выходящего – 580 °С. Среднюю теплоемкость смеси (условно считать ее неизменной): с = 2,052 кДж/м3 °С. Потери теплоты в окружающую среду принимаем 5% от прихода теплоты. Процесс идет по реакции: SO2 (г)+ 1/2О2(г)=SO3(г).+ 94 207 кДж. Решение Тепловой баланс контактного аппарата: Приход теплоты. Физическая теплота газа определяется по формуле: Q1 = V·с·t , где V - объем газообразного вещества, м3; с - средняя теплоемкость этого вещества, кДж/(м3·град); t - температура, град. Q1=25000·2,052·460 = 23598000кДж Теплота реакции: 22,4 м3- 94207 кДж 2250 м3 - Х, Х = 94627567 кДж или с учетом степени окисления 94627567 кДж -100% Q2-88% , Q2 = 8327225 кДж Общий приход тепла Q = Q1 + Q2 = 23598000 + 8290216 = 31888216 кДж Расход теплоты. Теплота, уносимая отходящими газами: Q3= 24010·2,052·580 = 28575742 кДж Тепловые потери: Qпот=31925226·0,05=1596261 кДж Общий расход теплоты: Qрасх= Q3+ Qпот=30172003 кДж Следовательно, необходимо отвести теплоты: Qотв= Qпот- Qрасх= 3192522-30172003=1753223 кДж. Составляем таблицу теплового баланса:
Задание 1. К заданию 1 из Практической работы 3, рассчитать температуру смеси на выходе из реактора, если температура входной смеси 420°С, потери тепла в окружающую среду составляют 3% от теплоты, поступающей с потоком исходных веществ, а с помощью теплообменных устройств отводят 40% теплоты химической реакции. Задание 2. К заданию 2 из Практической работы 3, рассчитать температуру смеси на выходе из реактора, если температура входной смеси 425°С, потери тепла в окружающую среду составляют 5% от теплоты, поступающей с потоком исходных веществ, а с помощью теплообменных устройств отводят 70% теплоты химической реакции. Задание 3. К заданию 3 из Практической работы 3, рассчитать температуру смеси на выходе из реактора, если температура входной смеси 390°С, потери тепла в окружающую среду составляют 2% от теплоты, поступающей с потоком исходных веществ, а с помощью теплообменных устройств отводят 20% теплоты химической реакции. Задание 4. К заданию 4 из Практической работы 3, рассчитать температуру смеси на выходе из реактора, если температура входной смеси 395°С, потери тепла в окружающую среду составляют 2% от теплоты, поступающей с потоком исходных веществ, а с помощью теплообменных устройств отводят 20% теплоты химической реакции. Задание 5. К заданию 5 из Практической работы 3, рассчитать температуру смеси на выходе из реактора, если температура входной смеси 420°С, потери тепла в окружающую среду составляют 2% от теплоты, поступающей с потоком исходных веществ, а с помощью теплообменных устройств отводят 20% теплоты химической реакции. Задание 6. К заданию 6 из Практической работы 3, рассчитать температуру смеси на выходе из реактора, если температура входной смеси 350°С, потери тепла в окружающую среду составляют 4% от теплоты, поступающей с потоком исходных веществ, а с помощью теплообменных устройств отводят 50% теплоты химической реакции. Практическая работа 6. РАСЧЁТ ТЕПЛОВОГО БАЛАНСА НЕЙТРАЛИЗАЦИИ АММИАКОМ ЭКСТРАКЦИОННОЙ ФОСФОРНОЙ КИСЛОТЫ 1. ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ Нейтрализация аммиаком фосфорной кислоты сопровождается реакциями: Н3PO4 + NH3==NH4H2PO4 NH4H2PO4 + NH3 = (NH4)2HPО4 H2SО4 + 2NH3 = (NH4)2SО4 Пример Рассчитать тепловой баланс сатурации в производстве аммофоса на 1000 кг фосфорной кислоты. Температуры: поступающей кислоты 60 °С, аммиака — 27 °С, при давлении 152 кПа (1,5 атм), отходящей пульпы 102 °С. Решение Приход теплоты Выделение теплоты за счет реакций: · образования моноаммонийфосфата Н3РО4 + NH3 = NH4H2PO4 + 75 362 кДж/кмоль; Q1 = mост(NH3) ∙ ΔН1 / М(NH3) = 73,1 ∙ 75362 / 17 = 324056,6 кДж mост(NH3) – масса (в кг) вступившего в реакцию аммиака; · образования диаммонийфосфата из моноаммонийфосфата NH4H2PО4 + NH3 = (NH4)2HPО4 + 96 296 кДж/кмоль; Q2 = mизб(NH3) ∙ΔН2 / М(NH3) = 5,6 ∙ 96296 / 17 = 31721,0, кДж, где mизб(NH3) - масса (в кг) аммиака, реагирующего с моноаммонийфосфатом; · образования сульфата аммония H2SО4 + 2NH3 = (NH4)2SО4 + 193 849 кДж/кмоль; Q3 = m(NH3) ∙ ΔН3 / (2∙ М(NH3)) = 12,3 ∙ 193 849 / (2 ∙ 17) = 70127,7 ,кДж: m(NH3) —масса (в кг) аммиака, связываемого в сульфат аммония. Всего за счет химических реакций Qх.р = Q1 + Q3 + Q3 = 324056,6 + 31721,0 + 70127,7 = 425905,3 кДж (Тепловые эффекты других реакций в расчет не включены из-за их малости). Теплота, вносимая кислотой и аммиаком Qк = m(фосфорной кислоты)∙ cкислоты ∙ tкислоты + ΔН ∙ mо(NН3)= = 1000 ∙ 2,868 ∙ 60 + (-117,2∙ 94,5)= 161004,6 кДж, где m(фосфорной кислоты) — масса фосфорной кислоты, кг; cкислоты — средняя удельная теплоемкость кислоты, кДж/(кг ∙ К); tкислоты — температура кислоты, °С; ΔН — энтальпия аммиака при -27 °С и 152 кПа (1,5 атм), кДж/кг; mо(NН3) —масса аммиака, кг. Всего поступает теплоты Qприход = Qх.р + Qк = 425905,3 + 161004,6 = 586909,9 кДж. Расход теплоты Нагревание пульпы до 102°С Qпульпы = m(материала) ∙ cпульпы ∙ tпульпы = 1097,4∙ 2,721 ∙ 102 = 304574,6 кДж где m(материала) — количество пульпы, кг; cпульпы — средняя удельная теплоемкость пульпы, кДж/(кг∙К); tпульпы — температура пульпы, °С. Теплопотери в окружающую среду принимаем равными 3% от общего количества подводимой теплоты Qпотерь = Qприход ∙ 0,03 = 586909,9 ∙ 0,03 = 17607,3 кДж Всего расходуется теплоты Qрасх. = Qпотерь + Qпульпы = 17607,3 + 304574,6 = 322181,9 кДж. Избыток теплоты расходуется на испарение воды: Qиспарение = Qприход - Qрасх. = 586909,9 – 322181,9 = 264728,0 кДж. Количество испаряющейся воды составит: mводы = Qиспарение / q = 264728,0 / 2253 = 117,5 кг где q — теплота испарения воды, кДж/кг. Общий расход теплоты: Qрасход = Qпульпы + Qпотерь + Qиспарение = 304574,6 + 17607,3 + 264728,0= 586909,9 кДж Тепловой баланс сатурации фосфорной кислоты аммиаком (на 1000 кг фосфорной кислоты) представляем в виде таблицы:
Задание 1. Рассчитать тепловой баланс сатурации в производстве аммофоса на 990 кг фосфорной кислоты. Температуры: поступающей кислоты 61 °С, аммиака — 27 °С, при давлении 152 кПа (1,5 атм), отходящей пульпы 102 °С. Задание 2. Рассчитать тепловой баланс сатурации в производстве аммофоса на 998 кг фосфорной кислоты. Температуры: поступающей кислоты 60 °С, аммиака — 28 °С, при давлении 152 кПа (1,5 атм), отходящей пульпы 101 °С. Задание 3. Рассчитать тепловой баланс сатурации в производстве аммофоса на 1000 кг фосфорной кислоты. Температуры: поступающей кислоты 65 °С, аммиака — 28 °С, при давлении 152 кПа (1,5 атм), отходящей пульпы 100 °С. Задание 4. Рассчитать тепловой баланс сатурации в производстве аммофоса на 800 кг фосфорной кислоты. Температуры: поступающей кислоты 59 °С, аммиака — 26 °С, при давлении 152 кПа (1,5 атм), отходящей пульпы 104 °С. Задание 5. Рассчитать тепловой баланс сатурации в производстве аммофоса на 1100 кг фосфорной кислоты. Температуры: поступающей кислоты 60 °С, аммиака — 28 °С, при давлении 152 кПа (1,5 атм), отходящей пульпы 101 °С. Задание 6. Рассчитать тепловой баланс сатурации в производстве аммофоса на 1200 кг фосфорной кислоты. Температуры: поступающей кислоты 60 °С, аммиака — 27 °С, при давлении 152 кПа (1,5 атм), отходящей пульпы 102 °С. Библиографический список 1. Балабанович. Я. К. Технологические расчеты современных схем производства сложных фосфоросодержаших удобрений [Текст] : учеб, пособие / Я. К. Балабапович. - Л. : СЗПИ, 1985. – 66 с. 2. Дыбина П. В. Расчеты по технологии неорганических веществ [Текст] : учеб, пособие для вузов / [П. В. Дыбина, А. С. Соловьева, Ю. И. Вишняк]: иод ред. 11. В. Дыбиной. - М. : Высш. шк., 1967. – 522 с. 3. Козадерова. О.А. Расчеты материальных и тепловых балансов п технологии минеральных удобрений [Электронный ресурс]: учеб, пособие / О.А. Козадерова. С.И. Нифталиев. - Воронеж: Воронежский государст-венный университет инженерных технологий, 2018. - 57 с. http://biblioclub.ru/index.php?page=book&id=488010 4. Позин М.Е. Расчеты по технологии неорганических веществ [Текст] : учеб, пособие для вузов / [М. Е. Позин и др.]; пол общ. ред. М. Е. Позина. - Л.: Химия, 1977. – 494 с. 5. Туболкин А.Ф. Расчеты химико-технологических процессов [Текст] : учеб, пособие .для вузов / [А. Ф. Туболкин и др.]; под общ. ред. И. П. Мухленова. - Л.: Химия, 1976. – 299 с. 6. Филимонова, О.Н. Технологические расчеты производственных процессов [Электронный ресурс]: учеб, пособие / 0.11. Филимонова, М.В. Ешотина. - Воронеж: Воронежский государственный университет инженерных технологий, 2012. –116 с. http://biblioclub.ru./index.php?pagc=book&id=142063 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
