коммуникация. инструмент кин ru. Подпишитесь на Deepl pro для редактирования данного документа
 Скачать 2.17 Mb. Скачать 2.17 Mb.
|
ПатофизиологияВлияние компрессии на нервное волокно Тяжесть повреждения нерва, вызванного острой и или хронической компрессией, зависит от продолжительности компрессионной травмы. Начало, как и восстановление нерва, может быть различным и отражает основную патофизиологию травмы. Нервные волокна проявляют свою восприимчивость к компрессии по-разному в зависимости от их калибра, длины пучка, а также расположения пучка в нервном стволе [6]. Более крупные волокна более восприимчивы к ишемии и компрессии по сравнению с более тонкими волокнами, а волокна, расположенные на периферии пучка, страдают больше по сравнению с теми, которые расположены более центрально. Аналогично, нервные волокна, расположенные в более поверхностных пучках, травмируются сильнее, чем те, которые расположены более центрально. Кроме того, конституция нервного ствола в месте сдавления является важным фактором, определяющим степень повреждения нерва. компрессионное повреждение: крупные пучки, расположенные в небольшом количестве эпиневральной ткани, более уязвимы к многочисленным компрессиям, чем маленькие пучки, расположенные и погруженные в большое количество эпиневральной ткани [2]. Физиопатологические основы острой и хронической компрессии противоречивы: в качестве первичных причин функционального дефекта были предложены как ишемические, так и ме- ханические факторы. Эта проблема трудноразрешима, поскольку все компрессионные силы, по определению, включают ишемические факторы, вторичные по отношению к облитерации микрососудов нерва. Как правило, умеренная или незначительная компрессия, приводящая к функциональному нарушению, которое сразу же обратимо и является следствием компрессии, свидетельствует о непосредственном обнаружении микрососудистой недостаточности, тогда как механические факторы, провоцирующие очаговое повреждение миелина, могут составлять этиологические факторы первостепенной важности при травмах, требующих, прежде всего, более длительного времени восстановления. Влияние компрессии на микрососудистые интраневральные структуры Эффект локальной компрессии был экспериментально изучен на животных с использованием различных миниатюрных моделей компрессии (рис. 5.6, 5.7). Rydevik [7, 8] в своем интраоперационном микроскопическом исследовании обнаружил, что внешнее компрессионное давление в 20 - 30 мм рт. ст. вызывает замедление потока венул эпиневрия. При увеличении компрессионного давления уменьшается и эндоневральный капиллярный поток. При давлении 80 мм рт. ст. возникает полный интраневральный стаз потока только в сегменте сдавленного нерва (ишемия) (табл. 5.6). Результаты Rydevik были недавно подтверждены другими авторами. 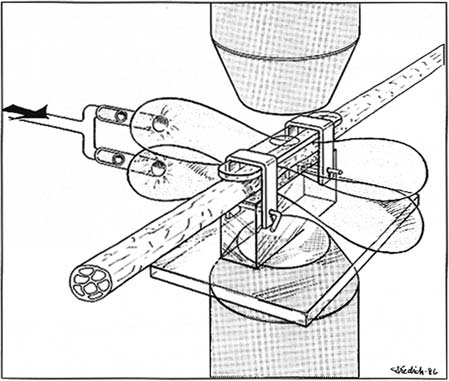 Рис. 5.6. Принципы интравитального микроскопического наблюдения интраневральной микроциркуляции в большеберцовом нерве кролика при компрессии. Нерв сдавливается двумя прозрачными манжетами, надутыми до нужного давления (из [2]). 5 Патофизиология компрессии срединного нерва 33 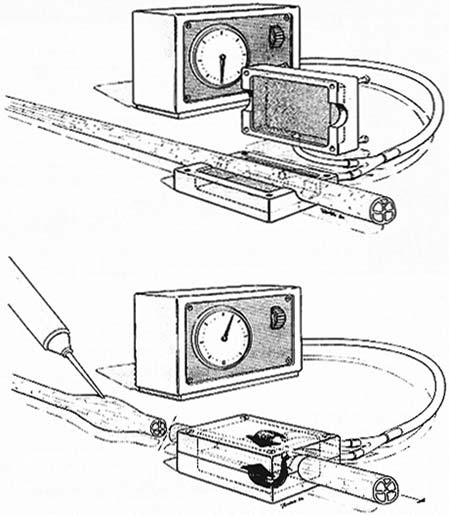 Рис. 5.7. Постепенное сжатие нерва миниатюрной манжетой, используемой для исследования сосудистой проницаемости и аксонального транспорта (из [2]) Таблица 5.6. Влияние давления на интраневральный микрососудистый поток  [8] Аксональный транспорт и компрессия нервов В 1948 году Weiss и Hiscoe [9] сообщили, что сдавление нерва указывает на отек и скопление жидкости в области, расположенной проксимальнее места повреждения. Они предположили, что это происходит из-за обструктивного эффекта на аксо-плазму внутри нервного волокна. Теоретически можно предположить, что компрессия препятствует аксональному транспорту прямым и механическим или вторичным образом посредством облитерации интраневральных сосудов с последующей аноксией. В экспериментальных исследованиях [10, 11], где нерв сдавливался на локальном уровне с помощью пневматического жгута, было продемонстрировано, что даже ограниченное сдавливание может препятствовать аксональному транспорту. Быстрый аксональный транспорт, изучаемый с помощью транспорта про- теина, остается нормальным до достижения давления 20 мм рт. ст. в течение 2 ч; при увеличении продолжительности (8 ч) наблюдается накопление материала проксимальнее места компрессии. Давление 30 мм рт. ст. в течение 2 ч вызывает частичное или полное торможение. Блокирование быстрого аксонального транспорта обратимо в течение 24 ч только в том случае, если Таблица 5.7. Влияние давления на быстрый антероградный аксональный транс- порт
[11, 43, 46] Таблица 5.8. Влияние давления на медленный антероградный аксональный транс- порт
[46] Таблица 5.9. Влияние давления на ретроградный аксональный транспорт
[43, 46] Далин и др. 1984, Далин и Маклин 1986 она не превышает компрессию более чем на 50 мм рт. ст. Транспортная блокада обратима только через 3 дня, если давление 200 мм рт. ст. применялось только в течение 2 ч, и в течение 7 дней после давления 400 мм рт. ст. в течение 2 ч (табл. 5.7). В другом экспериментальном исследовании было показано, что если метаболическое повреждение аксонального транспорта уже существует, например, у крыс с диабетом, вызванным стрептозотоцином, то быстрый аксональный транспорт значительно вовлекается по сравнению с контрольной группой. Это указывает на то, что нервы диабетических животных более восприимчивы к компрессии по сравнению с нервами здоровых животных. Медленный аксональный транспорт изучали Dahlin и McLean [12] (табл. 5.8). Сжатие 20 мм рт. ст., применяемое в течение более 8 ч, не вызывает накопления материала, транспортируемого медленным потоком, в то время как давление 30 мм рт. ст., применяемое в течение 8 ч, приводит к значительному накоплению жидкости, но не всех белков, которые были транспортированы медленным потоком. Эти результаты показывают, что даже самое низкое компрессионное давление может препятствовать медленному или быстрому аксональному потоку. Однако даже низкое давление представляет интерес, поскольку подобное давление было обнаружено в запястном канале у пациентов, страдающих СТС. Такое же низкое давление может даже вовлекать ретроградный аксональный транс- порт (табл. 5.9). В экспериментальном исследовании на животных 34 I Генерал 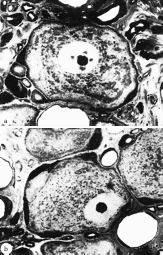 и несжатой области. Различные экспериментальные исследования показали, что такое перераспределение ткани часто не поддается измерению при использовании компрессионных инструментов и повреждает травмированные волокна, в то время как давление, более равномерно приложенное к нерву, вызывает незначительное повреждение волокон Интересные исследования были проведены в отношении компрессии нерва, возникшей в результате применения внешних компрессионных инструментов. В этой ситуации нерв сдавливается не прямолинейно по всей поверхности наложения жгута, а преимущественно на уровне границы, где касательные силы максимальны. В экспериментальном исследовании на обезьянах было показано, что узлы Рейнера перемещаются в сторону несжатой части нерва. Паранодальный миелин перемещается из одной части узла и складывается в другую. Это изменение положения происходит как в проксимальной, так и в дистальной части сдавливающего жгута и сопровождается сегментарной демиелинизацией и последовательной блокадой проводимости, обратимой через несколько недель или месяцев. Считается, что наблюдаемая очаговая демиелинизация [13 - 15] является прямым следствием механического давления, вызываемого сжимающим жгутом. Пауэлл и Майерс и несжатой области. Различные экспериментальные исследования показали, что такое перераспределение ткани часто не поддается измерению при использовании компрессионных инструментов и повреждает травмированные волокна, в то время как давление, более равномерно приложенное к нерву, вызывает незначительное повреждение волокон Интересные исследования были проведены в отношении компрессии нерва, возникшей в результате применения внешних компрессионных инструментов. В этой ситуации нерв сдавливается не прямолинейно по всей поверхности наложения жгута, а преимущественно на уровне границы, где касательные силы максимальны. В экспериментальном исследовании на обезьянах было показано, что узлы Рейнера перемещаются в сторону несжатой части нерва. Паранодальный миелин перемещается из одной части узла и складывается в другую. Это изменение положения происходит как в проксимальной, так и в дистальной части сдавливающего жгута и сопровождается сегментарной демиелинизацией и последовательной блокадой проводимости, обратимой через несколько недель или месяцев. Считается, что наблюдаемая очаговая демиелинизация [13 - 15] является прямым следствием механического давления, вызываемого сжимающим жгутом. Пауэлл и Майерс[16] показали, что локальный некроз шванновских клеток возникает до того, как происходит очаговая демиелинизация. Некроз может быть спровоцирован локальным ишемическим воздействием, поскольку этот физиопатологический механизм является наиболее вероятным для последовательной паранодальной демиелинизации.  Рис. 5.8. a Нормальная нервная клетка с обильным веществом Ниссля и центральным ядром. Клетка получена из ганглия, где вагус не подвергался никакой травме. B Нервная клетка с нарушенным веществом Ниссля (хроматолиз) и периферическим расположением ядра. Клетка взята из ганглия, где блуждающий нерв был сдавлен при 30 мм рт. ст. в течение 2 ч на 1 неделе до оценки морфологии (метиленовый синий и Azur II: × 1000) (из [2]) было показано, что давление в 20 - 30 мм рт. ст., применяемое в течение 8 часов, вызывает торможение ретроградного аксонального транспорта. Компрессия в 200 мм рт. ст. в течение 8 ч вызывает большее торможение этого типа потока. Далин наблюдал изменение морфологии тела клетки нейрона после применения низкого давления для сжатия ре- спективных нервных волокон. При давлении 30 мм рт. ст. можно наблюдать увеличение объема и ядерной плотности, эксцентриситет ядра и дисперсию вещества Ниссля (хрома-толиз) до 7 дней после компрессии (рис. 5.8). Такой тип поведения клеточного тела хорошо известен и встречается он-ли после сильного раздавливания или рассечения нерва.  Влияние давления на нервные волокна Компрессия нервного ствола может вызвать повреждение посредством прямого давления или связанных с ним касательных сил с перераспределением тканей из сдавленного Интраневральный отек в результате компрессии Компрессия с последующей полной и субтотальной ишемией может привести к повреждению всех интраневральных тканей, включая шванновские клетки, нервные волокна и интраневральные микрососуды. Повреждение микрососудов может быть связано с увеличением проницаемости мембраны для белков, а длительные периоды ишемии могут сопровождаться интраневральным отеком сразу после восстановления кровотока [17 - 20]. Этот локальный отек, называемый "феноменом нерефлюкса" [21, 22, 23] или "синдромом закрытого отсека", является хорошо известным явлением, которое возникает в мышечной ткани после тяжелого ишемического повреждения нервов и мышц. Влияние этого явления на нервы весьма критично и может вызвать функциональный барьер в околонервном слое [24]. Интрафасцикулярные сосуды особенно устойчивы к ишемии. Полная ишемия, продолжающаяся 6 ч, может сопровождаться полным восстановлением микрососудов с тромбозом или без него. Это явление может быть связано с локальным высвобождением факторов, активирующих плазминоген, из эндотелия эндоневральных сосудов при длительной ишемии, например, 8 ч и более, интенсивным эндоневральным отеком, связанным с "феноменом нерефлюкса". Эксперименты на животных показали, что этот тип эндоневрального отека 5 Патофизиология компрессии срединного нерва 35 Таблица 5.10. Влияние давления на интраневральный отек
[43, 46] После этого наступает необратимое повреждение функции нерва. Когда нерв подвергается локальной компрессии, необходимо учитывать ширину и длину накладываемого жгута, а также продолжительность давления, поскольку распределение внутрисосудистого эде-ма после сдувания жгута зависит от этих факторов, так как провоцируемое повреждение основано на этих факторах. Изменения ин-траневральной микрососудистой проницаемости были экспериментально изучены при различных уровнях компрессии (50 - 200 - 400 мм рт. ст.) с помощью миниатюрного жгута, накладываемого вокруг нерва (табл. 5.10). Компрессия в 50 мм рт. ст. в течение 2 ч вызывает отек, который остается строго в эпиневрии. Отек не достигает эндоневрия из-за барьерного эффекта периневрального слоя. Давление 200 - 400 мм рт. ст. в течение 2 ч продемонстрировало значительный объем микрососудистого повреждения краев сжатого сегмента. На это указывала венозная утечка введенного трассирующего материала. Следовательно, по краям компрессии был обнаружен интенсивный эндоневральный отек, в то время как в центре компрессированного сегмента он отсутствовал. Компрессия при давлении 200 мм рт. ст. в течение 2 ч или 400 мм рт. ст. в течение 15 мин сопровождалась эндоневральным отеком только в некоторых пучках по краям компрессии, но вместо этого более длительная компрессия приводила к появлению отека во всех пучках. Если давление составляло 200 мм рт. ст. и применялось в течение 4 или 6 часов, отек был заметен даже в центре сжатого сегмента. Эти данные показывают, что размеры и продолжительность компрессии играют очень важную роль в определении интраневрального отека, и что повреждения сосудов более очевидны по краям зоны компрессии. Повреждения нервных волокон происходят на краевых уровнях, и этот феномен получил название "краевой эффект". Эксперименты Ридевика [7, 8] показали, что Давление 80 мм рт. ст., приложенное в течение 2 ч, вызвало быстрое восстановление микрососудов; однако нервы, сдавленные при давлении 400 мм рт. ст. в течение того же периода времени, не продемонстрировали или продемонстрировали только частичное восстановление микроциркуляции сдавленного сегмента даже по истечении 7 дней (табл. 5.11). Этот "феномен нерефлюкса" основан на массивном интраневральном отеке в сдавленном нерве. Таблица 5.11. Влияние интраневрального отека на микрососудистый поток
[8] сегмента, связанное с прямой механической травмой интраневральных микрососудов на уровне компрессионного края, что в совокупности препятствует реперфузии сдавленного сегмента. Lundborg [2], а также Powell и Myers [16], изучали эффект межнейронального отека, возникающего в нервах после локального сдавления минипневматическими жгутами. В норме внутреннее тканевое давление пучков слегка положительное (2,0 +/- 1,0 см H2 O) [25, 26]. Давление ткани оценивается с помощью микропипетки после наложения компрессии от 1 до 24 ч, в то время как одновременно проводится гистологическая оценка нервного волокна, его ультраструктуры и эндоневрального содержимого в течение периода времени до 28 дней после снятия компрессии. Можно наблюдать увеличение эндо- неврального отека и давления тканевой жидкости до 4 раз в час после снятия компрессии 80 мм рт. ст. в течение 4 ч и до 3 раз после компрессии при 30 мм рт. ст. в течение 8 ч (рис. 5.12). Удалось даже зарегистрировать аналогичное значение давления через 24 ч после операции, а эндоневральный отек сохранялся даже через 28 дней с момента наложения компрессии. Микроскопические исследования выявили патологические изменения субпериневральных волокон с демиелинизацией даже в нервах, подвергшихся давлению всего в 10 мм рт. ст. В шванновских клетках после компрессии в 80 мм рт. ст. в течение всего 2 ч наблюдалось набухание и цитоплазматическая дезинтеграция в течение 28 дней с момента обработки. Увеличение давления тканевой жидкости происходит параллельно с увеличением эндоневрального отека, что имеет важное значение для понимания патофизиологии острой или хронической компрессии нервов. Постоянное повышение давления эндоневральной тканевой жидкости может привести к повреждению нервных волокон и изменению электролитического состава эндоневральной жидкости, что вызывает повреждение нервной проводимости. Повышение давления эндоневральной жидкости нарушает эндоневральную капиллярную микроциркуляцию, поэтому общее количество эндоневральных капилляров Таблица 5.12. Влияние давления на эндоневральный отек
[16] 36 I Генерал коллапс не наступает. Наблюдалось давление эндоневральной жидкости в три раза больше нормы, что связано со значительным снижением кровотока в нерве. Эндоневральный отек затрудняет диффузию кислорода между капиллярами и аксонами, что приводит к феномену эндоневральной гипоксии. Гипоксия может затрагивать различные участки эндоневрального пространства и распространяться очень вариабельно. При галактозных невропатиях возникает эндоневральный отек с повышенным давлением эндоневральной жидкости, а напряжение окси-гена в субпериневральном пространстве и в центре нервных пучков значительно снижается. Эндоневральный отек не может вытекать из эндоневрального пространства, поэтому существует диффузионный барьер, и давление в эндоневральном пространстве остается высоким в течение длительного периода времени. Эндоневральный отек подвержен фиброзной трансформации из-за инвазии фибробластов, в результате чего образуется интраневральный рубец, который после формирования становится необратимым.  Рис. 5.9. Экспериментальное устройство для приложения внешнего давления к запястному каналу человека-добровольца. Катетер Вика был в... вводится в запястный канал для контроля местного тканевого давления. Ишемия против компрессии - клинические эксперименты Льюис [27] создал специальный инструмент для оказания давления в 60-70 мм рт. ст. на лучевой и срединный нервы человека. Он обнаружил, что этого давления достаточно для блокирования нервной проводимости, и пришел к выводу, что блок зависит от интраневральной окклюзии микрососудов. Различные другие эксперименты тео- ретически пришли к такому же выводу, исключив ме- ханические факторы. Эксперимент Лундборга [28] положил конец этой дилемме. Эксперимент заключался в контролируемом давлении на срединные нервы человека. В эксперименте использовался манометр (фитильный катетер) для регистрации постоянного давления внутри запястного канала вблизи срединного нерва (рис. 5.9, 5.10). Руки добровольных испытуемых подвергались внешней компрессии на уровне запястного канала (около ладони) с помощью специально изготовленного инструмента. Таким образом, можно было контролировать и отслеживать давление, оказываемое на кисть, даже внутри канала и вблизи срединного нерва. Одновременно с этим проводимость срединного и чувствительного нервов контролировалась с помощью батареи специальных тестов, которые регистрировали клинические симптомы и появление двигательного или чувствительного дефицита. Давление 30 мм рт. ст. вызывало появление первых нейрофизиологических изменений, связанных с сенсорными симптомами (парестезия). Полный сенсорный и моторный блок нервной проводимости (VCS и VCM) появлялся, но только после достижения эндоканального давления около 40-50 мм рт. ст. или выше. В этих случаях ВКС первым демонстрировал замедление амплитуды сенсорного потенциала через 25 - 50 мин после применения наружной компрессии. Вместо этого двигательные потенциалы следовали тем же путем, но с задержкой в 10 - 30 мин (табл. 5.13). Эти эксперименты показывают, что критический уровень давления для микрососудов, который вызывает их облитерацию с последующим ише-. Локализованное давление оказывалось на запястный канал путем поднятия нижней платформы в направлении фиксированной крыши компрессионного устройства (из [2]) 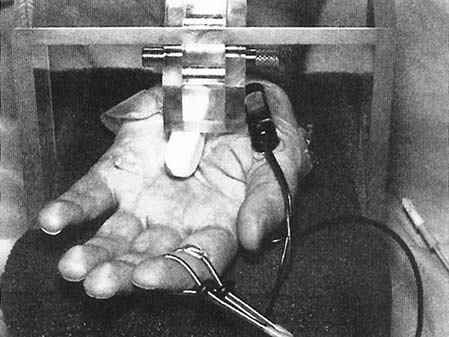 Рис. 5.10. Крупный план модели на рис. 5.9, показывающий поверхностные электроды для регистрации моторных и сенсорных волокон и форму, используемую для локального давления на канал запястья (из [2]) Таблица 5.13. Влияние давления на скорость проведения срединного нерва на запястье
[28] мия и полный блок нервной проводимости составляет около 40 - 50 мм рт. ст. Доказательства того, что именно ишемия, а не механическое воздействие компрессии само по себе определяет 38 I Генерал показали значительное снижение времени моторной скорости по сравнению с группой, которая не подвергалась однократной компрессии. Немото [36] также провел эксперимент, подтверждающий существование двойного уровня компрессии, используя металлические зажимы, которые вызывают хроническую компрессию при наложении с давлением около 30 мм рт. ст. на двух различных уровнях вдоль седалищных нервов собак. Через десять недель после приложения этих компрессионных сил к нерву Немото продемонстрировал, что проксимальная компрессия увеличила уязвимость дистальной части нерва и привела к последующей компрессии (рис. 5.11). Нейроапраксия Нейроапраксия относится к другому типу блокады нервной проводимости, при котором непрерывность аксонов сохраняется без дегенеративного начала, но проводимость через место компрессии восстанавливается только через несколько недель или месяцев. Этот термин был введен Седдоном [38, 39]. Считается, что этот тип повреждения соответствует острому явлению, с локальным повреждением миелина в узлах Рейнера, как это было описано Денни-Брауном и Бреннером [40] и Очоа [15]. Блок сохраняется до тех пор, пока повреждение миелина не заживет. Этот процесс обычно занимает от нескольких недель до нескольких месяцев. Как Седдон [38] первоначально заметил, что нейроапраксия |
