Полиядерные арены. полиядерные арены изм-1. Полициклические ароматические углеводороды
 Скачать 206.82 Kb. Скачать 206.82 Kb.
|
|
ПОЛИЦИКЛИЧЕСКИЕ АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ Схема лекции. 1. Полициклические ароматические углеводороды с изолированными циклами 1.1 Группа бифенила 1.2. Полифенилметаны 2. Конденсированные бензоидные углеводороды 2.1 Нафталин 2.2. Антрацен, фенантрен 1. Полициклические ароматические углеводороды с изолированными циклами Различают две группы полициклических ароматических углеводородов (аренов) с несколькими бензольными кольцами. 1. Углеводороды с изолированными кольцами. Сюда относятся бифенил и ди- и трифенилметаны. 2. Углеводороды с конденсированными кольцами или бензоидные углеводороды. Сюда относятся нафталин, антрацен и фенантрен. 1.1. Группа бифенила Определение: Соединения ароматического ряда, в которых два (или несколько) кольца (колец) соединены друг с другом простой связью – называются полициклическими ароматическими углеводородами с изолированными циклами. Самым простым соединением из ароматических углеводородов с изолированными циклами является бифенил. Положения заместителей в формуле бифенила обозначаются цифрами. В одном кольце цифры не маркируются: 1, 2 ….. Во втором кольце цифры маркируются штрихом 1, 2 и т.д. 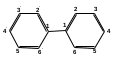 Схема 1. Структурная формула бифенила и порядок обозначения положения заместителей в молекуле бифенила. Бифенил - кристаллическое вещество с Тпл. 700С, Ткип. 2540С, имеет широкое применение благодаря термической и химической стойкости. Применяется в промышленности как высокотемпературный теплоноситель. В промышленности бифенил производят пиролизом бензола: 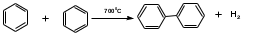 Схема 2. Схема синтеза бифенила пиролизом бензола. Лабораторным методом получения является действие натрия или меди на йодбензол 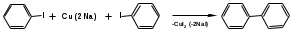 Схема 3. Схема синтеза бифенила из йодбензола. Реакция протекает особенно гладко при наличии в арилгалогенидах электроноакцепторных заместителей, повышающих подвижность галогена в ядре: 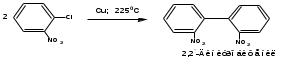 Схема 4. Схема синтеза бифенила по реакции Ульмана. Важнейшим производным бифенила является диамин бензидин. Обычно его получают восстановлением нитробензола до гидразобензола и изомеризацией последнего под влиянием кислот: 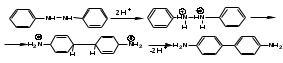 Схема 5. Схема синтеза бензидина. Бензидин является исходным веществом для получения многих субстантивных (прямых) красителей. Наличие двух аминогрупп, способных диазотироваться, позволяет получать бис-азокрасители, обладающие глубокой окраской. Примером красителя, получаемого из бензидина, является индикатор конго красный: 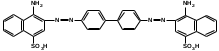 Схема 6. Индикатор конго красный. В кристаллическом состоянии оба бензольных кольца бифенила лежат в одной плоскости. В растворе и в газообразном состоянии угол между плоскостями колец составляет 450. Выход бензольных колец из плоскости объясняется пространственным взаимодействием атомов водорода в положения 2, 2 и 6, 6:  Схема 7. Схема стерических взаимодействий атомов водорода в орто- и орто-положениях. Если в орто-положениях находятся крупные заместители, то вращение относительно связи С-С становится затруднительным. Если заместители неодинаковые, то соответствующие производные могут быть разделены на оптические изомеры. Такая форма пространственной изомерии названа поворотной оптической изомерией или атропоизомерией. 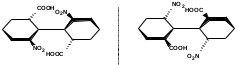 Схема 8. . Поворотные оптические изомеры. Бифенил значительно активнее по сравнению с бензолом участвует в реакциях электрофильного ароматического замещения. Бромирование бифенила эквимольным количеством брома приводит к образованию 4-бромбифенила. Избыток брома приводит к образованию 4,4`-дибромбифенила: 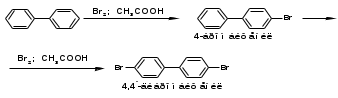 Схема 9. Схема реакции электрофильного замещения. Аналогично протекают реакции нитрования бифенила, ацилирование по Фриделю-Крафтсу и другие реакции электрофильного ароматического замещения. 1.2. Полифенилметаны Определение: Соединения ароматического ряда, в которых от двух до четырех бензольных колец соединены с одним атомом углерода, находящимся в состоянии sp3-гибридизации. Основоположником гомологического ряда полифенилметана является толуол, следующее соединение дифенилметан: 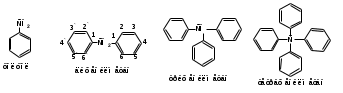 Схема 10. Полифенилметаны. Ди- и трифенилметан получают с использованием бензола по реакции Фриделя-Крафтса двумя методами: 1. Из хлористого метилена и хлороформа: 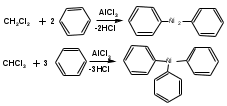 Схема 11. Схема синтеза ди- и трифенилметана хлористого метилена и хлороформа 2. Из хлористого бензила и хлористого бензилидена: 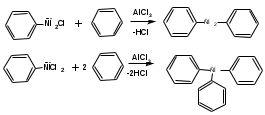 Схема 12.. Схема синтеза ди- и трифенилметана хлористого бензила и хлористого бензилидена. Дифенилметан – кристаллическое вещество с Тпл. 26-270С, обладает запахом апельсина. При окислении дифенилметана образуется бензофенон: 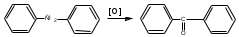 Схема 13. Схема окисления дифенилметана. Трифенилметан - кристаллическое вещество с Тпл. 92.50С. С бензолом дает кристаллическое молекулярное соединение Тпл. 780С. Трифенилметан легко окисляется до трифенилкарбинола. Водородный атом в его молекуле легко замещается металлами и галогенами. В свою очередь трифенилкарбинол при действии хлористого водорода трифенилхлорметан. Трифенилхлорметан при восстановлении образует трифенилметан, а при гидролизе – трифенилкарбинол: 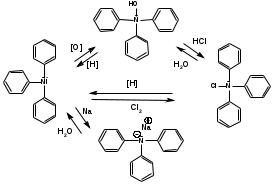 Схема 14.. Реакции с участием производных трифенилметана. Структура трифенилметана составляет основу так называемых красителей трифенилметанового ряда. Аминотрифенилметаны – бесцветные вещества, их называют лейкосоединениями (от греческого leukos – белый, бесцветный). При окислении в кислой среде образуют окрашенные соли. В этих солях носителем окраски (хромофором) является сопряженный ион с положительным зарядом, распределенным между атомами углерода и азота. Наиболее ярким представителем этой группы является малахитовый зеленый. Его получают по реакции Фриделя-Крафтса: 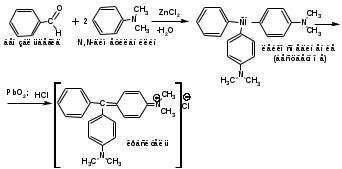 Схема 15. Схема синтеза красителя малахитовый зеленый. При окислении лейкосоединения образуется система сопряженных связей через бензольное кольцо между атомом азота и углеродом трифенилметановой системы, перешедшим в состояние sp2-гибридизации. Такая структура называется хиноидной. Наличие хиноидной структуры обеспечивает появление глубокой интенсивной окраски. К группе трифенилметановых красителей относится широко применяемый индикатор фенолфталеин. Получают по реакции фенола и фталевого ангидрида (ангидрид фталевой кислоты) в присутствии серной кислоты: 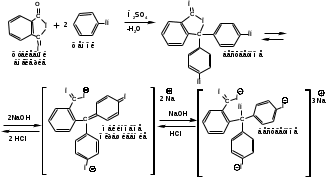 Схема 16. Схема синтеза индикатора фенолфталеин. 2. Конденсированные бензоидные углеводороды Углеводороды, содержащие два или более бензольных кольца, имеющих два общих атома углерода, называются конденсированными бензоидными углеводородами. 2.1. Нафталин Простейшим из конденсированных бензоидных углеводородов является нафталин: 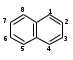 Схема 17. Структура молекулы нафталина и обозначение положений. Положения 1,4,5 и 8 обозначаются «α», положения 2, 3,6,7 обозначаются «β». Соответственно для нафталина возможно существование двух однозамещенных, которые носят название 1(α)- и 2(β)-производных, и десяти двухзамещенных изомеров, например: 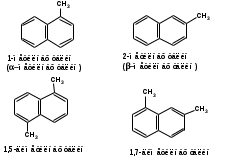 Схема 18. Производные нафталина. Способы получения. Основную массу нафталина получают из каменноугольной смолы. В лабораторных условиях нафталин можно получить пропуская пары бензола и ацетилена над древесным углем: 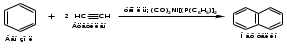 Схема 19. Схема синтеза нафталина из бензола и ацетилена. Дегидроциклизацией над платиной гомологов бензола с боковой цепью из четырех и более атомов углерода: 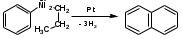 Схема 20. Схема синтеза нафталина дегидроциклизацией гомологов бензола. По реакции диенового синтеза 1,3-бутадиена с п-бензохиноном: 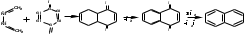 Схема 21. Схема синтеза нафталина по реакции диенового синтеза. Удобным лабораторным способом получения нафталина и его производных является метод, основанный на реакции Фриделя-Крафтса: 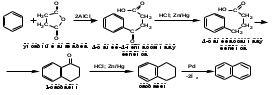 Схема 22. Схема синтеза нафталина по реакции Фриделя-Крафтса. Нафталин кристаллическое вещество с Тпл. 800С, отличающийся большой летучестью. Нафталин вступает в реакции электрофильного замещения легче, чем бензол. При этом первый заместитель почти всегда становиться в α-положение, так как в этом случае образуется энергетически более выгодный σ-комплекс, чем при замещении в β-положение. В первом случае σ-комплекс стабилизируется перераспределением электронной плотности без нарушения ароматичности второго кольца, во втором случае такая стабилизация не возможна: 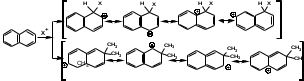 Схема 23. Схема образования σ-комплексов при замещении α- и β-положения. Ряд реакций электрофильного замещения в нафталине: 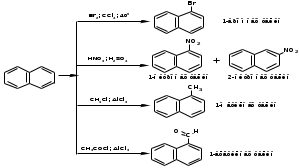 Схема 24. Реакции электрофильного замещения в нафталине. Вступление электрофильного агента в β-положение наблюдается реже. Как правило это происходит в специфических условиях. В частности, сульфирование нафталина при 600С протекает как кинетически контролируемый процесс, с преимущественным образованием 1-нафталинсульфокислоты. Сульфирование нафталина при 1600С протекает как термодинамически контролируемый процесс и приводит к образованию 2-нафталинсульфокислоты: 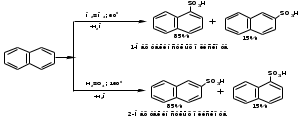 Схема 25. Реакции сульфонирования нафталина. Место вступления второго заместителя в нафталиновую систему определяется: 1. ориентационным влиянием уже имеющегося заместителя; 2. Различиями в реакционной способности α и β-положения. При этом выполняются следующие условия: 1. Если в одном из колец нафталина имеется заместитель I рода, то новый заместитель вступает в это же кольцо. Заместитель I рода в 1(α)-проложении направляет второй заместитель, преимущественно в 4(пара)-положение. Изомер со вторым заместителем во 2(орто)-положении образуется в незначительных количествах, например: 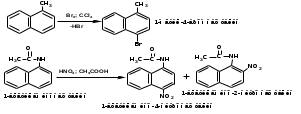 Схема 26. . Схема введения второго в молекулу нафталина, содержащую заместитель I рода в 1-положении. Электроноакцепторный заместители, находящиеся в молекуле нафталина, направляют атаку в другое кольцо в 5-е и 8-е положения: 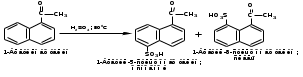 Схема 27. Схема введения второго в молекулу нафталина, содержащую заместитель II рода в 1-положении. 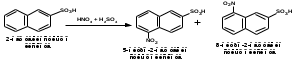 Схема 28. Схема введения второго в молекулу нафталина, содержащую заместитель II рода во 2-положении. Окисление нафталина кислородом воздуха с использованием пентаоксида ванадия в качестве катализатора приводит к образованию фталевого ангидрида: 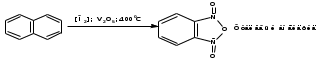 Схема 29. Схема окисления нафталина. Нафталин может быть восстановлен действием различных восстановителей с присоединением 1, 2 или 5-ти молей водорода: 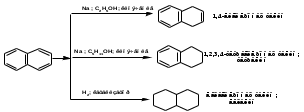 Схема 30. Схема восстановления нафталина. 2.2. Антрацен, фенантрен Наращиванием еще одного кольца из нафталина можно получить два изомерных углеводорода – антрацена и фенантрена: 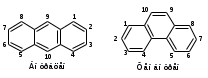 Схема 31.. Структурные формулы антрацена и фенантрена и порядок обозначения положения заместителей в молекуле бифенила. Положения 1, 4, 5 и 8 обозначаются «α», положения 2, 3, 6 и 7 обозначаются «β», положения 9 и 10 обозначаются «γ» или «мезо» - среднее положение. Способы получения. Основную массу антрацена получают из каменноугольной смолы. В лабораторных условиях антрацена получают по реакции Фриделя-Крафтса из бензола либо с тетрабромэтаном: 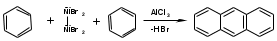 Схема 32. Схема синтеза нафталина по реакции Фриделя-Крафтса. либо по реакции с фталевым ангидридом: 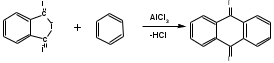 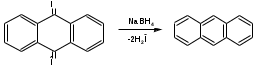 Схема 33. Схема синтеза антрацена по реакции диенового синтеза. В результате первой стадии реакции получают антрахинон, который легко восстанавливается до антрацена, например, боргидридом натрия. Также используется реакция Фиттига, по которой молекула антрацена получается из двух молекул орто-бромбензилбромида: 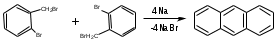 Схема 34. Схема синтеза антрацена по реакции Фиттига. Свойства: Антрацен – кристаллическое вещество с Тпл. 2130С. Все три бензольные кольца антрацена лежат в одной плоскости. Антрацен легко присоединяет в положения 9 и 10 водород, бром и малеиновый ангидрид: 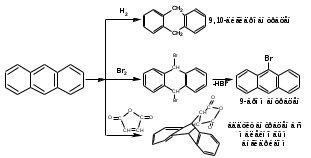 Схема 35. Реакции присоединения антрацена. Продукт присоединения брома легко теряет бромистый водород с образованием 9-бромантрацена. Под действием окислителей антрацен легко окисляется в антрахинон: 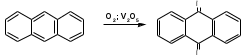 Схема 36. Реакция окисления антрацена. Фенантрен, также как и антрацен входит в состав каменноугольной смолы. Также как и антрацен фенантрен присоединяет водород и бром в 9 и 10-положения: 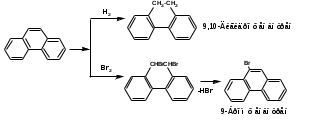 Схема 37. Реакции присоединения фенантрена. Под действием окислителей фенантрен легко окисляется в фенантренхинон, который далее окисляется до 2,2`-бифеновой кислоты: 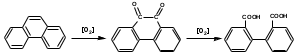 Схема 38. Реакции окисления фенантрена. |
