|
|
фазовые равновесия ФХ коллоквиум. Положительные и отрицательные отклонения от законов идеальных газов
Зависимость общего давления пара от состава раствора
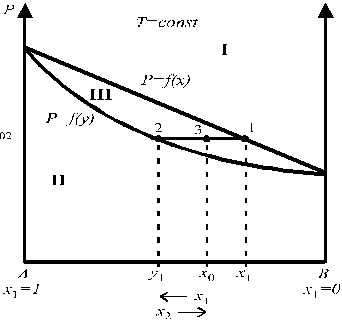
Любая точка на диаграмме состояния носит название фигуративной. Точки 1 и 2 характеризуют состав находящихся в равновесии жидкой и паровой фаз, соответственно. Точка 3 характеризует общий состав системы. В области I диаграммы существует только жидкий раствор, в области II — только пар, в области III жидкая и паровая фазы сосуществуют. Кривая p = f(x) называется линией жидкости и выражает зависимость давления пара над раствором от состава жидкого раствора. Кривая p = f(y) называется линией пара и выражает зависимость давления пара над раствором от состава пара.
Зависимость температуры кипения от состава раствора
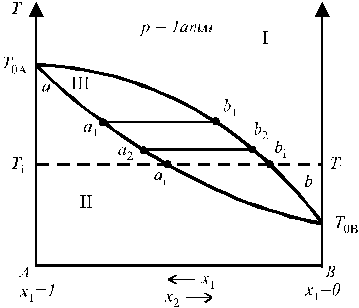 
В области I диаграммы существует только пар (газовый раствор), в области II — только жидкий раствор; область III является областью сосуществования пара и жидкого раствора. Кривая aa1a2…b называется кривой кипения;кривая ab1b2…b — кривой конденсации; T0A и T0B — температуры кипения чистых жидкостей А и В (более летучим компонентом является В, так как T0A > T0B).
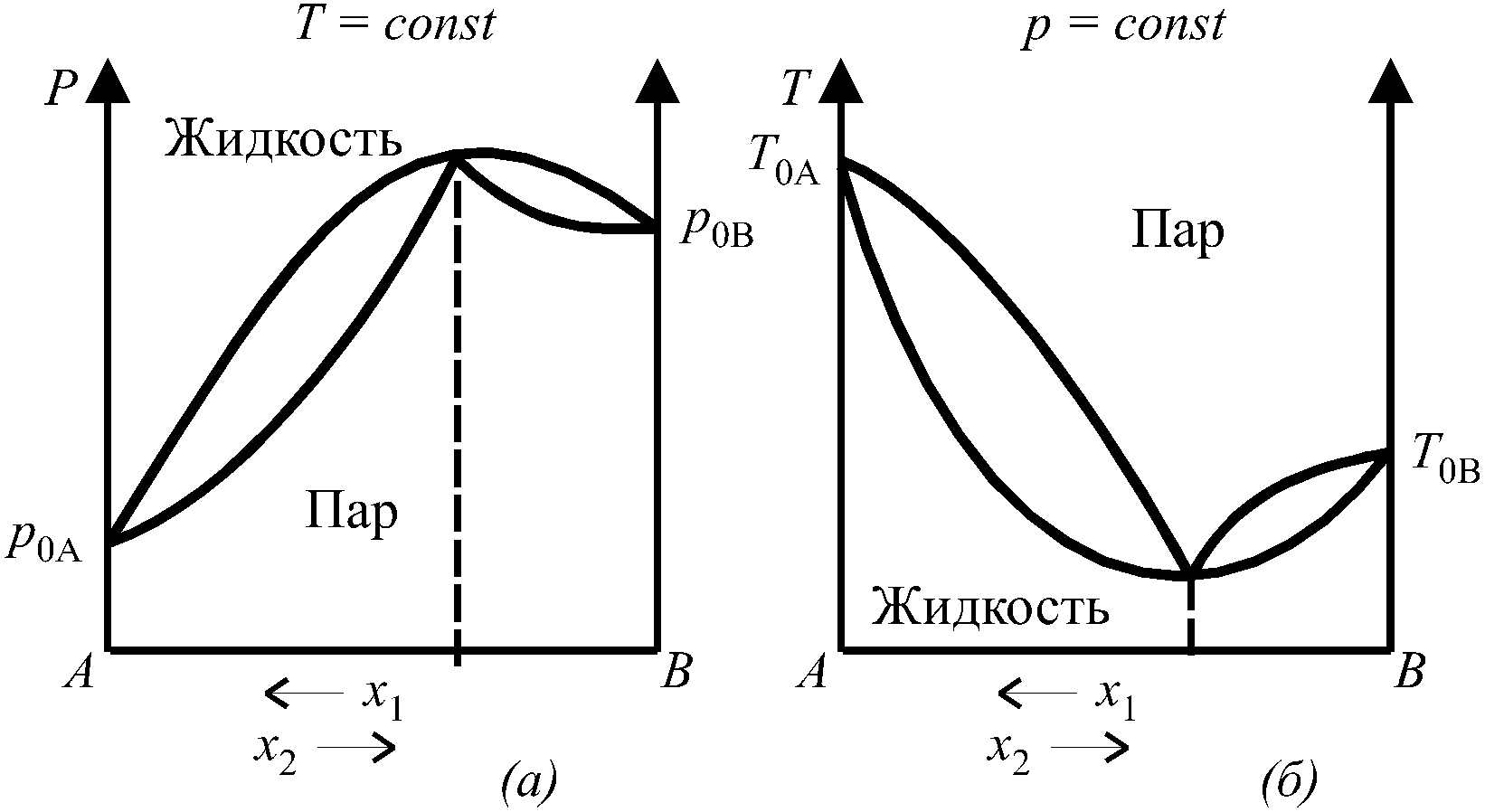
Для азеотропных смесей:
Диаграммы состояния бинарных систем с максимумом на кривой давления пара и минимумом на кривой температур кипения представлены.
ПРАВИЛО РЫЧАГА.
Отношение масс жидкой и твердой фазы, обратно пропорционально отношению отрезков, на которые делит данная фигуративная точка конноду (ноду)
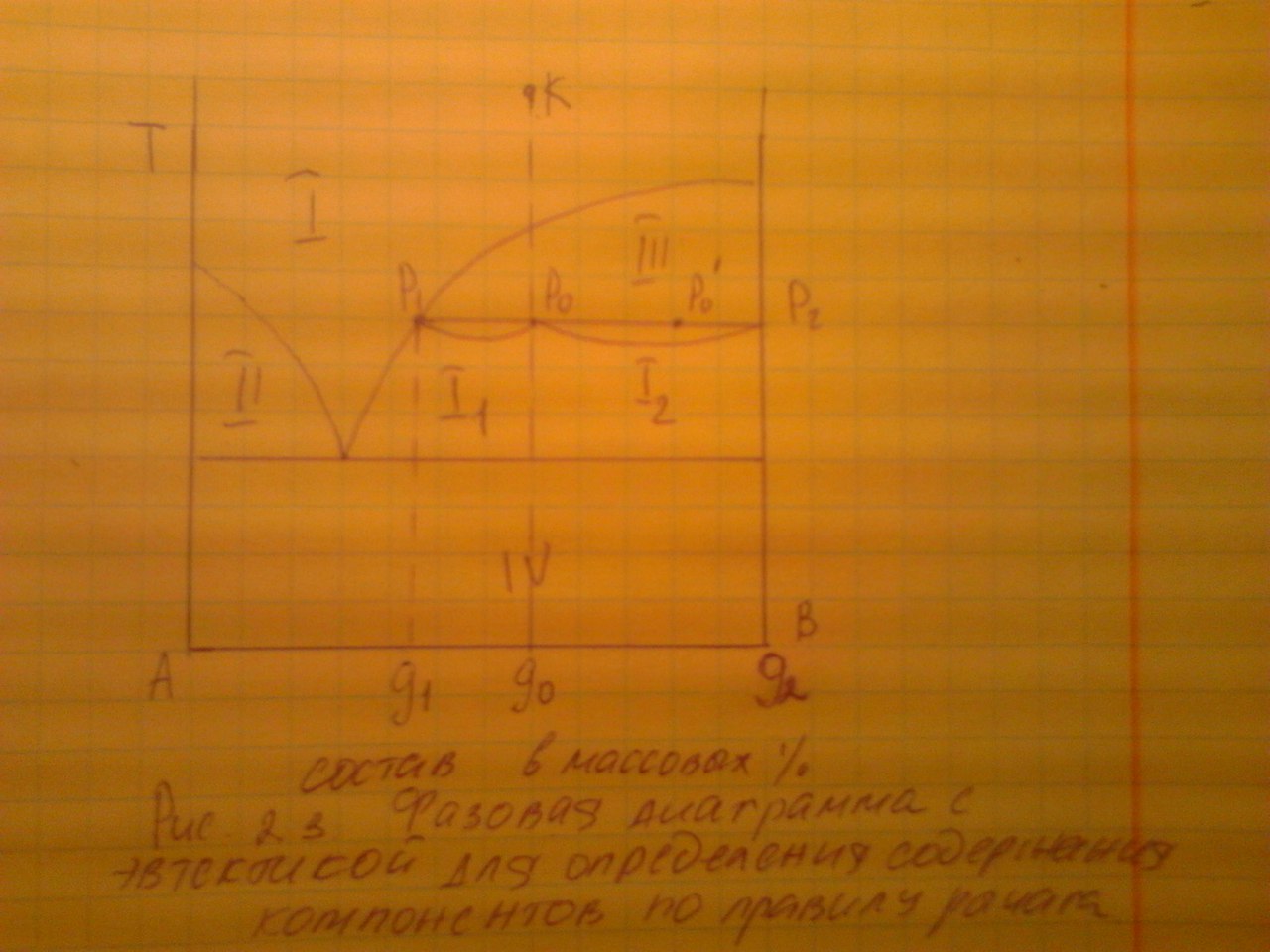
Точка К – ненасыщенный расплав состава g0.
Точка Р0, состава g0, отражает валовый (общий) состав.
Точки Р1 состава g1 и Р2 состава g2 отражают состав жидкой и твердой фаз соответственно (сопряженные точки).
Р0=Р1+Р2 (2.7)
Составим материальный баланс по компоненту В.
g0 - процентное содержание компонента В в системе;
g1 - процентное содержание компонента В в жидкой фазе;
g2 - процентное содержание компонента В в твердой фазе.
Материальный баланс компонента В можно описать уравнением:
РАЗДЕЛЕНИЕ РАСТВОРА НА КОМПОНЕНТЫ: ФРАКЦИОННАЯ ПЕРЕГОНКА.
Фракционная перегонка (дистилляция) – способ разделения смеси жидких веществ, основанный на различной температуре кипения компонентов смеси. При этом отогнанный дистиллят обогащается низкокипящим компонентом, а остаток – высоко кипящим. При этом виде перегонки используется дефлегматор, в котором при неполном охлаждении пара кипящей жидкости происходит частичная конденсация пара более высоко кипящей жидкости, обогащенный высоко кипящим компонентом промежуточный дистиллят (флегма) возвращается в колбу, а пар обогащается более низкокипящим веществом. При этом фракционная перегонка позволяет эффективно разделять смеси веществ с небольшой разницей в температурах кипения (10-20 °C).
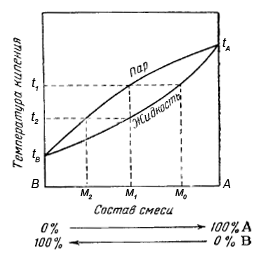
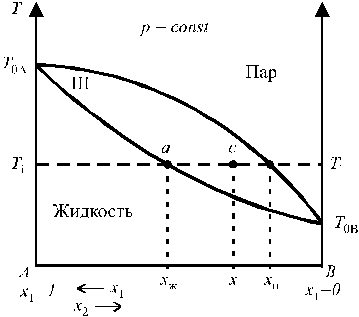
Из диаграммы фазового равновесия видно что, паровая фаза при любой температуре кипения содержит большее количество низкокипящего компонента, чем жидкая фаза; при этом каждой температуре кипения соответствуют строго определенные составы жидкости и пара. Таким образом, пар, образующийся из кипящей бинарной смеси, всегда содержит оба компонента, но обогащен более летучим из них (состав M1). При полной конденсации такого пара получается жидкость с тем же составом, что и пар. При вторичной перегонке этой жидкости образуется пар (состав M2), еще более обогащенный легкокипящим компонентом. Следовательно, в результате многократного повторения условий фазового равновесия (перегонки) для каждой первой фракции можно в конечном счете получить в первой фракции от последней перегонки низкокипящнй компонент смеси, не содержащий другого компонента. Соответственно, последняя фракция будет состоять из чистого высококипящего компонента первоначальной смеси. В этом по существу и заключается принцип разделения дробной перегонки.
ПЕРЕГОНКА С ВОДЯНЫМ ПАРОМ.
Перегонка с водяным паром является эффективным методом очистки органических соединений, не растворимых или трудно растворимых в воде. Она особенно пригодна в тех случаях, когда продукт реакции загрязнен большим количеством труднолетучих смолистых примесей.
Этот способ позволяет проводить перегонку веществ при температуре, значительно меньшей, чем их температура кипения.
В случае практически нерастворимых друг в друге жидкостей испарение каждой из них идет независимо от другой и давление паров каждого компонента при неизменной температуре остается постоянным при любых соотношениях масс взятых жидкостей.
Принимая систему за идеальную по закону Рауля можно найти давление пара каждой жидкости над смесью, а по закону Дальтона - общее давление паров над смесью
pA=pA*xA, pB=pB*xB, p = pA + pB
Так как для взаимно несмешивающихся жидкостей xA=1; xВ=1 (мольные доли веществ A, B в жидкости), то:
p = pA* + pB*
Из уравнения видно, что общее давление паров на системой из двух несмешивающихся жидкостей всегда больше чем давления паров чистых веществ.
Т.к. условием начала кипения является равенство давления паров над жидкостью внешнему давлению, то при нагревании общее давление пара над системой достигает значения внешного давления раньше, чем это возможно для паров чистых веществ. Поэтому такие жидкости всегда кипят при более низкой температуре, чем компоненты, образующие их, и температура кипения остается постоянной, пока полностью не отгонится один из компонентов.
В случае перегонки с водяным паром при нормальном давлении температура кипения смеси всегда будет меньше 100° С.
РАВНОВЕСИЕ ТВЁРДОЕ ВЕЩЕСТВО-ЖИДКОСТЬ В БИНАРНЫХ СИСТЕМАХ.
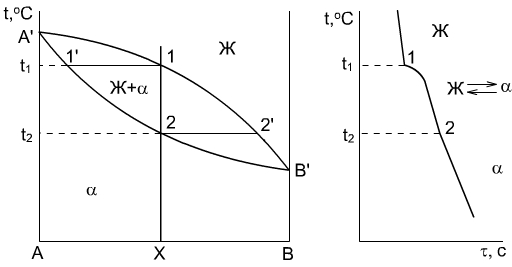
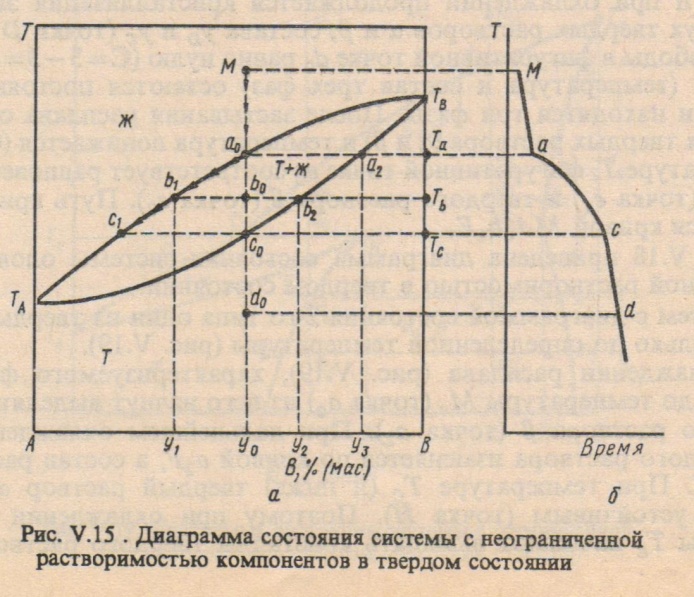
Если два компонента неограниченно растворяются в твердом и жидком состоянии, то возможно существование только двух фаз – жидкого раствора (расплава) и твердого раствора. Диаграмма состояния с неограниченной растворимостью компонентов А и В в жидком и твердом состоянии представлена на рисунке.
ФИЗИКО-ХИМИЧЕСКИЙ АНАЛИЗ.
Изучение многокомпонентных систем, образующих несколько фаз, производится при помощи физико-химического анализа, в основе которого лежит изучение функциональной зависимости между физическими свойствами системы и факторами, определяющими её равновесие. В качестве изучаемых свойств могут быть выбраны: тепловые, электрические, механические и др. Найденные из опыта зависимости изображаютмя в виде лиаграмм состав-свойство.
Частным случаем физико-химического анализа является термический анализ, заключающийся в определении температуры, при которой в равновесной системе изменяется число фаз. Анализ основан на изучении изменения температуры системы в зависимости от времени охлаждения. В результате получаются так называемые кривые охдаждения, вид которых зависит от состава и типа смеси.
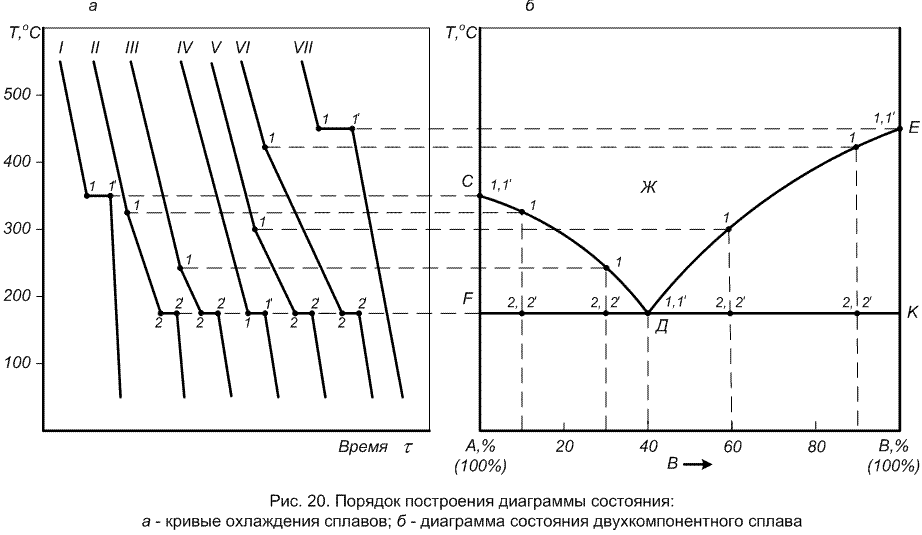
Диаграммы плавкости с эвтектикой.
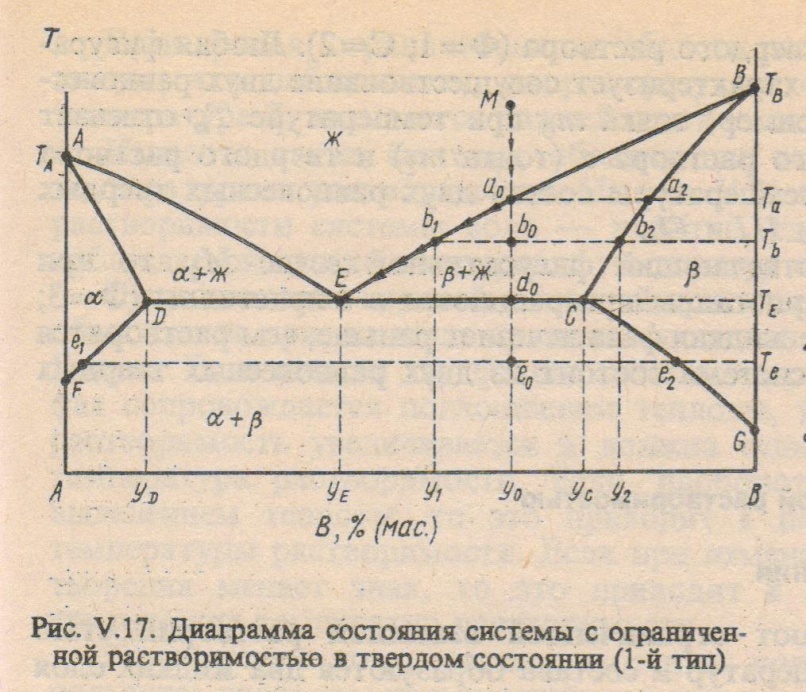
Одним из основных типов диаграмм состояния двухкомпонентных конденсированных систем является диаграмма состояния с эвтектикой, приведённая на рис 8. Такую диаграмму состояния дают компоненты А и В, которые в твёрдом виде не образуют между собой химическое соединение или твёрдый раствор.
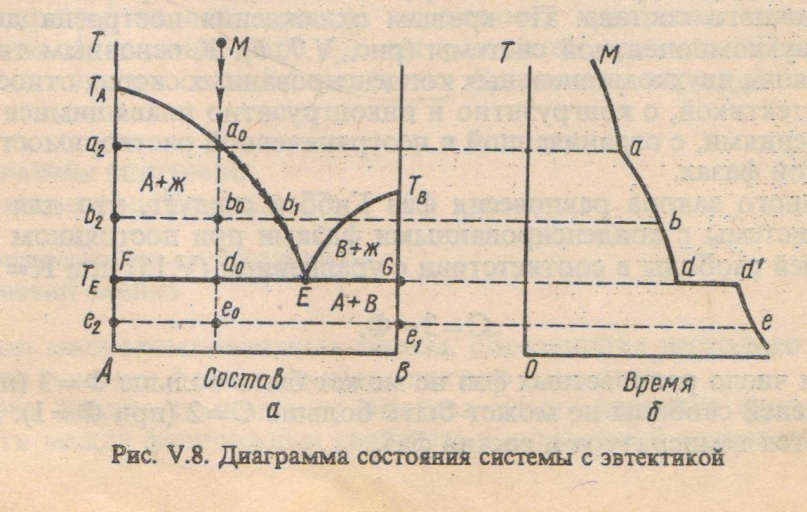
Точка Е пересечения кривых ТАЕ и ТВЕ показывает температуру и состав расплава , который одновременно находится в равновесии с кристаллами вещества А и вещества В. Точка Е называется эвтектической точкой. Расплав, соответствующий точке Е, называется эвтектическим расплавом, а температура ТЕ-эвтектической температурой. Твердая эвтектика состит из двух тв.фаз(кристаллов А и В).
Линии ликвидуса – ТАЕ и ЕТВ, линии солидуса – FG
Точка Мимеет двувариантную смесь С=2-1+1=2, т.е. можно менять произвольно Т и состав расплава, не меняя числа фаз
Точка а0(выпадение первых кристаллов): С=2-2+1=1, т.е. имеем одновариантную систему, можно менять произвольно только температуру, а состав расплава при каждной температуре определяется ТАЕ.
Точка b0 (расплав обогащается компонентом В) двуфазная, одновариантная. Для определения состава расплава проводим конноду через точку b0 горизонтальную линию b2b1. т.b2-состав тв.фазы(кристалла А),т.b1-состав расплава.
Точка d0(три фазы-одна ж, и 2-тв.). С=2-3+1=0, т.е. ни Т, ни состав нельзя менять.
Точка е0 (охлаждение двух тв.фаз). С=2-2+1=1
Диаграммы плавкости с химическими соединениями
Химическое соединение устойчиво, если его можно нагреть без разложения до плавления – конгруэнтно плавящееся химическое соединение, и неустойчиво, если при нагревании оно разлагается - инконгруэнтно плавящееся химическое соединение. В зависимости от этого различают два типа диаграмм.
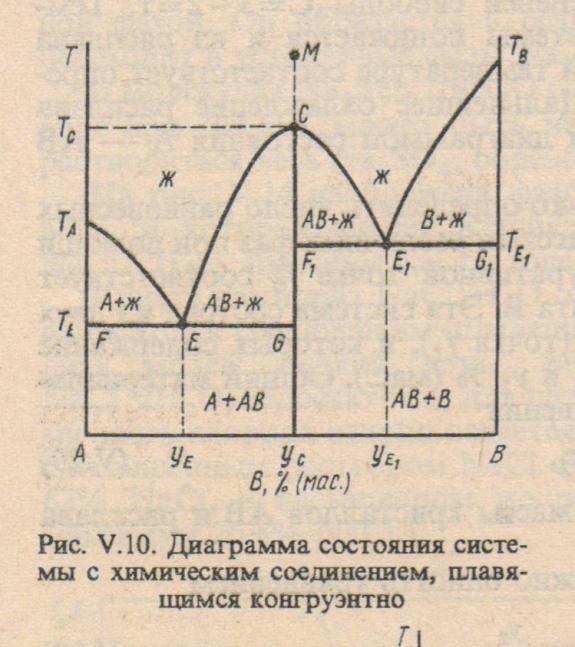
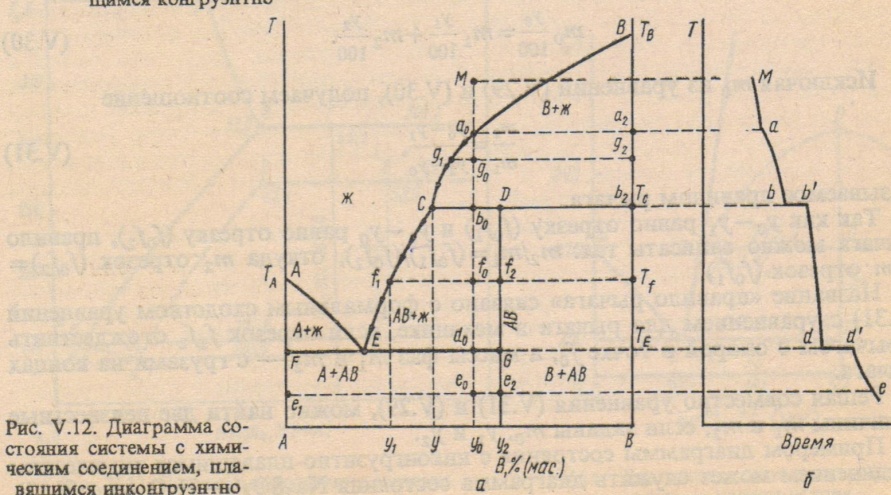
Точка С-перетектика. Точка Е-эвтектика
В эвтектической точке одновременно выпадают две твердые фазы, а в перетектической - одна тв фаза выпадает, а другая растворяется.
Точка ао : С=2-2+1=1
Точка b0: С=2-3+1=0 (три фазы: расплав, кристаллы АВ и В)
Точка f0: C=2-2+1=1
Точка d0: С=2-3+1=0
Точка e0: С=2-2+1=1
Диаграммы плавкости с твердыми растворами
Твердые растворы – гомогенные системы переменного состава, состоящие из двух или более компонентов.
Фазовая диаграмма с неограниченной растворимостью компонентов в твердом состоянии:
Если два компонента неограниченно растворяются в твердом и жидком состоянии, то возможно существование только двух фаз – жидкого раствора (расплава) и твердого раствора
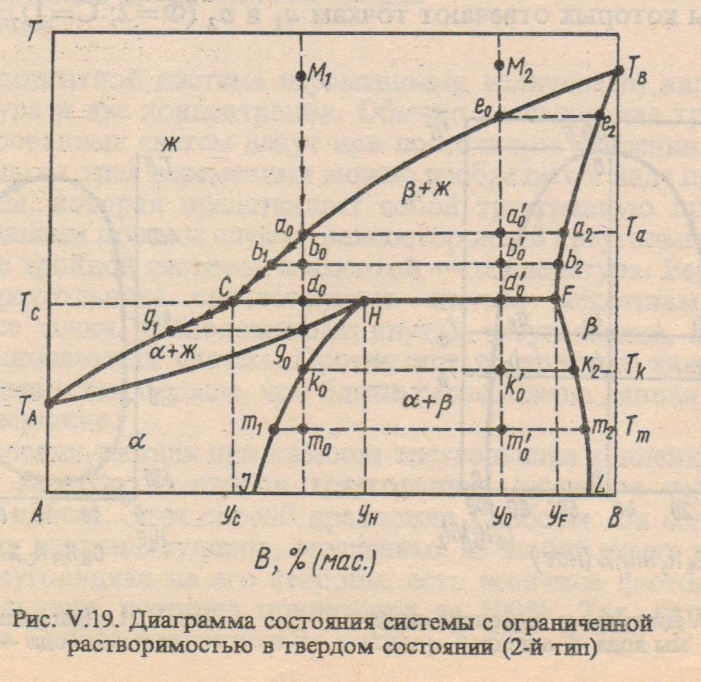
Фазовые диаграммы с ограниченной растворимостью компонентов в твердом состоянии.
Оба компонента неограниченно растворимы в жидком состоянии, ограниченно растворимы в твердом и не образуют химических соединений.
Различают два типа диаграмм:
1. Диаграмма с эвтектикой (I типа) – твердые растворы образуют эвтектическую смесь.
2. Диаграмма с перитектикой (II типа) – твердые растворы образуют перитектическую смесь (один из твердых растворов устойчив только до определенной температуры)
Равновесие жидкость-жидкость
Многие жидкости обладают ограниченной взаимной растворимостью и в некотором интервале температур и состава образуются два жидких слоя (две фазы).
При смешивании двух жидкостей возможны 3 случая взаимной растворимости:
Жидкости неограниченно растворимы друг в друге-смешиваются в любых соотношениях (жидкость-пар)
Жидкости раств-ся др в др до определенного предела ( смешиваются частично: вода-эфир)
Жидкости не растворимы др в др.
Рассмотрим систему неограниченно растворимые др в др жидкости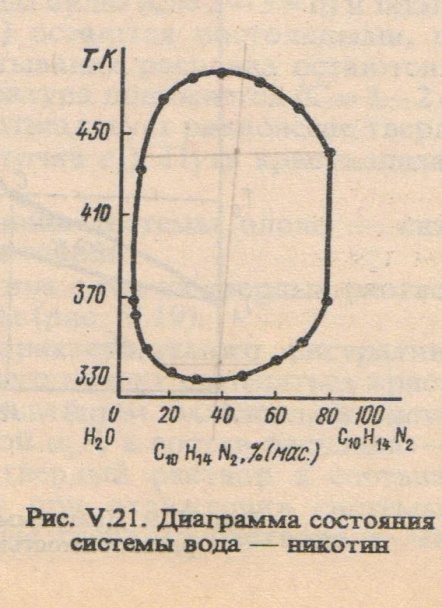
Рассмотрим систему, состоящую из двух огрнаич.растворимы др в др жидкостей
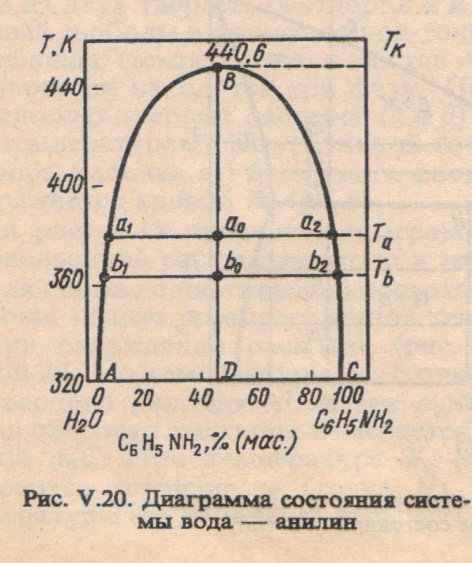
АВ-показывает зависимость состава водного слоя от температуры, ВС-зависимость состава анилинового слоя от Т. С ростом Т увел-ся взаимная расворимость анилина в воде и воды в анилине. Когда оба слоя становятся одинаковыми по составу, кривые сливаются в точке В(верхняя критическая Т растворения). За пределами криво АВС находится область однофазных систем, внутри кривой АВС – область расслаивания
Ограниченная растворимость двух жидкостей.
В зависимости от своей природы жидкости в разных соотношениях смешиваются друг с другом — от практической нерастворимости в любых условиях до неограниченной взаимной растворимости. Рассмотрим случай ограниченной взаимной растворимости на примере двойной системы анилин—вода. Если при постоянной температуре путем длительного и энергичного встряхивания перемешать произвольные, но достаточно большие количества анилина и воды, получится неустойчивая эмульсия. С течением времени она расслаивается на два сопряженных раствора верхний — насыщенный раствор анилина в воде и нижний — насыщенный раствор воды в анилине. При постоянной температуре оба раствора имеют строго определенный равновесный состав, который (в известных пределах концентраций) не изменяется при добавлении новых порций анилина и воды, изменяются лишь относительные количества растворов.
Закон распределения
Если какое-либо вещество растворимо в двух несмешивающихся жидкостях, то при его растворении в смеси двух таких жидкостей оно само распределяется между ними. Отношение, в котором происходит это распределение, определяется законом распределения. Он утверждает, что растворимое вещество распределяется между двумя несмешивающимися жидкостями в постоянном отношении концентраций, не зависящем от количества добавляемого растворимого вещества.
Закон распределения основан на экспериментальных наблюдениях. Рассмотрим, например, распределение иода между двумя несмешивающимися растворителями - водой и тетрахлорометаном. Если встряхивать иод с этими двумя растворителями, часть его растворится в воде, а часть в тетрахлорометане . В конце концов в системе устанавливается динамическое равновесие. При этом скорость, с которой иод переходит из в воду, уравнивается со скоростью, с которой иод переходит из воды в

Независимо от того, какое количество иода используется в этом эксперименте, окончательное отношение концентраций оказывается постоянным. Полученная постоянная называется коэффициентом распределения К.

При значение постоянной К для рассматриваемого равновесия равно 85. Это означает, что концентрация иода в в 85 раз больше, чем в воде. Столь большое различие объясняется тем, что иод является неполярным растворяемым веществом. Поэтому он гораздо лучше растворим в неполярных растворителях, подобных , чем в полярных, подобных воде.
Закон распределения выполняется лишь при определенных условиях, а именно: 1) при постоянной температуре; 2) при достаточном разбавлении обоих растворов; 3) при условии, что растворенное вещество не реагирует, не ассоциирует и не диссоциирует в обоих растворителях.
Экстракция - процесс разделения смеси жидких или твёрдых веществ с помощью избирательных (селективных) растворителей (экстрагентов).
Процесс Э. включает 3 последовательные стадии: смешение исходной смеси веществ с экстрагентом; механическое разделение (расслаивание) двух образующихся фаз; удаление экстрагента из обеих фаз и его регенерацию с целью повторного использования. После механического разделения получают раствор извлекаемого вещества в экстрагенте (экстракт) и остаток исходного раствора (рафинат) или твёрдого вещества. Выделение экстрагированного вещества из экстракта и одновременно регенерация экстрагента производится дистилляцией (См. Дистилляция), Выпариванием, кристаллизацией (См. Кристаллизация), Высаливанием и т. п.
Достоинствами Э. являются низкие рабочие температуры, рентабельность извлечения веществ из разбавленных растворов, возможность разделения смесей, состоящих из близкокипящих компонентов, и азеотропных смесей, возможность сочетания с другими технологическими процессами (ректификацией, кристаллизацией), простота аппаратуры и доступность её автоматизации. Недостатком Э. в ряде случаев является трудность полного удаления экстрагента из экстрагируемых веществ.
Э. подчиняется законам диффузии (См. Диффузия) и равновесного распределения. При Э. из жидкостей после смешения исходного раствора с экстрагентом и расслоения образовавшейся смеси концентрация у экстрагируемого вещества (В) в фазе экстракта больше его концентрации х в фазе рафината. |
|
|
 Скачать 1.83 Mb.
Скачать 1.83 Mb.