Дисциплина «Биохимия»,
для студентов специальности 31.05.01 Лечебное дело
ПРАКТИКУМ ПО РЕШЕНИЮ ЗАДАЧ ПО ТЕМЕ:
«Обмен липидов»
Переваривание и всасывание белков
Задание
|
Указания к выполнению задания
|
Вспомните биологическую роль белков.
|
1. Напишите, какие функции выполняют белки в организме:
а), б), в) и.т.д.
Краткий ответ
Белки являются основными функциональными молекулами всех видов живых организмов. Почти любая работа в клетке — химическая, сократительная, рецепторная, транспортная, иммунная и многие другие выполняются белками.
Развернутый ответ
• Структурная (пластическая). В комплексе с липидами белки составляют структуру всех клеточных мембран и основу цитоплазмы клеток. Структурной основой соединительной ткани являются такие белки, как коллаген (входит в состав хрящей и сухожилий), кератин (входит в состав кожи), эластин (входит в состав связок и стенок сосудов).
• Каталитическая. Эту функцию выполняют специфические белки-ферменты, регулирующие обмен веществ и энергии в организме. Если ферменты не работают в клетке, то биохимические реакции не протекают и живая клетка может погибнуть.
• Сократительная. Все виды сокращения и движения скелетных мышц, миокарда и других сокращающихся тканей обеспечивают сократительные белки актин и миозин.
• Транспортная. Белки способны связывать и транспортировать с током крови или через клеточные мембраны отдельные молекулы и ионы. Например, гемоглобин эритроцитов крови переносит кислород от легких к тканям и углекислый газ — от тканей к легким; миоглобин мышц переносит кислород в мышечной ткани к местам его использования. Отдельные белки крови транспортируют жирные кислоты, липиды, железо, некоторые гормоны.
• Защитная. Белки иммунной системы гаммаглобулины "узнают" и связывают чужеродные вещества, поступающие в организм, защищая тем самым его от вирусов, бактерий и клеток других организмов. Защитную функцию выполняет также белок интерферон. Белки плазмы крови фибриноген и тромбин участвуют в процессах свертывания крови, предотвращая кровопотери при ранениях.
• Гормональная, или регуляторная. Высокоспецифические белки-гормоны регулируют обмен веществ.
• Рецепторная. Многие белки являются рецепторами гормонов, нейромедиаторов, других биологически активных веществ. Они осуществляют избирательное узнавание, связывание и передачу их регуляторного действия.
• Передача наследственной информации. Белки входят в состав хромосом и участвуют в воспроизведении генетической информации, в регуляции процессов роста и размножения.
• Опорная. Упругость и прочность костей скелета, кожи, сухожилий обеспечивают преимущественно белки коллаген и эластин.
• Энергетическая. Около 10—15 % энергопотребления организма обеспечивается белками. При окислении 1 г белков выделяется 17 кДж (4,1 ккал) энергии.
|
Изучите роль пищевых белков.
|
1. Выпишите, какие факторы должны учитываться при обосновании норм потребления белка. Напишите формулу незаменимых аминокислот.
Значение пищевых белков для организма определяется главным образом двумя факторами: 1) близостью аминокислотного состава пищевого белка к аминокислотному составу белков тела; 2) содержанием в белках незаменимых аминокислот, которые животные и человек, в отличие от растений и микроорганизмов, не могут синтезировать. Из 20 аминокислот, входящих в состав белков, только 10 способны синтезироваться в организме — это заменимые аминокислоты, остальные 10 аминокислот являются незаменимыми, т. е. они должны поступать в организм с пищей. Аргинин и гистидин относятся к полунезаменимым, т. е. они могут синтезироваться в организме, но в количестве, недостаточном для сохранения нормальной жизнедеятельности человека. Последствия недостаточности какой-либо незаменимой аминокислоты приводят к остановке роста и развитию клинической картины, напоминающей авитаминоз.

Формулы незаменимых аминокислот
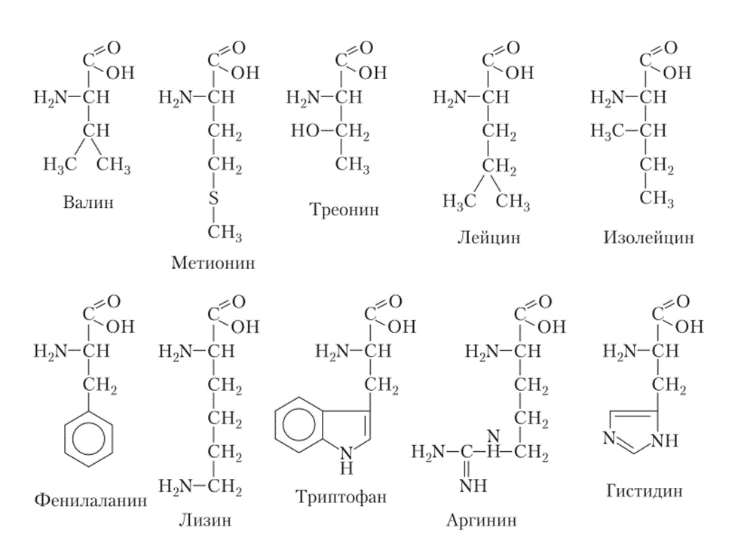
2. Дайте определение понятию «полноценные белки».
Белки пищи, содержащие все незаменимые аминокислоты, называются полноценными. Такие белки содержатся в основном в продуктах животного происхождения и являются неотъемлемым компонентом рационального питания человека.
|
Дайте общую характеристику процессов переваривания белков в ЖКТ
|
1. Законспектируйте состав желудочного, панкреатического и кишечного соков.
В состав желудочного сока входят соляная (хлористоводородная) кислота (HCl), протеазы, липаза, гастромукопротеин и муцин, хлористые соли калия, натрия, аммония, фосфаты, сульфаты и органические соединения (молочная кислота, мочевина, креатинин, глюкоза и др.).

Панкреатический сок содержит большое число пищеварительных протеолитических ферментов (в виде проферментов): трипсин, химотрипсин, эластазу, карбоксипептидазу, липолитичесих ферментов и коферментов: липазу, фосфолипазу, карбоксилэстергидролазу, колипазу, а также α-амилазу и нуклеазы (рибонуклеазу и дезоксирибонуклеазу).

Состав кишечного сока: ферменты: амилаза, мальтаза, сахараза, лактаза, липаза (но она менее активна, чем панкреатическая липаза), аминопептидаза, дипептидаза; слизь; карбонаты натрия и калия, определяющие рH.
2. Запишите сведения о субстратной специфичности протеиназ, оптимуме рН их действия.
Белки, поступившие в организм с пищей, в желудочно-кишечном тракте (ЖКТ) расщепляются до аминокислот при действии группы протеолитических ферментов —протеиназ.
Ферменты, расщепляющие белки, обладают относительной субстратной специфичностью, которая определяется:
• длиной полипептидной цепи;
• структурой радикалов аминокислотных остатков, образующих гидролизуемую пептидную связь;
• положением связи в полипептиде.
Субстратная специфичность этих ферментов заключается в том, что каждый из них с наибольшей скоростью расщепляет пептидные связи, образованные определёнными аминокислотами. Протеазы, гидролизующие пептидные связи внутри белковой молекулы, относят к группе эндопептидаз. Ферменты, относящиеся к группе экзопептидаз, гидролизуют пептидную связь, образованную концевыми аминокислотами. Под действием всех протеаз ЖКТ белки пищи распадаются на отдельные аминокислоты, которые затем поступают в клетки тканей.
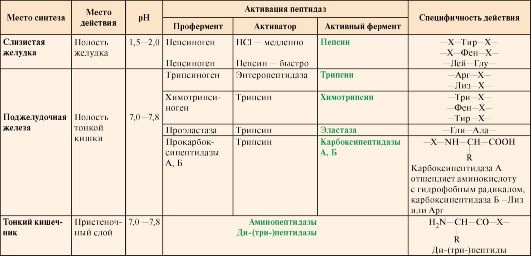
Желудочные и панкреатические пептидазы вырабатываются в неактивной форме (проферменты), секретируются к месту действия, где активируются путем частичного протеолиза (отщепление пептида различной длины, чаще с N-конца молекулы профермента). Место синтеза проферментов (клетки слизистой оболочки желудка, поджелудочная железа) и место их активации (полость желудка, тонкого кишечника)пространственно разделены. Такой механизм образования активных ферментов необходим для защиты секреторных клеток желудка и поджелудочной железы от самопереваривания.
|
Изучите процессы переваривания белков в желудке
|
1. Назовите условия, необходимые для переваривания белков в желудке
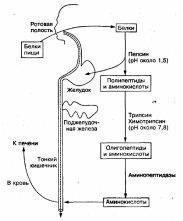
Белки пищи в ротовой полости не расщепляются, так как слюна не содержит гидролитических ферментов. Химическое расщепление белков начинается в желудке под воздействием протеолитических ферментов (пептидгидролаз), которые расщепляют пептидные связи между аминокислотами:
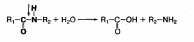
Эти ферменты образуются клетками слизистой оболочки желудка, тонкого кишечника и поджелудочной железы в неактивной форме. Такая форма ферментов предотвращает самопереваривание белков в клетках, где они синтезируются, и стенок желудочно-кишечного тракта. В желудке переваривание белков происходит при участии фермента желудочного сока пепсина, который образуется из неактивного пепсиногена под воздействием соляной кислоты. Пепсин проявляет максимальную ферментативную активность в сильно кислой среде при рН 1—2. Кроме того, под воздействием соляной кислоты происходит набухание и частичная денатурация белков, что приводит к увеличению поверхности соприкосновения фермента с белками. Все это облегчает процесс расщепления белков в желудке. Пепсин расщепляет пептидные связи белковых молекул, в результате чего образуются высокомолекулярные пептиды и простетические группы. В двенадцатиперстной кишке образовавшиеся пептиды подвергаются дальнейшему расщеплению при участии ферментов сока поджелудочной железы и кишечного сока трипсина и химотрипсина. Поджелудочная железа вырабатывает неактивный фермент трипсиноген, который под действием фермента слизистой оболочки тонкого кишечника — энтерокиназы превращается в активный трипсин. Трипсин воздействует на другой неактивныи фермент поджелудочного сока — химотрипсиноген, превращая его в активный химотрипсин.
Трипсин и химотрипсин проявляют максимальную активность в слабощелочной среде при рН 7,8. Они расщепляют белки (пептиды и полипептиды) на более простые соединения — низкомолекулярные пептиды (олигопептиды) и некоторое количество свободных аминокислот.
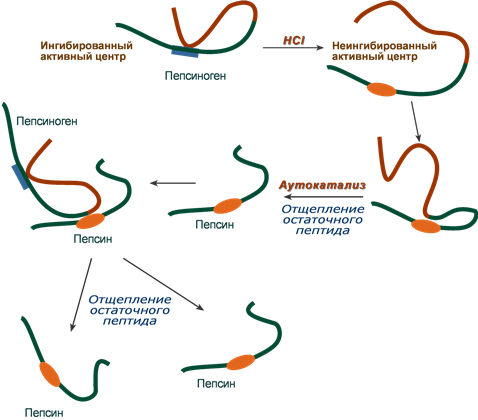
2. Представьте схему превращения пепсиногена в пепсин.
Большинство нативных пищевых белков имеют структуру компактной глобулы и поэтому значительная часть пептидных связей недоступна для гидролитических ферментов. Отсюда возникает необходимость в предварительной денатурации белка, которая происходит в желудке, содержимое которого имеет pH 2 благодаря секреции обкладочными клетками слизистой HCl. В кислой среде нарушаются многие слабые связи, стабилизирующие белковую глобулу, она разворачивается, делая доступными связи для протеолиза. Кроме того, соляная кислота выполняет и другие функции:
• создает барьер, препятствующий попаданию патогенных бактерий в кишечник;
• участвует в активации пепсиногена.
Пепсиноген в присутствии HCl приобретает частичную протеолитическую активность вследствие протонирования некоторых групп и изменения конформации. Активированный таким образом пепсиноген катализирует отщепление от другой молекулы пепсиногена N-концевой части, содержащий 42 аминокислоты, переводя фермент в активную форму. Образованный пепсин катализирует превращение других молекул пепсиногена. Таким образом, продукт реакции —пепсин ускоряет свое собственное образование. Подобный тип активации называется аутоактивацией. При многих заболеваниях желудочно-кишечного тракта нарушается секреция HCl и пепсиногена. Изменение концентрации HCl и пепсина в желудочном соке используется для диагностики некоторых заболеваний желудка.
3. Начертите в тетради и заполните таблицу:
|
пепсиноген
|
пепсин
|
гастриксин
|
Активатор - HCl, пепсин, аутоактивация
|
В течение суток синтезируется около 2 г пепсина.
|
Пепсиноподобный фермент, до 20-50% количества пепсина.
|
Расщепляется с образованием пепсина и петидного фрагмента
|
Пепсин расщепляет примерно 10% всех пептидных связей белков, попадающих в желудок
|
Прогастриксин (профермент), активируется НСI Оптимум рН 3,2-3,5
|
Молекулярная масса пепсиногена 40,4 kDa
|
позволяет организму пепсином переваривать белки мясной пищи, стимулирующей секрецию HCl
|
Молочно-растительная пища
|
Место синтеза - главные клетки желудка
|
Частично гидролизует белки, расщепляя пептидные связи, образованные ароматиескими АК Phe, Tyr, Trp
|
Является эндопептидазой, гидролизует связи, образованные карбоксильными группами дикарбоновых аминокислот
|
Место и механизм активации - Полость желудка. Отщепление N-концевой части (42 остатка аминокислот)
|
Молекулярная масса пепсина — 32,7 kDa.
|
позволяет организму гастриксином переваривать белки растительно-молочной пищи
|
|
|
|
Изучите переваривание белков в кишечнике и всасывание продуктов гидролиза
|
1. Приведите условия, обеспечивающие переваривание белков в тонком кишечнике
Окончательное расщепление низкомолекулярных пептидов до аминокислот происходит в тонком кишечнике под действием высокоспецифических ферментов аминопептидаз, карбоксипептидаз и дипептидаз. Превращение белков, как и углеводов, происходит не только в полости кишки, но и на поверхности клеток слизистой оболочки (контактное или пристеночное пищеварение). В полости кишки расщепляются преимущественно белковые молекулы, а на поверхности клеток (между микроворсинками) — относительно небольшие пептиды. Образовавшиеся свободные аминокислоты и некоторые простые пептиды при помощи сложных биохимических процессов всасываются в кровь и доставляются в печень и другие ткани.
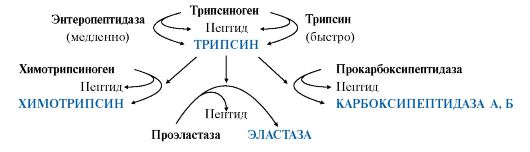
2. Перечислите протеолитические ферменты кишечника и опишите их роль в переваривании белков и пептидов.
Все пептидазы, в зависимости от места расположения в пептиде гидролизуемой связи, делятся на эндопептидазы и экзопептидазы:
•эндопептидазы - расщепляют пептидные связи, удаленные от концов пептидной цепи (пепсин, трипсин, химотрипсин, эластаза);
•экзопептидазы - гидролизуют пептидные связи, образованные N- и С-концевыми аминокислотами (аминопептидаза, карбоксипептидазы А и В), а также расщепляют ди- и трипептиды.
3. Начертите в тетради и заполните таблицу:
|
трипсин
|
химотрипсин
|
эластаза
|
карбоксипептидазы А и В
|
Трипсин гидролизует преимущественно пептидные связи, образованные карбоксильными группами катионогенных аминокислот:
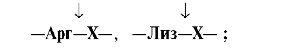
|
Химотрипсин - пептидные связи, образованные карбоксильными группами ароматических аминокислот:
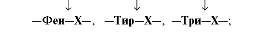
|
Эластаза - связь между -Гли-Ала-
|
Карбоксипептидазы отщепляют С-концевые аминокислоты: карбоксипептидаза А - гидрофобные аминокислоты, карбоксипептидаза В - Лиз и Арг;
|
Форма секреции – профермент, активируется энтерокиназой
|
Форма секреции – профермент, активируется трипсином
|
Форма секреции – профермент, активируется трипсином
|
Форма секреции – профермент, активируется трипсином
|
Действие – расщепляет протеины и полипептиды
|
Действие – расщепляет внутренние связи белка
|
Действие – перваривает эластин, протеин соединительной ткани
|
Действие – расщепляет с карбоксильного конца наружные связи белка, включая ароматические (А) и основные (В) аминокислоты
|
гидролазы
|
гидролазы
|
гидролазы
|
гидролазы
|
Входит в состав панкреатического сока
|
Входит в состав панкреатического сока
|
Входит в состав панкреатического сока
|
Входит в состав панкреатического сока
|
эндопептидазы
|
эндопептидазы
|
эндопептидазы
|
экзопептидазы
|
Протеолитический фермент ЖКТ
|
Протеолитический фермент ЖКТ
|
Протеолитический фермент ЖКТ
|
Протеолитический фермент ЖКТ
|
Изучите механизмы регуляции секреции пищеварительных соков и протеолитических ферментов
|
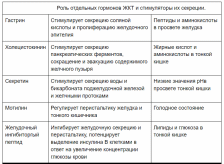
1. Перечислите основные гормоны ЖКТ и назовите их физиологическую роль. Дайте характеристику их структуры.
В эндокринном контроле функции пищеварения участвует большая группа гормонов, нейропептидов и нейромедиаторов. Большинство этих регуляторов синтезируются клетками гастроэнтеропанкреатической (ГЭП) системы - своеобразной железы внутренней секреции желудочно- кишечного тракта. Гастроэнтеропанкреатические гормоны – это биологически активные пептиды.
Гастрин:

Холеоцистокеин:

Секретин:

Огромная протяженность желудочно-кишечного тракта и разнообразие органов, участвующих в переваривании и усвоении продуктов питания создает определенные сложности в регуляции процессов пищеварения, а регуляторам придает свойства, отличающие их от общепринятого понятия гормона. В секреции гормонов ЖКТ важным элементом является временная составляющая – не все гормоны секретируются одновременно, их секреция тесно увязывается во времени с фазами пищеварения.
|
Изучите гниение белков в кишечнике
|
1. Сформулируйте понятие о гниении белков в кишечнике.
Белки, не расщепившиеся в тонком отделе кишечника, подвергаются расщеплению в толстом кишечнике под воздействием пептидаз, которые синтезируются находящейся здесь микрофлорой. Ферменты микрофлоры толстого кишечника способны расщеплять многие аминокислоты пищи с образованием различных токсичных веществ: фенола, крезола, индола, сероводорода, меркаптанов и др. Такое превращение аминокислот в толстом кишечнике называется гниением белков. Токсические вещества всасываются в кровь и доставляются в печень, где подвергаются обезвреживанию.
2. Представьте примеры химических процессов превращения аминокислот в ядовитые продукты гниения.
В процессе глубокого распада серосодержащих аминокислот (цистина, цистеина и метионина) в кишечнике образуются сероводород H2S и меркаптан CH3SH. Диаминокислоты, в частности орнитин и лизин, подвергаются процессу декарбоксилирования с образованием диаминов, иногда называемых трупными ядами, поскольку они образуются также при гнилостном разложении трупов. Из орнитина образуется путресцин, а из лизина — кадаверин:
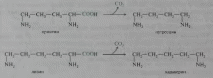
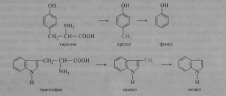
Из фенилаланина, тирозина и триптофана при бактериальном декарбоксилировании образуются соответствующие биогенные амины: фенилэтиламин, л-гидроксифенилэтиламин (или тирамин) и индолилэтиламин (триптамин); при постепенном разрушении боковых цепей циклических аминокислот, в частности тирозина и триптофана, образуются ядовитые продукты обмена: соответственно крезол и фенол, скатол и индол:
3. Дайте примеры основных процессов детоксикации продуктов гниения.
Соединения, поступающие в организм с пищей, через кожу или легкие и не используемые организмом для энергетических и пластических целей, называются чужеродными веществами или ксенобиотиками. Они, как правило, гидрофобны, токсичны и должны удаляться из организма. Для снижения их токсичности и повышения растворимости они подвергаются детоксикации, которая заключается в их химической модификации, и удаляются из организма. Обезвреживанию подвергаются также токсические вещества, образующиеся в организме: NH3, пептидные и стероидные гормоны, катехоламины, продукты катаболизма гема, продукты гниения аминокислот в кишечнике. Лекарственные вещества в редких случаях используются организмом в качестве субстратов, большая их часть, выполнив свою функцию, которая заключается во взаимодействии с белками или ферментами, должны быть удалены из организма. Они могут, в зависимости от их структуры, выводиться из организма как в неизмененном виде, так и в модифицированном.
Обезвреживание токсических веществ происходит путем химической модификации в две фазы:
• в реакциях первой фазы гидрофобное вещество модифицируется, причем чаще всего происходит его гидроксилирование;
• во вторую фазу происходит реакция конъюгации.
Конъюгация - это присоединение к функциональным группам, образовавшимся в первой фазе или уже имеющимся у ксенобиотиков, других молекул или групп, увеличивающих гидрофильность и уменьшающих их токсичность.
Конъюгация может происходить с:
• глицином,
• глюкуронатом,
• сульфатом,
• ацетататом,
• метильной группой,
• глутатионом.
В этой фазе участвуют ферменты трансферазы, которые присоединяют различные конъюгаты к гидрофильным группам обезвреживаемых веществ. Полученный продукт, как правило, хорошо растворим и легко удаляется из организма с желчью и мочой.
4. Напишите структурные формулы ФАФС и УДФ-глюкуроновой кислоты и примеры реакций обезвреживания с их участием.
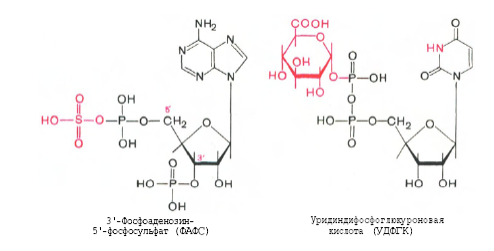
Индол и скатол обезвреживаются в печени, предварительно окисляясь соответственно в индоксил и скатоксил, выводятся из организма в виде парных соединений, вступая в реакцию конъюгации с З-фосфоаденозил-5-фосфосульфатом (ФАФС) или уридиндифосфатглюкуроновой кислотой (УДФГК).
В качестве примера приведена реакция детоксикации индола, которая заканчивается образованием животного индикана, выводимого с мочой:
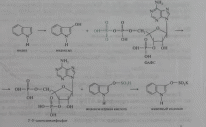
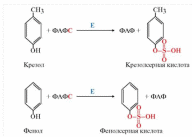
Конъюгация фенола и крезола с глюкуроновой кислотой происходит при участии фермента УДФ-глюкуронилтрансферазы. Продукты конъюгации - фенолглюкуронат и крезолглюкуронат хорошо растворимы в воде и выводятся с мочой. Повышение количества конъюгатов глюкуроновой кислоты с фенолом и крезолом в моче обнаруживается при усилении гниения белков в кишечнике.
|
Обмен аминокислот. Обезвреживание аммиака
Задание
|
Указания к выполнению задания
|
Вспомните структуру и свойства аминокислот.
|
1. Напишите структуру моноаминомонокарбоновых аминокислот.
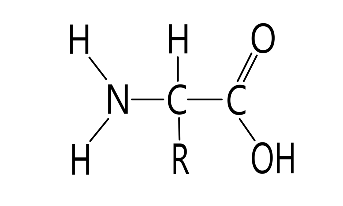
Природные АК содержат NH2 группу в α-положении (20 штук).
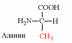 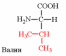 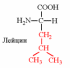 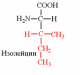 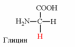 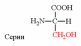 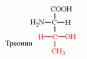 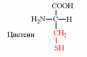 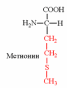 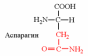 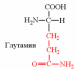
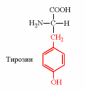
2. Напишите структуру ароматических и гетероциклических аминокислот.
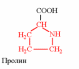  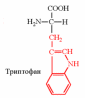 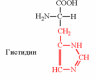 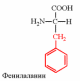
3. Напишите структуру моноаминодикарбоновых и диаминомонокарбоновых аминокислот.
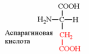 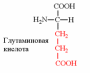 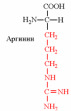 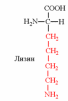
|
Изучите общие пути превращений аминокислот в тканях.
|
1. Дайте определение понятию «клеточный метаболический фонд аминокислот».
В клетках постоянно поддерживается определенный стационарный уровень аминокислот - фонд (пул) свободных аминокислот. Этот фонд обновляется за счет поступления аминокислот и используется для синтеза биологически важных химических компонентов клетки, т.е. можно выделить пути поступления и использования клеточного пула аминокислот.
За сутки в организме человека обновляется до 400 г белка. В целом период распада всех белков организма человека составляет 80 суток. Необратимо распадается четвертая часть белковых аминокислот (около 100 г). Эта часть возобновляется за счет пищевых аминокислот и эндогенного синтеза - синтеза заменимых аминокислот.
2. Зарисуйте схему основных путей поступления и использования аминокислот в клетке.
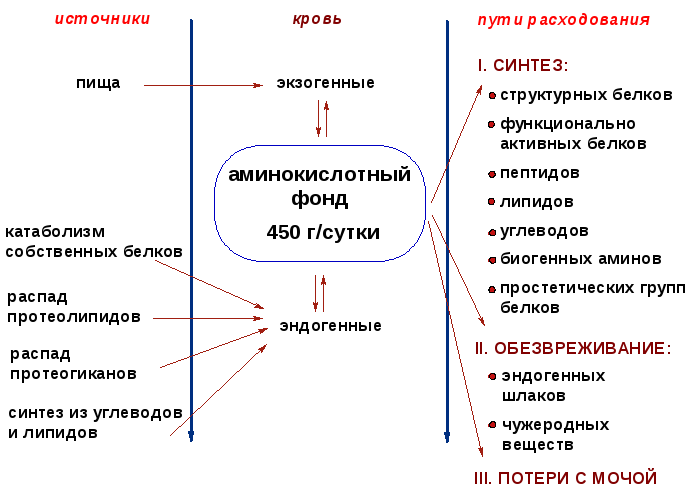
|
Изучите процессы переаминирования, дезаминирования и декарбоксилирования аминокислот.
|
1. Представьте общую схему процесса переаминирования.
Трансаминирование аминокислот — это реакция переноса аминогруппы с аминокислоты на кетокислоту. Такие реакции обратимы и получили название "переаминирование", или "трансаминирование". В ходе реакций трансаминирования образуются новые амино- и кетокислоты:

2. Вспомните структуру пиридоксальфосфата и напишите молекулярный механизм переаминирования.
Пиридоксалевые ферменты, ферменты, простетической группой которых является пиридоксальфосфат. К П. ф. относятся аминотрансферазы, рацемазы, декарбоксилазы, ди- и моноаминоксидазы и многие др. ферменты, катализирующие важнейшие превращения аминокислот в организмах.
Пиридоксальфосфата:
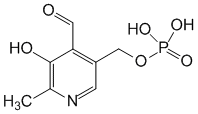
В азометинах происходит смещение электронов по направлению от a-углеродного атома аминокислоты к атому азота пиридинового кольца пиридоксальфосфата (показано стрелками), что приводит к поляризации и разрыву связей у a-углеродного атома аминокислоты. Направление и специфичность происходящих далее реакций определяются структурой белковой части фермента — апоферментом. В П. ф. альдегидная группа пиридоксальфосфата образует связь с e-NH2-группой остатка лизина в апоферменте. Поэтому первый этап взаимоействия П. ф. с субстратом аминокислотой) — реакция замещения, в ходе которой NH2-группа аминокислоты вытесняет NH2-группу фермента из связи с СО-группой пиридоксальфосфата с образованием азометина I. В этом случае азометин I превращается в азометин II, который легко гидролизуется с образованием оксокислоты (III) и пиридоксальфосфата (IV); далее реакция идёт между связанными с ферментом пиридоксаминфосфатом и др. оксокислотой, что приводит к образованию новой аминокислоты и пиридоксальфосфата. В аминотрансферазах функции кофермента могут выполнять как пиридоксальфосфат, так и пиридоксаминфосфат, подвергающиеся взаимопревращению в ходе переаминирования.
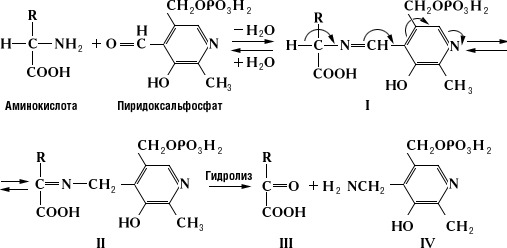
3. Объясните биологический смысл переаминирования и его роль во взаимосвязи обмена аминокислот с углеводами, липидами, циклом трикарбоновых кислот.
Растения и многие виды бактерий содержат ферментные системы, необходимые для синтеза всех требуемых α-кетокислот. Животные утратили способность синтезировать некоторые α-кетокислоты. Эти α–кетокислоты соответствуют незаменимым аминокислотам. Другие α-кетокислоты (соответствующие заменимым аминокислотам) могут образовываться в результате метаболизма иных веществ, в основном из глюкозы.
Последней реакцией в синтезе аминокислот из α-кетокислот является реакция трансаминирования , в ходе которой аминогруппа переносится от донорной аминокислоты к акцепторной α-кетокислоте. В результате получается α-кетокислота из донорной аминокислоты и новая аминокислота. Реакцию катализируют ферменты аминотрансферазы (трансаминазы) с участием кофермента пиридоксальфосфата (производное витамина В6). Эта реакция легко обратима. Любые аминокислоты, которых в пище недостаточно, можно получить за счет имеющихся в избытке, при наличии соответствующих α-кетокислот:
Трансаминирование происходит практически во всех органах. Большинство промежуточных продуктов важных метаболических путей являются кетокислотами, которые могут включаться в трансаминирование.
4. Напишите названия глюкогенных и кетогенных аминокислот.
К глюкогенным относятся аминокислоты, при распаде которых образуются пируват и метаболиты ЦТК, например, оксалоацетат или α-кетоглутарат. В дальнейшем образующиеся метаболиты ЦТК могут уходить на синтез глюкозы (глюкогенные).

Строго кетогенными являются лизин и лейцин, при их окислении образуется исключительно ацетил-SКоА. Он принимает участие в синтезе кетоновых тел (кетогенные), жирных кислот и холестерола.
5. Охарактеризуйте типы дезаминирования в живых системах.
Дезаминирование аминокислот связано с потерей NН2-группы и образованием свободного аммиака и кетокислот. Реакции дезаминирования протекают при участии ферментов дезаминаз или оксидаз. Кроме аммиака, при дезаминировании аминокислот образуются окси- и кетокислоты. Различают несколько видов процесса дезаминирования: восстановительное, гидролитическое, внутримолекулярное и окислительное. У животных и человека преобладают два последних вида дезаминирования.
6. Напишите схему действия глутаматдегидрогеназы
Окислительное дезаминирование аминокислот интенсивно протекает при увеличении потребления энергии в клетке, так как эта реакция сопровождается извлечением энергии в виде высокоэнергетического Н2 в составе восстановленного НАДН2 или ФАДН2. Наиболее активно окислительному дезаминированию подвергается глутаминовая кислота, что связано с
высокой активностью глутаматдегидрогеназы, обнаруженной почти во всех тканях:
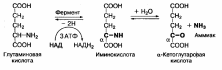
Фермент глутаматдегидрогеназа катализирует как реакцию дезаминирования, так и обратимую реакцию — аминирования, что приводит к образованию глутаминовой кислоты из аммиака и α-кетоглутаровой кислоты. Этот процесс называется восстановительным аминированием.
7. Напишите непрямое дезаминирование аланина, аспартата, серина.
Непрямое дезаминирование аланина:
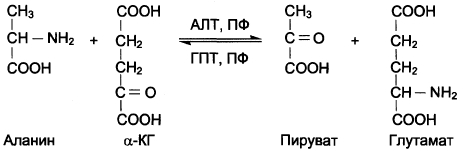
Непрямое дезаминирование аспартата:
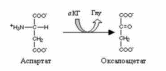
Непрямое дезаминирование серина:
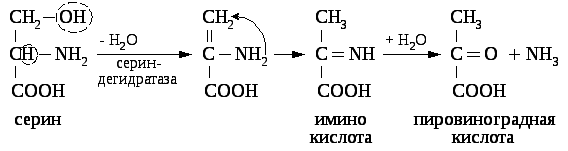
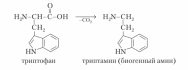
8. Напишите реакции декарбоксилирования гистидина, триптофана, лизина, глутамата.
Декарбоксилирования триптофана:
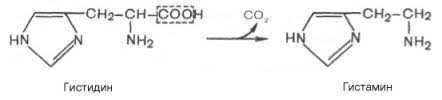
Декарбоксилирования гистидина:
Декарбоксилирования лизина:
Декарбоксилирования глутамата:

9. Охарактеризуйте биологические эффекты образующихся аминов.
Образующийся триптамин обладает сильным фармакологическим действием на множество физиологических функций человека и животных. Так, триптамин и серотонин оказывают сосудосуживающее действие. Функционально важной реакцией такого типа является декарбоксилирование аминокислоты гистидина, ведущее к образованию тканевого гормона гистамина. Гистамин обладает широким спектром биологического действия. Много гистамина образуется в очаге воспаления, обладая сосудорасширяющим действием, он ускоряет приток лейкоцитов и тем самым активирует защитные силы в борьбе с инфекцией. Кадаверин содержится в продуктах гнилостного распада белков; образуется из лизина при его ферментативном декарбоксилировании. Ранее кадаверин относили к так называемым трупным ядам (птомаинам), однако ядовитость кадаверина относительно невелика. Имеется в свободной форме в наличии как в разлагающейся биомассе животных и растительных организмов, так и в живых растениях. Важную биологическую функцию выполняет γ-аминомасляная кислота (ГАМК) — продукт а-декарбоксилирования глутаминовой кислоты. Оба эти соединения — глутамат и ГАМК — относятся к нейромедиаторам: ГАМК ингибирует, а глутамат активирует передачу нервных импульсов. Введение γ-аминомасляной кислоты вызывает тормозной процесс в коре головного мозга (центральное торможение), а у животных приводит к утрате условных рефлексов. γ-Аминомасляная кислота используется в клинике при лечении некоторых заболеваний ЦНС, связанных с резким возбуждением коры головного мозга. Декарбоксилирование аминокислот — необратимый процесс превращения аминокислот, который приводит к образованию биогенных аминов, отличающихся чрезвычайной биологической активностью.
10. Напишите схему инактивации аминов в организме.
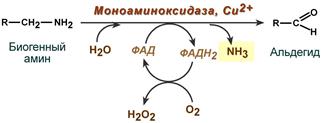
Существуют два способа инактивации биогенных аминов - дезаминирование и метилирование.
Дезаминирование протекает с образованием свободного аммиака и с участием ФАД. Катализирует реакцию моноаминоксидаза, она обнаружена во многих тканях, но наиболее активна в печени, желудке, почках, кишечнике, нервной ткани.
Реакция с участием моноаминоксидазы
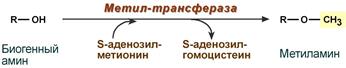
Метилирование биогенного амина происходит при наличии у него гидроксильной группы (дофамин, серотонин). В реакции принимает участие активная форма метионина – S-аденозилметионин (SAM), образуется метилированная форма амина и S-аденозилгомоцистеин (SАГ).
Реакция метилирования
|
Изучите пути обезвреживания аммиака в организме.
|
1. Напишите реакции синтеза и распада глутамина.
Транспорт аммиака из других органов в печень осуществляется в основном в виде глутамина (амида глутаминовой кислоты). Биосинтез глутамина (Глн) катализируется митохондриальным ферментом глутаминсинтетазой, присутствующим почти в
всех тканях. На синтез одной амидной связи затрачивается энергия гидролиза 1 молекулы АТФ:
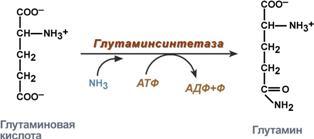
Экскреция аммиака с мочой. Клетки почек поглощают из циркулирующей крови глутамин. Фермент глутаминаза в почках катализирует гидролиз глутамина с образованием глутамата и аммиака.

Образующийся глутамат может в дальнейшем подвергаться дезаминированию при участии глутаматдегидрогеназы. Таким образом, из одной молекулы глутамина всего может образоваться две молекулы аммиака.
2. Представьте схему выведения аммиака с мочой.
В печени весь удаляемый аммиак используется для синтеза мочевины. Увеличение синтеза мочевины наблюдается при распаде тканевых белков и азотистых соединений (голодание, воспалительные процессы, сахарный диабет) или при избыточном белковом питании. У младенцев и детей синтез мочевины может быть снижен по двум причинам: незрелость печени и активный синтез белков и нуклеиновых кислот при росте организма.
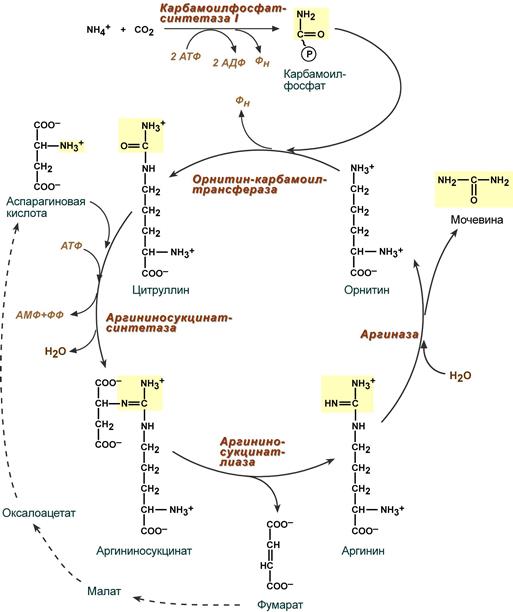
Реакции синтеза мочевины являются циклическим процессом и получили название орнитиновый цикл. Синтез мочевины начинается в митохондриях (первая и вторая реакции), оставшиеся три реакции идут в цитозоле. Для переноса цитруллина и орнитина через митохондриальную мембрану существуют специальные переносчики.
В образовании одной молекулы мочевины участвует 1 молекула NH4+, 1 молекула CO2, аминогруппа 1 молекулы аспарагиновой кислоты, затрачивается 4 макроэргических связи трех молекул АТФ.
Реакция синтеза карбамоилфосфата и орнитиновый цикл
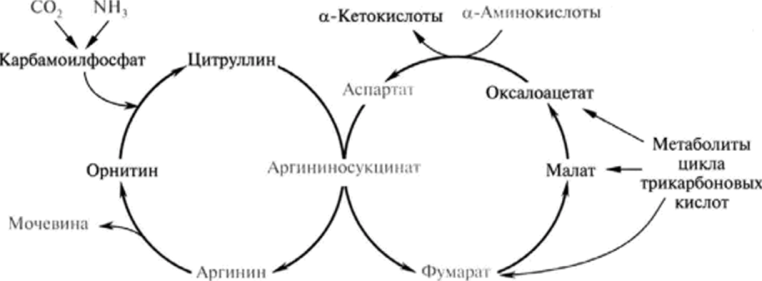
3. Нарисуйте схему взаимосвязи между орнитиновым циклом и циклом трикарбоновых кислот.
Как побочный продукт орнитинового цикла образуется фумаровая кислота, переносимая обратно в митохондрии. Она связывает между собой орнитиновый цикл мочевины с циклом трикарбоновых
кислот Здесь в реакциях ЦТК из нее образуется оксалоацетат, который трансаминируется с глутаматом до аспартата, выходит в цитозоль и вновь реагирует с цитруллином.
4. Объясните, какие соединения являются донорами первого и второго атомов азота при синтезе мочевины. Напишите реакции орнитинового цикла с участием этих соединений.
Непосредственных источников азота мочевины — два: аммиак и NH2-acпартата, который превращается в безазотистое соединение фумаровую кислоту;
Первый этап — синтез аминокислоты цируллина протекает в митохондриях печени, где аммиак обезвреживается путем связывания с С02 и образования карбамоилфосфата при участии фермента карбамоилфосфатсинтетазы I (КФС I):
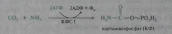
Второй этап — синтез аргинина из цитруллина и аспартата (донора аминогруппы) протекает уже в цитоплазме печени и включает двереакции.
1. Конденсация цитруллина и аспарагиновой кислоты с образованием аргининосукцината катализируется аргининосукцинатсинтетазой:
 2. Аргининосукцинат распадается на аргинин и фумаровую кислоту при участии фермента аргининосукцинатлиазы: 2. Аргининосукцинат распадается на аргинин и фумаровую кислоту при участии фермента аргининосукцинатлиазы:

|
Изучите процессы обмена некоторых аминокислот.
|
1. Представьте схему метаболизма ароматических аминокислот. Назовите биохимические дефекты при фенилкетонурии, альбинизме, алкаптонурии.
Триптофан относится к группе гидрофобных ароматических аминокислот и для человека является незаменимой аминокислотой.
Поступающий в составе белков пищи триптофан в основном используется для биосинтеза белков, биогенного аминасеротонина и гормона мелатонина, и ниацина (витамин PP).
Метаболизм аминокислоты осуществляется в трех направлениях, которые сложны и на некоторых участках перекрещиваются друг с другом. Принципиально можно выделить следующие пути:
1. Кинурениновый (основной) – окисление и разрушение индольного кольца с образованием производных кинуреновой и антраниловой кислот. Большая часть триптофана распадается до ацетил-SКоА, но в одном из ответвлений этого пути одна из 60 молекул триптофана превращается в никотиновую кислоту (витамин B3, ниацин).
2. Серотониновый путь – окисление до 5-окситриптофана и далее превращение в серотонин и мелатонин.
3. Индольный путь – образование индольных производных, которые затем конъюгируются и выводятся с мочой.
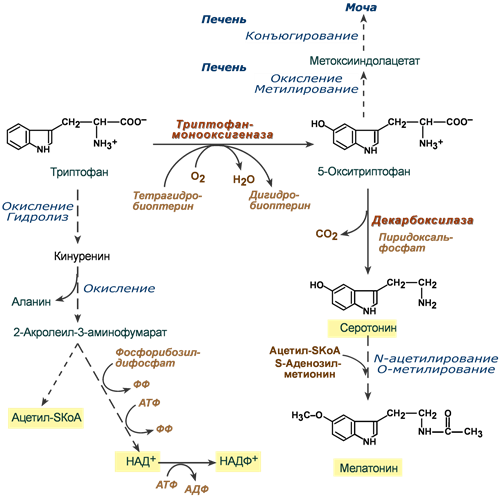
Реакции метаболизма триптофана
Тирозин образуется из незаменимой аминокислоты фенилаланина путем ее гидроксилирования под действием оксигеназы (фенилаланин-4-гидроксилаза) за счет прямого присоединения кислорода:

Фенилкетонурия развивается как результат потери способности организма синтезировать фенилаланингидроксилазу, катализирующую превращение фенилаланина в тирозин. Характерной особенностью болезни является резкое замедление умственного развития ребенка, а также экскреция с мочой больших количеств фенилпировиноградной кислоты (до 1—2 г в сутки) и фенилацетилглутамина (до 2—3 г). Развитие болезни можно предотвратить, если значительно снизить или исключить прием фенилаланина с пищей с самого рождения ребенка.
Алкаптонурия характеризуется экскрецией с мочой больших количеств (до 0,5 г в сутки) гомогентизиновой кислоты, развиваются охроноз, отложение пигмента в тканях. Метаболический дефект при алкаптонурии связан с врожденным отсутствием в печени и почках оксидазы гомогентизиновой кислоты.
Альбинизм характеризуется врожденным отсутствием пигментов в коже, волосах и сетчатке. Метаболический дефект связан с нарушением способности синтезировать тирозиназу — фермент, катализирующий окисление тирозина в диоксифенилаланин и диоксифенилаланинхинон, которые являются предшественниками пигмента меланина.
Таким образом, при наследственных заболеваниях первичные нарушения обмена отдельных аминокислот чаще всего связаны с синтезом дефектных ферментных белков или их полным отсутствием (ферментопатии, или энзимопатии). Идентификация химической реакции или ферментативной системы, нарушение функции которой является первопричиной развития тяжелого наследственного заболевания, представляет не только большой теоретический интерес, но и играет решающую роль в диагностике и терапии этих болезней.
2. Напишите примеры реакций метилирования с участием S-аденозилметионина.
5-аденозилметионин образуется в процессе АТФ-зависимой реакции из метионина:
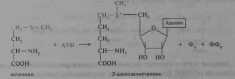
В S-аденозилметионине метильная группа метионина активируется под действием положительно заряженного соседнего атома серы, поэтому ее реакционная способность значительно выше, чем у N5-метилтетрагидрофолата (N5-метил ТГФ).
Примеры:
3. Напишите структуру глутатиона и укажите его биологическую роль.
Роль переносчика аминокислот принадлежит широко распространенному в биологических системах трипептиду глутатиона:
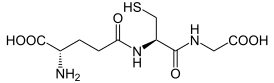
Главную роль в этом процессе играет мембрано-связанный гликопротеин — фермент γ-глутамилтрансфераза (ГГТФ), который катализирует перенос γ-глутамильного остатка глутатиона на транспортируемую аминокислоту, т. е. глутатион выполняет роль донора γ-карбоксильной группы глутаминовой кислоты, а аминокислота — акцептор этой группы.
4. Представьте схему превращений цистеина и глицина.
Серин является предшественником глицина и цистеина. При синтезе глицина β-углеродный атом серина переносится на тетрагидрофолат (ТГФ) — переносчик одноуглеродных фрагментов:
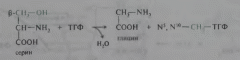
Эта реакция катализируется ферментом серингцдроксиметилтрансферазой, простетической группой которого является пиридоксальфосфат. Цистеин синтезируется из серина и гомоцистеина (деметилированного метионина), выступающего донором сульфогруппы. Реакции протекают в две стадии и катализируются также пиридоксальфосфатзависимыми ферментами — цистатионсинтазой и цистатиониназой:
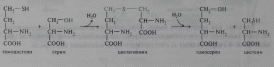
| |
 Скачать 7.25 Mb.
Скачать 7.25 Mb.