2.6. Определение технологической схемы синтеза и её описание.
Мной был выбран способ получения анилина восстановлением нитробензола водородом в газовой фазе по методу фирмы IG Farbenindustrie.
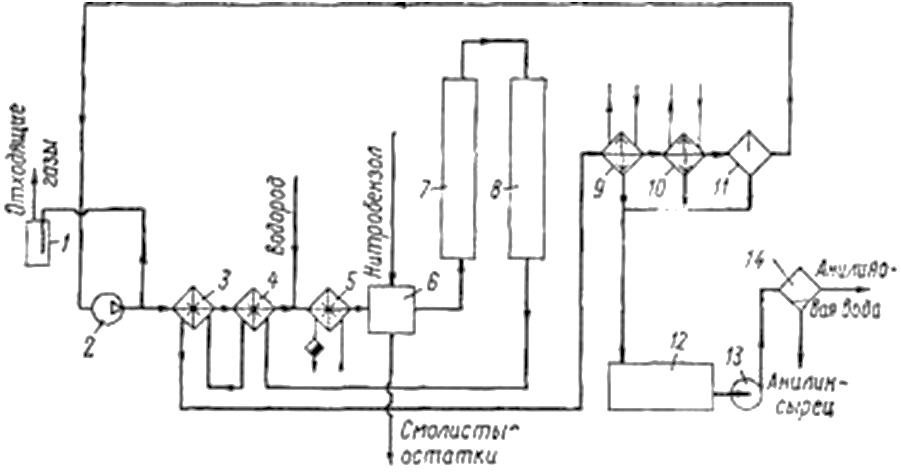
Рис.1. Схема получения анилина по методу фирмы IG Farbenindustry:
1—гидравлический затвор; 2 — газодувка; 3, 4, 5 — теплообменники; 6—испаритель; 7, 8—реакторы; 9, 10 — холодильники-конденсаторы; 11 — фазоразделитель; 12—сборник; 13 — насос; 14 — сепаратор.
Фирма IG Farbenindustrie для установки в г. Людвигсхафене мощностью 3 тыс. т анилина в год использовала адиабатический реактор.
Схема установки представлена на рис.1 . Нитробензол подают в испаритель 6 с падающей пленкой жидкости; сюда же поступает нагретый водород. Чтобы не отравлять медный катализатор, в водороде не должно быть оксида углерода.
Смесь водорода и паров нитробензола при 170°С поступает в первый реактор 7; из реактора 8 контактные газы выходят при 350—370 °С. Реакторы работают при небольшом избыточном давлении (0, 035 МПа). Температуру в реакторе 7 регулируют, подавая относительно холодный водород в циркуляционный контур, минуя подогреватели 3 и 4. Расход водорода регулируют специальным клапаном в зависимости от температуры в реакторе 7. По мере дезактивирования катализатора повышают температуру поступающей в реактор смеси нитробензола и водорода.
Когда температура на входе в реактор 7 достигнет 280°С, прекращают подачу нитробензола и переводят реактор на режим регенерации. Она состоит в том, что катализатор сначала продувают воздухом, тщательно контролируя температуру, а затем восстанавливают водородом. Обычно регенерацию проводят через 2000 ч работы катализатора. После 4—5 регенераций проводят допропитку катализатора, пропуская через реакторы медноаммиачный раствор. Через 6700 ч работы (т. е. после переработки около 4000 т нитробензола) катализатор подлежит замене. Расход меди составляет примерно 0, 7 кг на 1000 кг анилина.
Продукты реакции после теплообменников 4 и 3 отделяют от циркулирующего водорода в двух охлаждаемых водой трубчатых холодильниках-конденсаторах 9 и 10. Анилин-сырец и анилиновую воду разделяют в сепараторе 14 и направляют на дальнейшую переработку. Из воды экстрагируют растворенный анилин нитробензолом, а органический слой ректифицируют, получая в итоге товарный анилин. Выход в целом по процессу составляет 98 % от теоретического (в расчете на товарный анилин). В кубовых остатках содержится около 0, 3 % о-аминофенола.
Основной аппарат.
В качестве основного аппарата мной выбран адиабатический реактор.
 Рис.2. Схема адиабатического реактора: 1–зона реакции; 2–корпус реактора; 3–теплоизоляция. Рис.2. Схема адиабатического реактора: 1–зона реакции; 2–корпус реактора; 3–теплоизоляция.
Адиабатический реактор представляет собой две последовательно соединенные башни емкостью по 50 м3, засыпанные катализатором. В качестве катализатора применены куски пемзы, пропитанные карбонатом меди и 50 %-ным раствором силиката натрия. Перед началом процесса восстанавливают катализатор, продувая его циркулирующим водородом при 190—200 °С.
Адиабатические Реакторы при спокойном (без перемешивания) течении потока реагентов не имеют теплообмена с окружающей средой, так как снабжены хорошей теплоизоляцией. Вся теплота реакции аккумулируется потоком реагирующих веществ.
К достоинствам адиабатических реакторов относится: полнота использования объема реактора; сравнительная простота конструкции и удобство в эксплуатации, относительно не большой удельной расход металла. Серьезным недостатком адиабатического реактора является то, что в нем невозможно обеспечить высокую производительность катализатора. Съем анилина с 1 л катализатора в процессе фирмы IG Farbenindustrie составляет всего 5—8 г/ч.
3. Расчет материального баланса
Материальный баланс стадии синтеза.
Материальный баланс отражает соотношение количеств реагирующих веществ, вводимых в процесс, полупродуктов и продуктов производства, а также отходов и потерь. Он рассчитывается на основании закона сохранения массы веществ и уравнений химических реакций. Материальный баланс служит основой составления теплового (энергетического баланса). Материальный баланс – вещественное выражение закона сохранения массы вещества, согласно которому во всякой замкнутой системе масса веществ, вступающих во взаимодействие равна массе веществ, образовавшихся в результате данного взаимодействия.
Основная реакция:
C6H5NO2 + 3H2 → C6H5NH2 + 2H2O
(A) (B) (C) (D)
(анилин)
Побочная реакция:
C6H5NO2 + 6H2 → C6H11NH2 + 2H2O
(A1) (B1) (E) (D1)
(нитробензол) (циклогексиламин)
Уравнение материального баланса для основной и побочной реакций:
GA + GA1 + GB + GB1 + G C6H6 + G N2 = GE + GD + GD1 + GC6H6 +GN2 + GA2 + GB2 + Gпотерь
Расчёт производительности в кмоль/час:
GC = ПС·1000 / MrС·n·24 = 220·1000 / 93·24·280 = 0,352 кмоль/час
MrC6H5NH2 = 6·12+5·1+14+2·1 = 93
Приход.
1)Количество C6H5NO2 требующееся для получения 0,452 кмоль/час анилина:
GA = vA /vC · GC = 1/1·0.352 = 0,352 кмоль/час
1.1с учётом технологического выхода :
GAꞋ = GA/f = 0,352/0,97 = 0,363 кмоль/час
1.2с учётом селективности:
GAꞋꞋ = GAꞋ/Ф = 0,363/0,82 = 0,443 кмоль/час
1.3с учётом степени превращения:
GAꞋꞋꞋ = GAꞋꞋ/XA = 0,443/0,87 = 0,509 кмоль/час
2)Количество C6H5NO2, пошедшее на побочную реакцию:
GA1 = GAꞋꞋ - GAꞋ = 0,443 – 0,363 = 0,08 кмоль/час
3)Количество непрореагировавшего C6H5NO2:
GA2 = GAꞋꞋꞋ - GAꞋꞋ = 0,509 – 0,443 = 0,066 кмоль/час
4)Количество технического C6H5NO2:
GA3 = GAꞋꞋꞋ·MrA / 0,87 = 0,509·123 / 0,87 = 71,942 кг/час
В том числе C6H6 : G C6H6 = GA3·13 / 100 = 71,942·13/100 = 9,355 кг/час
или 9,335 / 78 = 0,120 кмоль/час
Mr C6H5NO2 = 6·12+5·1+14+16·2 = 123
Mr C6H6 = 12·6+1·6 = 78
5)Количество водорода по заданному мольному соотношению:
GB = GAꞋꞋꞋ·10 = 0,509·10 = 5,09 кмоль/час
6)Количество водорода пошедшего на целевую реакцию:
GBꞋ = vB / vA·GAꞋ = 3/1·0,363 = 1,089 кмоль/час
7)Количество водорода пошедшего на побочную реакцию:
GB1 = vB1 / vA1·GA1 = 6/1·0,08 = 0,48 кмоль/час
8)Количество непрореагировавшего водорода:
GB2 = GB-(GBꞋ+GB1) = 5,09-(1,089+0,48) = 3,621 кмоль/час
9)Количество технического водорода:
GB3 = GB·MrH2 / 0,52 = 5,09·2 / 0,52 = 19,577 кг/час
В том числе GN2: GN2 = GB3·0,48 = 19,577·0,48 = 9,397 кг/час
или 9,397/28 = 0,336 кмоль/час
MrN2 = 14·2 = 28
Расход.
10) По целевой реакции образовалось 0,363 кмоль/час анилина.
Технологические потери составят:
0,363-0,352 = 0,011 кмолль/час
11) Количество воды образовавшееся в целевой реакции:
GD = vD / vC·GC = 2/1·0,363 = 0,726 кмоль/час
12)Побочно образовалось циклогексиламина:
GE = vE / vA1·GA1 = 1/1·0,08 = 0,08 кмоль/час
13) Побочно образовалось воды:
GD1 = vD1 / vE·GE = 2/1·0,08 = 0,16 кмоль/час
Итого общее количество воды:
GD2 = GD+GD1 = 0,726+0,16 = 0,886 кмоль/час
Результаты расчётов сведены в таблицу:
Приход.
Наименование веществ
|
кмоль/час
|
%,мольн.
|
кг/час
|
%масс.
|
м3/час
|
%объём.
|
Нитробензол технический в том числе: C6H5NO2C6H6
|
- 0,509 0,120
|
- 8,41 1,98
|
71,942 62,607 9,335
|
68,41 10,20
|
0,052 0,010
|
0,043 0,008
|
Водород технический в том числе: H2 N2
|
- 5,09 0,336
|
- 84,06 5,55
|
19,577 10,18 9,397
|
11,12 10,27
|
80,111 7,517
|
93,721 6,228
|
Итого:
|
6,055
|
|
91,519
|
|
87,986
|
|
Расход.
Наименование веществ
|
кмоль/час
|
%,мольн.
|
кг/час
|
%масс.
|
м3/ч
|
%объём
|
Анилин
|
0,452
|
6,55
|
32,736
|
35,77
|
0,032
|
0,036
|
Циклогексиламин
|
0,08
|
1,49
|
7,92
|
8,65
|
9,669
|
10,989
|
Вода
|
0,886
|
16,49
|
15,948
|
17,43
|
0,016
|
0,018
|
Азот
|
0,436
|
6,25
|
9,397
|
10,27
|
7,517
|
8,543
|
C6H6
|
0,220
|
2,23
|
9,335
|
10,20
|
0,010
|
0,011
|
C6H5NO2 непрор.
|
0,066
|
1,24
|
8,118
|
8,87
|
0,007
|
0,008
|
H2 непрор.
|
3,621
|
65,54
|
7,042
|
7,69
|
78,244
|
80,927
|
Технологические потери анилина
|
0,011
|
0,21
|
1,023
|
1,12
|
0,008
|
0,009
|
Итого
|
6,055
|
|
91,519
|
|
87,986
|
|
4. Заключение
Анили́н (фениламин) — органическое соединение с формулой
C6H5NH2, простейший ароматический амин. Получают анилин из толуола и хлорбензола, аммонолизом фенола и бензола, замещением сульфогруппы аминогруппой, восстановлением нитробензола чугунной стружкой в кислой среде (метод Бешана) и каталитическим восстановлением нитробензола в жидкофазной и газофазной средах. Достаточного внимания заслуживает метод газофазного каталитического восстановления. Он является достаточно экономичным способом получения анилина: в процессе участвует меньше аппаратов, что сокращает энергозатраты, практически отсутствуют побочные продукты, в процессе производства не образуются отходы, а выход готового продукта составляет 98%. При данном способе получения анилина получаются низкие энергетические затраты, так как выделяющееся тепло утилизируется для получения водяного пара и сокращается количество отходов.
Более 60 лет анилин использовался исключительно в анилинокрасочной промышленности. В этот период производство красителей в промышленно развитых странах в среднем увеличивалось в год на 4 %.
В расчетно-графической работе было рассмотрено получение анилина в стадии синтеза, описаны технологическая схемы и сырье, используемое в производстве анилина.
Кроме того, был составлен материальный баланс изученного производства и рассчитаны основные технические показатели эффективности производства.
В данной работе была представлена технологическая схема получения анилина по методу фирмы IG Farbenindustrie, которая в качестве основного аппарата использовала адиабатический реактор, представляющий собой две последовательно соединенные башни емкостью по 50 м3, засыпанные катализатором.
5. Литература
Артеменко А. И. Органическая химия. — М.: «Высшая школа», 1987. — 430 с.
Анилин // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
http://chemanalytica.com/book/novyy_spravochnik_khimika_i_tekhnologa/12_obshchie_svedeniya/6130
|
 Скачать 1.07 Mb.
Скачать 1.07 Mb.

