производство анилина. Производство анилина
 Скачать 1.07 Mb. Скачать 1.07 Mb.
|
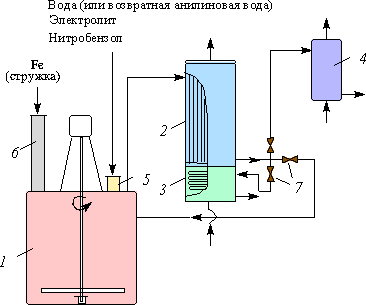
1.4. {\displaystyle {\mathsf {C_{6}H_{5}NH_{2}+HCl\rightarrow [C_{6}H_{5}NH_{3}]Cl}}}Физические свойства анилинаЯдовитое вещество, пары которого токсичны. Представляет собой маслянистую жидкость, не имеющую цвета. Запах слабый, характерный именно для этого вещества. При его возгорании пламя яркое, коптящее. Частично растворим в воде (при температуре кипения растворимость 6,4 %). Минерализованная вода понижает его растворимость, за исключением содержания бромидов лития и цезия, а также йодида цезия. Последний, наоборот, повышает растворимость анилина. При хранении вещество темнеет, особенно быстро это происходит при воздействии воздуха и света. При этом он делается более вязким. Иначе данный процесс называют «аутооксидацией». Окисление может быть замедленно при помощи добавления антиоксидантов – щавелевой кислоты, гидро- и тиосульфата натрия. Ниже приведены характеристики анилина при нормальном атмосферном давлении: температура кипения - 184,4 °С; температура плавления/замерзания – минус 5,89 °С; плотность при температуре 20 °С - 1,02 г/см куб.; температура самовоспламенения на воздухе - 562 °C; температура вспышки на воздухе – 79 °C. 1.5. Получение и применение В промышленности анилин получают в две стадии. На первой стадии бензол нитруется смесью концентрированной азотной и серной кислот при температуре 50 - 60°C в результате образуется нитробензол. На втором этапе нитробензол гидрируют при температуре 200-300°C в присутствии катализаторов Впервые восстановление нитробензола было произведено с помощью железа: Другим способом получение анилина является восстановление нитросоединений — Реакция Зинина: Изначально анилин получали восстановлением нитробензола молекулярным водородом; практический выход анилина не превышал 15 %. При взаимодействии концентрированной соляной кислоты с железом выделялся атомарный водород, более химически активный по сравнению с молекулярным. Реакция Зинина является более эффективным методом получения анилина. В реакционную массу вливали нитробензол, который восстанавливается до анилина. По состоянию на 2002 год, в мире основная часть производимого анилина используется для производства метилдиизоцианатов, используемых затем для производства полиуретанов. Анилин также используется при производстве искусственных каучуков, гербицидов и красителей (фиолетового красителя мовеина) В России он в основном применяется в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты), но в связи с ожидаемым ростом производства полиуретанов возможно значительное изменение картины в среднесрочной перспективе. Схема производства 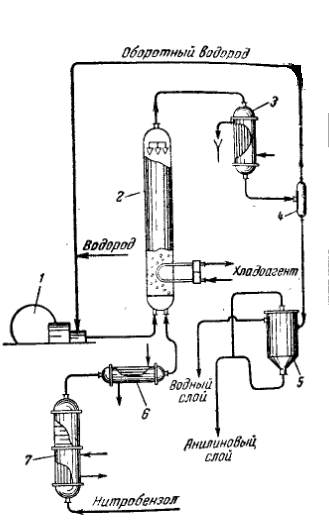 Схема восстановления нитробензола водородом: 1-компрессор; 2-реактор; 3-конденсатор; 4-сепаратор; 5-разделитель; 6-перегреватель; 7-испаритель 2. Технологическая часть 2.1. Технологическая характеристика процесса Более прогрессивным способом производства анилина является каталитическое гидрирование нитробензола молекулярным водородом. В качестве катализаторов предложены различные металлы, их окислы и сульфиды, например, смесь никеля и пятиокиси ванадия на окиси алюминия, медь на двуокиси кремния, сульфид никеля на окиси алюминия. Процесс гидрирования нитробензола осуществляют в паровой фазе в стационарном(неподвижном) и в псевдоожиженном слое катализатора. На стр.6 показана сокращенная схема получения анилина в псевдоожиженном слое катализатора (медь на двуокиси кремния).Водород(свежий и оборотный) вместе с парами нитробензола в соотношении 3:1 поступает под распределительную решетку реактора 2.Реакция гидрирования нитробензола протекает с выделением большого количества тепла (112 ккал/моль). Выделяющееся тепло отводится хладоагентом в теплообменнике из U-образных труб. Благодаря высокому коэффиценту теплопередачи от псевдоожиженного слоя катализатора к хладоагенту не требуется большой поверхности теплообмена, поэтому теплообменник можно размещать внутри реактора над распределительной решеткой. В верхней части реактора имеются пористые фильтры из нержавеющей стали для улавливания частиц катализатора, увлекаемых из реакционной зоны продуктами реакции. 2.2. Технологическая схема периодическим способом
|