Расчетнографическое задание по общей физике 1
 Скачать 4.3 Mb. Скачать 4.3 Mb.
|
Молекулярная физика и термодинамика(Специально для этого раздела см. Практикум по решению физических задач с применением компьютера. Молекулярная физика и термодинамика / Штыгашев А.А. Новосибирск: НГТУ, 2016. -64 с.) 6. Законы идеального газа 6.1. В сосуде объемом 30 л содержится идеальный газ при температуре 273 К. После того как часть газа была выпущена наружу, давление в сосуде изотермически понизилось на 0.78 атм. Найти массу выпущенного газа. Плотность данного газа при нормальных условиях 1.3 г/л. Построить график процесса. 6.2. Сосуд объемом 20 л содержит смесь водорода и гелия при температуре 293 К и давлении 2 атм. Масса смеси 5 г. Найти отношение массы водорода к массе гелия в этой смеси. Привести поясняющий рисунок и указать основные параметры. 6.3. В сосуде находится смесь 7 г азота и 11 г углекислого газа при температуре 290 К и давлении 1 атм. Найти плотность этой смеси, считая газы идеальными. Привести поясняющий рисунок и указать основные параметры. 6.4. В вертикальном закрытом сосуде с обоих торцов цилиндре находится массивный поршень, по обе стороны которого – по одному молю воздуха. При температуре 300 К отношение верхнего объема к нижнему равно 5. При какой температуре это отношение станет равным 3? Трение не учитывать. Построить график процесса. 6.5. В шаре диаметром 20 см находится воздух массой 7 г. До какой температуры можно нагреть этот шар, если максимальное давление, которое выдерживают стенки шара, равно 3 атм? Молярная масса воздуха 0.029 кг/моль. Построить график процесса. 6.6. При нагревании газа некоторой массы на один градус при постоянном давлении объем газа увеличивается на 1/300 часть его первоначального объема. Определить начальную температуру. Построить график процесса. 6.7. Сколько качаний поршневого насоса надо сделать, чтобы накачать пустую камеру футбольного мяча объемом 2.5 л до давления, превышающее атмосферное давление в 4 раза? За каждое качание насос захватывает из атмосферы воздух объемом 0.2 л. Температуру мяча считать постоянной. Построить график процесса. 6.8. В одном баллоне вместимостью 1.5 л находится газ под давлением 2 атм, а в другом – тот же газ под давлением 10 атм. Баллоны, температура которых одинакова, соединены трубкой с краном. Если открыть кран, то в обоих баллонах установилось давление 4 атм. Какова вместимость второго баллона? Построить график процесса. 6.9. Давление в цилиндре паровой машины объемом 20 л, после открывания клапана, уменьшилось на 8.1 атм. Какова масса пара, выпущенного из цилиндра? Температуру пара считать равным 100 градусов. Построить график процесса. 6.10. Найти объем смеси, состоящей из азота массой 2.8 кг и кислорода массой 3.2 кг и имеющей температуру 290 К и давление 4 атм. Привести поясняющий рисунок и указать основные параметры. 6.11. Предельно допустимая концентрация (ПДК) аммиака (NH3) в воздухе равна 10 мг/м3. Определить парциальное давление и массу аммиака в помещении объемом 100 м3 при температуре 30о, если его концентрация соответствует ПДК. Привести поясняющий рисунок и указать основные параметры. 7. Распределение Максвелла-Больцмана В те далекие времена, когда небо было синее и трава зеленее, студенты использовали логарифмические линейки и металлические арифмометры «Феликс», большую роль играли различные численные таблицы. В настоящее время человека окружают со всех сторон различные электронные вычислительные устройства, поэтому роль численных таблиц значительно уменьшилась. Очень важно научиться правильно применять вычислительные устройства в повседневной жизни, в том числе и при решении задач. Пример 7.1. Найти, при какой температуре средняя кинетическая энергия атомов гелия равна 1 эВ. Определить, какая доля атомов гелия имеет кинетическую энергию, отличающуюся от средней на 25 %. (1 эВ = 1.6×10-19 Дж) Дано: Математическая модель (см.[1]). Плотность распределения молекул по скоростям задается выражением 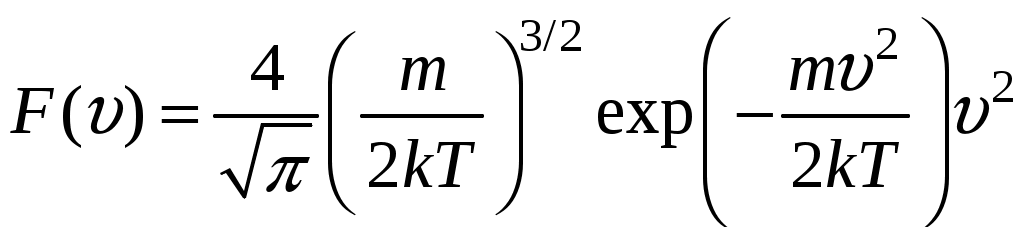 , (7.1) , (7.1)где 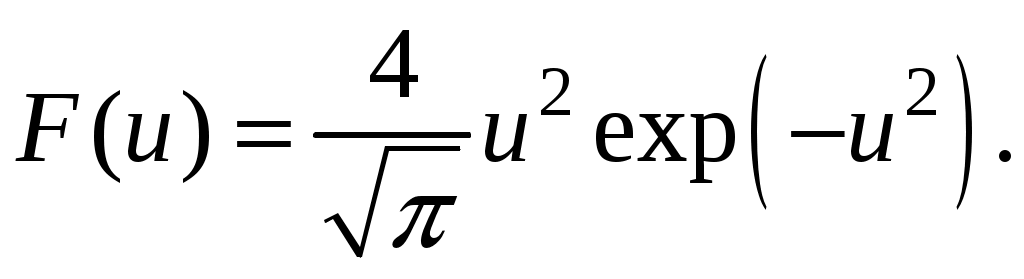 (7.2) (7.2)Решение Кинетическая энергия молекулы состоит из поступательной и вращательной энергий, суммарное значение которых равно 1 эВ. Атом гелия имеет 3 степени свободы. По закону равнораспределения на одну степень свободы молекулы приходится средняя энергия Поэтому для атомов гелия мы имеем тогда температура, при которой энергия атомов гелия равна 1 эВ будет определяться из следующей цепочки 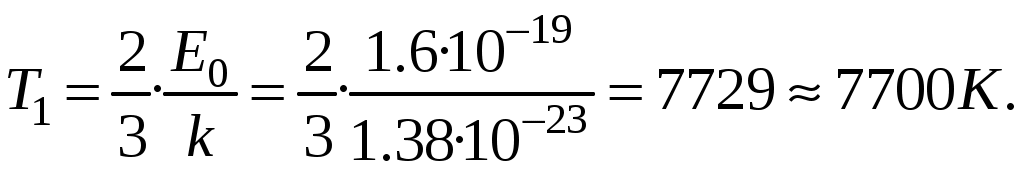 Относительная доля молекул идеального газа, чьи скорости лежат в диапазоне от Для того, чтобы найти долю частиц, у которых скорости находятся в диапазоне от 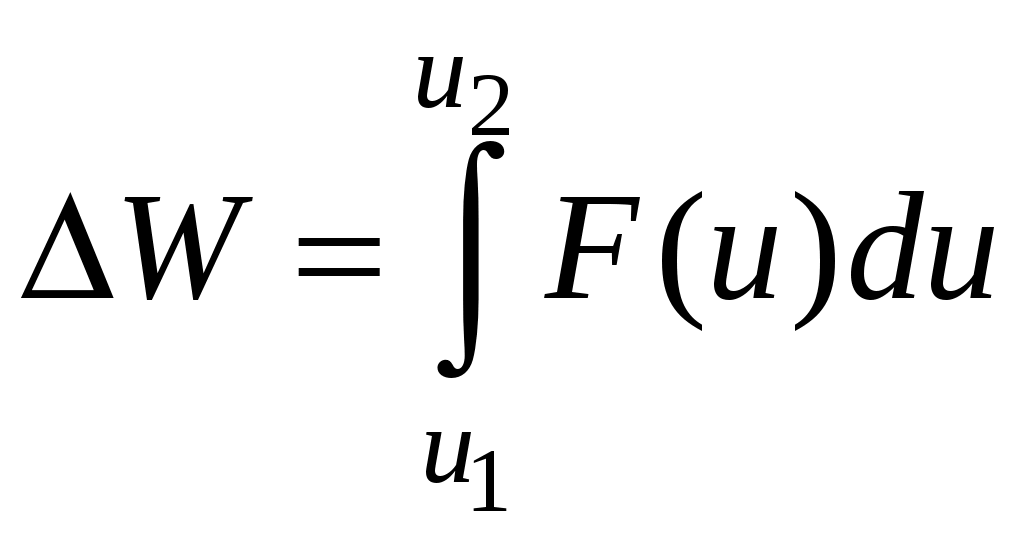 (7.5) (7.5)Вычислим скорости 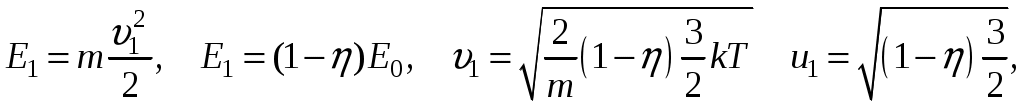 (7.6) (7.6)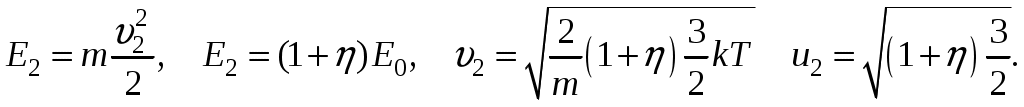 (7.7) (7.7)Итак, скорости равны 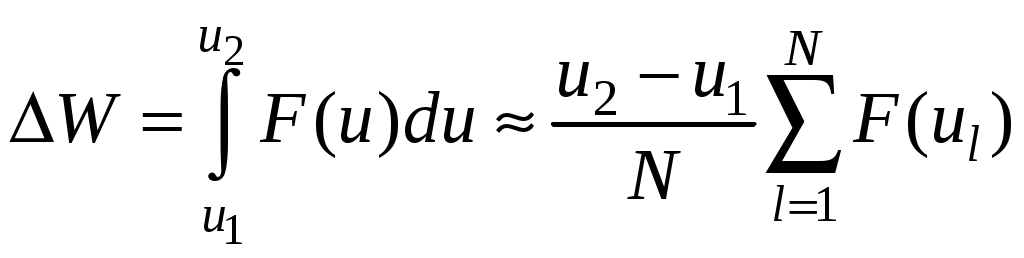 (7.8) (7.8)реализованную в виде псевдокода begin\\ q=1.6e-19;\\ k=1.38e-23;\\ E0=1*q;\\ i=3;\\ T1=2*E0/3/k\\ nu=0.25\\ u1=sqrt(1.3*(1-nu))\\ u2=sqrt(1.3*(1+nu))\\ N=500\\ du=(u2-u1)/N;\\ sums=0\\ for j=1:N\\ u=u1+j*du;\\ sums=sums+u*u*exp(-u*u);\\ end\\ DW=4*du*sums/sqrt(pi)\\ % Распределение молекул газа по скоростям v1=0\\ v2=4\\ N=100\\ dv=(v2-v1)/N;\\ sums=0\\ for j=1:N\\ u=v1+j*dv;\\ v(j)=u;\\ f(j)=4*u*u*exp(-u*u)/sqrt(pi);\\ sums=sums+f(j);\\ end\\ DW0=dv*sums\\ end\\ Выполняя расчет (8.8), получаем Построим график 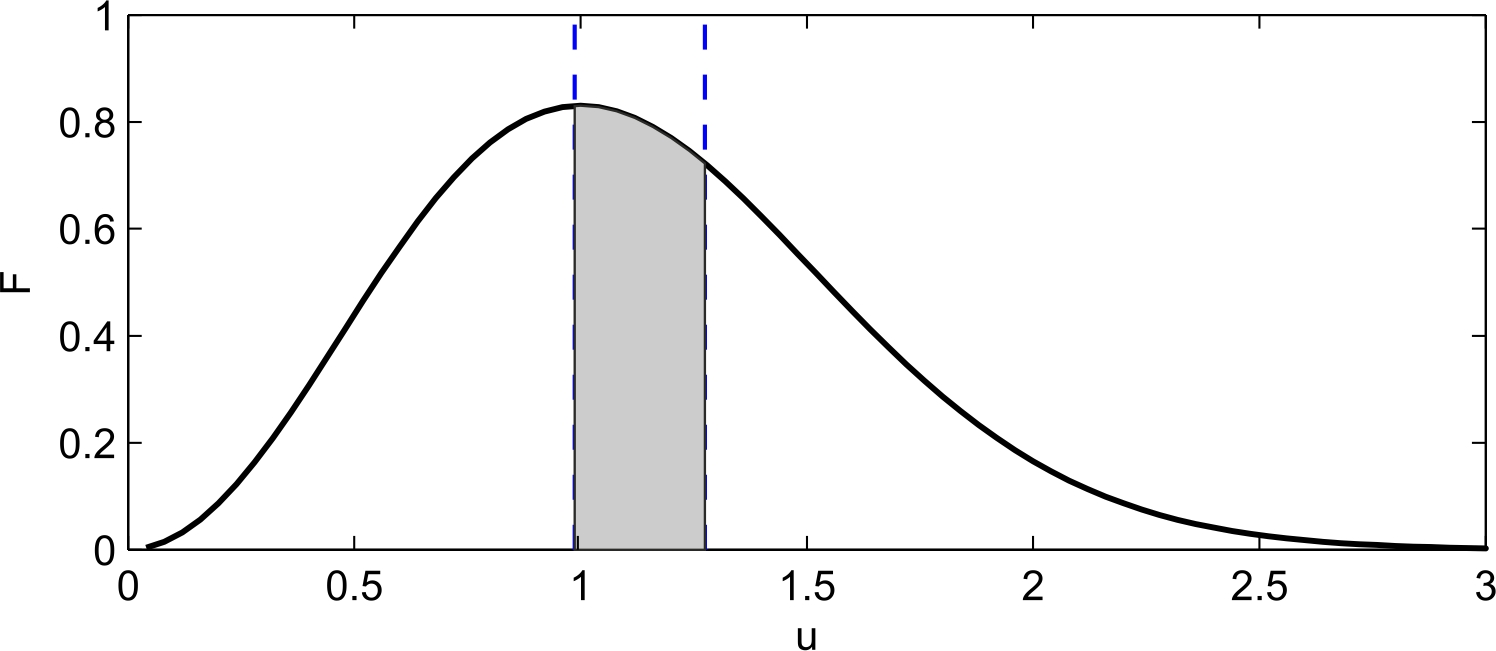 Рис.7.1.Распределение молекул газа по скоростям Анализ решения Оценивая «на глаз» заштрихованную площадь и полученное численное значение вероятности Ответ: *** 7.1. Энергию атомных и субатомных частиц часто измеряют в электрон-вольтах, 1 эВ = 1.6×10-19 Дж. Найти, при какой температуре средняя кинетическая энергия молекулы азота равна 1 эВ. Определить, при какой температуре 25% всех молекул имеют кинетическую энергию, превышающую 1 эВ. Постройте график зависимости 7.2. Азот массой 12 г находится в закрытом сосуде при температуре 300 К. Какое количество теплоты необходимо передать азоту, чтобы средняя квадратичная скорость молекул возросла в 2 раза? Привести поясняющий рисунок и указать основные параметры. 7.3. Газ, состоящий из жестких двухатомных молекул, находится при температуре 300 К. Вычислить среднюю квадратичную угловую скорость вращения молекулы, если ее момент инерции равен 2.1 10-46 кг м2. Привести поясняющий рисунок и указать основные параметры. 7.4. В вакуумном диоде электроны, эмитируемые накаленным катодом, попадают в задерживающее поле анода. До анода доходят лишь достаточно быстрые электроны. Считая, что тепловые скорости эмитируемых (вышедших из катода) электронов распределены по закону Максвелла с температурой 1150 К, определить долю электронов, преодолевающих задерживающий потенциал а) 0.2 В, б) 0.4 В. Катодом является тонкая прямолинейная нить, натянутая по оси цилиндрического анода. Привести поясняющий рисунок и указать основные параметры. 7.5. Найти отношение числа молекул водорода, скорости которых лежат в пределах от 3000 м/с до 3050 м/с, к числу молекул, имеющих скорости в пределах от 1550 м/с до 1600 м/с, если температура водорода 573 К. Постройте график зависимости 7.6. Какая часть молекул кислорода обладает скоростями, отличающимися от наивероятнейшей не больше чем на 25 м/с при температурах 273 К и 573 К? Постройте график зависимости 7.7. Определить отношение числа молекул водорода, обладающих скоростями в интервале от 2500 м/с до 2600 м/с, к числу молекул, обладающих скоростями от 1500 м/с до 1600 м/с, если температура водорода 273 К. Постройте график зависимости 7.8. Найти полное число молекул и их вес в столбе атмосферы с основанием 1 см2 , если концентрация молекул у земли n0 = 2.691019 см-3 при Т = 273 К, = 0.029 кг/моль. Привести поясняющий рисунок и указать основные параметры. 7.9. Оценить порядок величины полного числа молекул в атмосфере Земли, считая, что плотность молекул описывается барометрической формулой при постоянной температуре Т=273 К, а радиус Земли равен 6370 км. Привести поясняющий рисунок и указать основные параметры. 7  .10. (См.[3]) Дымовая труба высотой 150 м выпускает дым при температуре .10. (См.[3]) Дымовая труба высотой 150 м выпускает дым при температуре 7.11. Для определения числа Авогадро Перрен измерял распределение по высоте шарообразных частиц гуммигута, взвешенных в воде. Он нашел , что отношение количества частиц в слоях, отстоящих друг от друга на расстоянии 30 мкм, равно 2.08. Плотность частиц 1194 кг/м3, воды 1000 кг/м3. Радиусы частиц 0.212 мкм. На основании этих данных вычислите число Авогадро. Температура воды 18о С. Привести поясняющий рисунок и указать основные параметры. 7.12. Вычислить наиболее вероятную энергию молекул в идеальном газе и показать, что эта энергия не равна 8. Явления переноса Пример 8.1 Теплопроводность. Сколько теплоты протекает через окно с двойной рамой за один час, если окно имеет размеры 0.76х1.12 м? Толщина слоя воздуха между рамами 0.16 м, температура наружнего воздуха –350 С, а внутри дома 200 С. 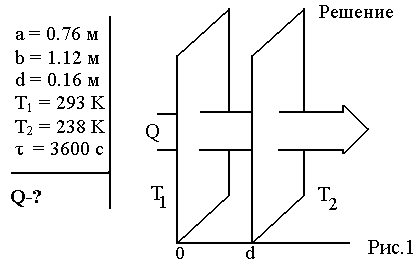 Теплопотери через окно можно вычислить на основе эмпирического закона Фурье (см., например, [7] с.86) Здесь Q - количество теплоты, переданное через окно, площадью где Теплопроводность воздуха является одной из важнейших характеристик, используемых при проектировании различных сооружений, в двигателестроении, в химической технологии и т.п., поэтому имеются обширные таблицы этой величины, измеренной при различных давлениях и температурах. Воспользуемся опытными данными, взятыми из справочника [8] (с. 345) и приведенными в Приложении. Как видно из рис.А.1 зависимость 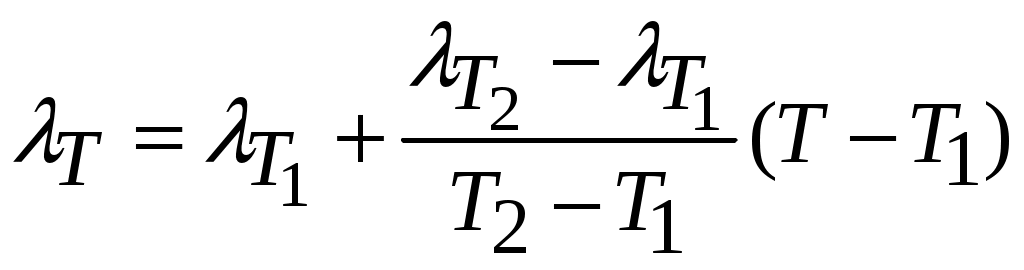 (8.3) (8.3)где значения При линейной зависимости Подставляем численные значения физических величин, получаем следующую оценку теплопотерь через окно 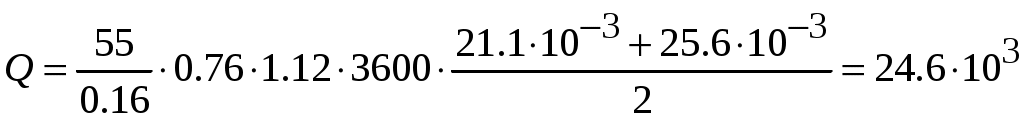 Дж Дж |
