Документ Microsoft Office Word. Распространенность
 Скачать 155.44 Kb. Скачать 155.44 Kb.
|
|
Распространенность Рак почки занимает 10 место по уровню заболеваемости среди злокачественных новообразований. За последнее десятилетие заболеваемость в России возросла на треть. Мужчины страдают данной патологией в два раза чаще, чем женщины. Несмотря на то, что заболевание преимущественно встречается у пожилых людей, участились случаи выявления заболевания у лиц молодого возраста. Опухоли почки у взрослых обнаруживают сравнительно редко, составляя 2–3% всех новообразований. Преимущественный возраст больных 55–60 лет. Мужчины болеют раком почки в 2 раза чаще. Наиболее частый вид опухолей почки – почечно-клеточный рак. Его доля в структуре злокачественных опухолей составляет примерно 3%. Опухоли почечной лоханки и мочеточника встречаются реже, составляя лишь 15% от всех опухолей почек и мочеточника. Мезенхимальные опухоли (саркомы) встречаются еще реже. Но следует отметить, что в детской онкологии опухоли почек иногда достигают 40% от всей онкологической патологии детского возраста. Гистологическая классификация Морфологическая (гистологическая) классификация рака почки предусматривает 4 варианта:
Чаще всего встречается светлоклеточный рак. В последние годы в морфологическую характеристику опухолевого процесса внесена градация злокачественности гистопатологическая градация G: GX степень дифференцировки опухоли не может быть определена G1 высокодифференциированная опухоль; G2 умереннодифферинциированная опухоль; G3 низкодифферинциированная опухоль; G4 недифференциированная опухоль. Международный противораковый комитет разработал классификацию злокачественных опухолей по системе TNM, где Т (tumor) распространение первичной опухоли, N (nodi-limphatici), поражение регионарных лимфоузлов, М (отдаленный metastasis). Категория TNM устанавливаются на основании физикальных и лучевых методов обследования. Регионарными лимфоузлами являются узлы ворот почки, абдоминальные, парааортальные и параковальные. Обязательно гистологическое подтверждение диагноза и разделение опухоли на гистологические типы. Т – первичная опухоль ТХ – первичная опухоль не может быть оценена. Т0 – нет признаков первичной опухоли Т1 – опухоль не больше 7 см в наибольшем измерении, ограниченная почкой Т1а опухоль 4 см или менее Т1b – опухоль > 4 см, но < 7 см Т2 – опухоль более 7 см, в наибольшем измерении, ограниченная почкой Т3 – опухоль распространяется в крупные вены либо инвазирует в надпочечник или окружающие ткани, но не выходит за пределы фасции Герота. Т3а – опухолевая инвазия надпочечника или паранефральной клетчатки в пределах фасции Герота Т3b – опухоль распространяется в почечную вену или в нижнюю полую вену ниже диафрагмы. Т3с – опухоль распространяется в нижнюю полую вену выше диафрагмы Т4 0 опухоль распространяется за пределы фасции Герота N – Регионарные лимфатические узлы NX – Регионарные лимфатические узлы не могут быть оценены N0 – нет метастазов в регионарных лимфатических узлах N1 – метастаз в одно регионарном лимфатическом узле N2 – метастаз более чем в одном регионарном лимфатическом узле М – отдаленные метастазы МХ – отдаленные метастазы не могут быть оценены М0 – нет отдаленных метастазов М1 – отдаленные метастазы Возможные группировки по стадиям
Предрасполагающие факторы • Курение - риск появления опухоли почки у курильщиков возрастает с 30% до 60% по сравнению с некурящим населением. После отказа от курения риск появления рака почки снижается • Ожирение - приводит к увеличению частоты заболеваемости почечно-клеточным раком на 20%. • Артериальная гипертензия • Мочегонные лекарственные препараты - ряд авторов связывают появление почечно-клеточного рака с использованием диуретических препаратов. Риск развития данной патологии у больных, получавших мочегонные средства по различным показаниям, составляет более 30%. • Сахарный диабет - в ряде исследований отмечено увеличение заболеваемости почечно-клеточным раком у больных, страдающих сахарным диабетом. Однако показатели смертности от рака почки в данной группе аналогичны таковым в популяции. Тесная взаимосвязь между сахарным диабетом, ожирением и гипертензией затрудняет оценку истинного влияния каждого из этих заболеваний на частоту развития опухолей почки. • Питание - употребление овощей и фруктов, по данным большинства авторов, способствует снижению риска развития рака почки. Влияние употребления алкоголя, кофе и чая на заболеваемость опухолями почки не доказано. Клинические проявления рака почки На ранних стадиях заболевание протекает бессимптомно. В этих случаях новообразование почки выявляют как случайную находку при ультразвуковом или компьютерном исследовании по поводу других заболеваний. В связи с эти классическая триада симптомов, описываемая у больных раком почки (боль в поясничной области, кровь в моче и пальпируемая опухоль), в настоящее время встречается редко. Первым и наиболее частым симптомом отмечается гематурия (кровь в моче). Она может появляться периодически или постоянно, при массивном кровотечении возможно формирование сгустков крови в моче. Боли в пояснице и животе возникают при прорастании или сдавлении растущей опухолью окружающих структур, а также при почечной колике, обусловленной обтурацией мочеточников сгустками крови. Острая боль может быть следствием кровоизлияния в опухоль или ее разрыва с формированием забрюшинной гематомы. Прощупываемая опухоль – третий местный симптом рака почки, бывает положительным у каждого шестого на момент установления диагноза. На поздних стадиях заболевания появляются отеки ног, варикоцеле (расширение вен семенного канатика), расширение подкожных вен живота, тромбоз глубоких вен нижних конечностей, потеря аппетита, похудание, слабость. Диагностика рака почки Важная роль в постановке диагноза принадлежит методам медицинской визуализации:
Следующим этапом диагностики является пункционная биопсия опухоли, однако ее диагностическая ценность порой ограничена. Картина крови при раке почки неспецифична: анемия, увеличенная СОЭ, повышение активности щелочной фосфатазы. Анализ мочи может выявлять эритроцитурию, лейкоцитурию, протеинурию. Хирургическое лечение рака почки Хирургический подход является единственно эффективным в лечении больных с раком почки на разных стадиях болезни. Методом выбора оперативного вмешательства является радикальная нефрэктомия (удаление почки). Суть операции состоит в том, что вместе с почкой удаляется паранефральная клетчатка (клетчатка, которая окружает почку) и надпочечник. В некоторых случаях необходимо удалять регионарные лимфатические узлы. Однако в последнее время при определенных показаниях производится органосохраняющая операция – резекция почки (удаляется только опухоль, а почка сохраняется). Локализованный и местно-распространенный рак почки: нефрэктомия или резекция? С 1995 по 2004 г. в Урологической клинике ММА им. И.М. Сеченова наблюдалось 577 больных опухолью почки. У 493 из них имелся рак одной почки. Двусторонние новообразования почек были у 41 пациента, опухоль единственной почки — у 3 и доброкачественные и злокачественные неэпителиальные новообразования, в том числе неорганные — у 40. Распределение 493 больных односторонним раком почки в зависимости от стадии рТ представлено в Таблице 1. Таблица 1. Стадия рT у больных односторонним раком почки
Улучшение методов диагностики привело к тому, что выявляемая опухоль почки на сегодняшний день зачастую небольших размеров и ограничена в пределах органа или не выходит за пределы фасции Герота. За последние 10 лет число больных раком почки, ограниченным в пределах фасции Герота (рТ1а, рТ1б, рТ2 и рТ3а), составило 93,8%. Более того, среди 21 пациента с рТ4 стадией лишь у 5 имела места инвазия в прилежащие органы и ткани, а у остальных 16 больных новообразование прорастало лишь фасцию Герота. Локализованная опухоль почки — это новообразование Т1а, Т1б и Т2 стадии. Пограничным является новообразование Т3а стадии, когда опухоль прорастает фиброзную капсулу почки и распространяется в паранефрий, но в пределах фасции Герота. Чаще прорастает в паранефрий новообразование более 4 см, однако инвазия может быть и при меньших размерах опухоли (рис. 1). 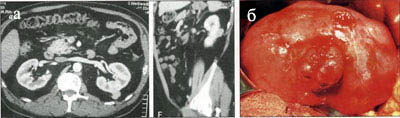 Рисунок 1. Сопоставление данных предоперационного обследования и инраоперационной ситуации у больного с маленьким новообразованием Т3а стадии. а — МСКТ. Маленькая опухоль располагается по задней поверхности средней части левой почки, с инвазией в паранефрий; б — почка выделена из паранефрия и максимально вывихнута в рану. Опухоль по задней поверхности средней части почки с прорастанием фиброзной капсулы органа (Т3а стадия) Дифференциальная диагностика на дооперационном этапе крайне сложна, так как ни один даже самый современный метод, включая мультиспиральную компьютерную томографию (МСКТ) и магнитно-резонансную томографию (МРТ), не позволяет визуализировать фиброзную капсулу почки. О ее состоянии можно косвенно судить по данным МРТ на Т2-ВИ (рис. 2), когда подавляется сигнал от жира. Рисунок 2. Нарушение наружного контура новообразования верхнего сегмента левой почки свидетельствует об инвазии опухоли в паранефрий Среди 493 больных раком почки, оперированных в нашей клинике за последние 10 лет, было 346 (70,2%) пациентов с локализованным новообразованием (Т1а-2 стадия) и 117 (23,7%) — с местно-распространенным (Т3а стадия). Сравним эти две группы больных (см. табл. 2). Таблица 2. Сравнение локализованного и местно-распространенного рака почки 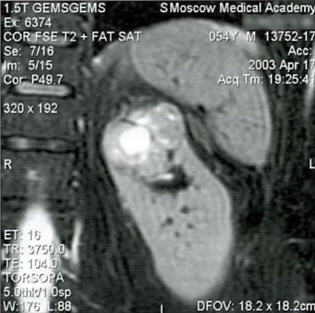
Таким образом, при локализованном новообразовании пациенты более молодого возраста чаще выявляются случайно при профилактическом УЗИ, при этом у них меньше размеры новообразования и более часто высокая степень дифференцировки раковых клеток по сравнению с местно-распространенной опухолью. Наибольшие изменения тактика лечения претерпела при раке почки, ограниченном пределами фиброзной капсулы. У этой группы пациентов пересмотрено положение об облигатности радикальной нефрэктомии. Новые методы диагностики, включая МСКТ и МРТ, позволили почти полностью отказаться от ангиографии и экскреторной урографии у этих пациентов при планировании органосохраняющей операции. Обсуждение тактики лечения особенно актуально для данной группы пациентов, у которых приходится делать выбор: нефрэктомия или резекция? Выбор органосохраняющего или органоуносящего оперативного пособия является тактической задачей при раке почки, ограниченном паранефральной клетчаткой, когда нет метастатического распространения опухоли, т.е. при стадиях Т1—3аN0М0. При Т2 стадии опухоль также ограничена фиброзной капсулой почки, но ее размеры превышают 7 см, т.е. новообразование замещает большую часть почки и выполнение органосохраняющей операции невозможно по техническим причинам. Число больных раком почки Т2 стадии, которым выполнена резекция почки, было крайне незначительным, в связи с чем они исключены из анализа. Обсуждение правильности выбора лечебной тактики на основании анализа отдаленных результатов актуально для больных раком почки стадии Т1аN0М0, Т1бN0М0 и Т3аN0М0. Как известно, стадия Т1а отличается от Т1б только размерами новообразования (до 4 см и от 4 до 7 см), а Т3а — прорастанием опухоли в паранефрий вне зависимости от размеров новообразования. При размерах опухоли более 7 см в ряде наблюдений возможно выполнение резекции почки, если опухоль распространяется преимущественно экстраренально, но для этого должны быть абсолютные показания к органосохраняющей операции. Следовательно, при размере опухоли более 7 см выбор лечебной тактики не зависит от предпочтений хирурга-уролога. При этом функция как ипси- так и контралатеральной почки должна быть сохранна или снижена незначительно, чтобы исключить влияние этих факторов на тактику лечения. Соматический статус больного, а также наличие и выраженность интеркуррентных заболеваний зачастую заставляют планировать операцию в минимальном объеме и согласовывать тактику с анестезиологом. Для объективизации выбора нефрэктомии или резекции мы исключили из анализа пациентов пожилого и старческого возраста с выраженными интеркуррентными заболеваниями. В последнее время появился термин "элективные", или избирательные показания к органосохраняющей операции, когда лечебная тактика зависит от предпочтений врача при информированном согласии пациента. Для объективизации правомочности выбора лечебной тактики необходимо сравнить отдаленные результаты в двух однородных по полу, возрасту, стадии заболевания группах больных. Врач осуществляет выбор органосохраняющей или органоуносящей операции при информированном согласии пациента в следующих случаях:
Ретроспективно из базы данных "Опухоль почки" отобрано 100 пациентов, отвечающих данным критериям. У этих больных осуществлялся выбор органосохраняющей или органоуносящей операции, так как имелись элективные показания к органосохраняющей операции. В Урологической клинике ММА им. И.М. Сеченова начиная с 1974 г. выполняются органосохраняющие операции при раке почки. К 1999 г. выполнено 52 резекции почки по избирательным показаниям. Судьба 2 пациентов неизвестна, и они исключены из анализа. Таким образом, у 50 больных выполнена резекция почки, а у остальных 50 пациентов — нефрэктомия. Традиционно мы стремимся сохранить пораженную опухолью почку, что, однако, не всегда технически возможно из-за локализации новообразования и направления его роста, поэтому больных, которым по элективным показаниям выполнена нефрэктомия, намного больше, чем пациентов, которым осуществлена органосохраняющая операция. Однородность по перечисленным критериям двух групп больных раком почки, подвергнутых органосохраняющей и органоуносящей операции, статистически достоверна (р<0,005) Среди 100 отобранных пациентов имелись больные как с Т1а, Т1б, так и с Т3а стадией рака почки. До операции можно составить ориентировочное представление о стадии, так как при распространении новообразования за контур почки определяли стадию Т3а, но зачастую речь идет лишь об оттеснении фиброзной капсулы без прорастания в нее опухоли. Ни один метод дооперационной диагностики не позволяет до удаления новообразования дифференцировать Т1 и Т3 стадию, которая окончательно устанавливается после морфологического исследования экстраренальной части опухоли с фиброзной капсулой почки и прилежащим паранефрием. Отметим лишь, что среди отобранных 100 пациентов морфологически подтвержденное прорастание опухоли в фиброзную капсулу почки было лишь у 25 (11 выполнена резекция почки и 14 — нефрэктомия). Для обобщенной числовой характеристики изучаемого признака у совокупности обследуемых пациентов рассчитывали средние величины (средняя арифметическая). У частотных параметров вычисляли также ошибку репрезентативности (m). Данные, полученные при обследовании больных, были сведены в корреляционную матрицу. Выживаемость пациентов, летальность, случаи рецидивирования рака, сроки появления отдаленных метастазов, а также осложнения и причины смерти в послеоперационном периоде оценивали на основе логранговой модели Каплана — Мейера, а также путем прямого наблюдения. Влияние различных клинических и патоморфологических параметров на результаты лечения оценивали при помощи регрессии Кокса (так называемой модели пропорционального риска), а также методом множественной регрессии. Указанные расчеты дескриптивных и корреляционных параметров производили как для всего массива данных, так и после распределения его на группы, а затем и на подгруппы. Отдаленные результаты оперативного лечения фиксировались по окончании планового контрольного обследования, которое в послеоперационном периоде проводили в следующие сроки: в течение 3 лет после операции — каждые 4 мес, в течение последующих 2 лет — 1 раз в полгода, затем ежегодно в течение всей жизни. Регистрировались наблюдаемые (без учета конкретных причин смерти) и скорректированные данные выживаемости и летальности вследствие прогрессирования рака. 5-летняя скорректированная выживаемость всей группы больных составила 88%. При анализе 5-летней скорректированной выживаемости в зависимости от вида операции установлено, что для пациентов, перенесших нефрэктомию, она составила 85%, а для больных, подвергнутых резекции почки, — 92%. Сравнение наблюдаемой и скорректированной выживаемости больных в зависимости от вида операции представлено на рис. 3 и 4. 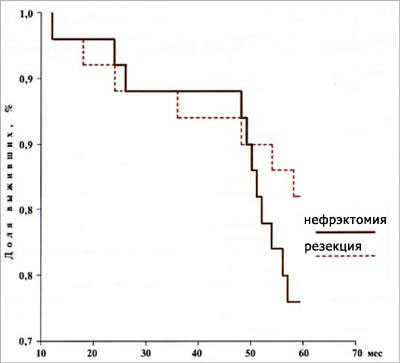 Рисунок 3. Выживаемость больных раком почки в зависимости от вида операции 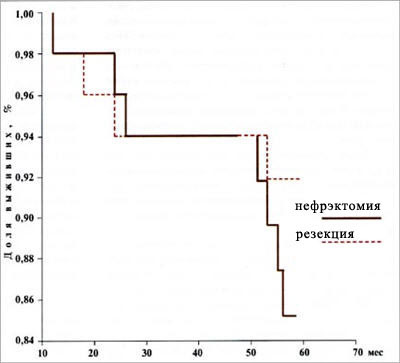 Рисунок 4. Скорректированная выживаемость больных раком почки в зависимости от вида операции Таблица 3. 5-летняя скорректированная выживаемость (%) по стадии в зависимости от вида операции
Итак, результаты резекции почки лучше таковых нефрэктомии при рТ1а стадии и статистически достоверно не отличаются при рТ1б стадии. При рТ3а стадии результаты резекции почки, напротив, хуже, чем результаты нефрэктомии. Прорастать в паранефральную клетчатку может как небольшое (< 4 см) новообразование, так и опухоль большего размера. В связи с этим определяли отдаленные результаты при рТ3а стадии и размерах новообразования < 4 см и от 4 до 7 см (табл. 4) Таблица 4. 5-летняя выживаемость (%) больных раком почки рТ3а стадии в зависимости от размеров новообразования и вида операции
Таким образом, отдаленные результаты при рТ3а стадии зависят от размеров новообразования. При опухоли < 4 см результаты резекции почки лучше, чем результаты нефрэктомии и, напротив, при новообразовании > 4 см целесообразнее органоуносящее пособие. Отдаленные результаты лечения больных раком почки рТ1а, рТ1б и рТ3а стадии при размерах опухоли < 4 см свидетельствуют о том, что более эффективны органосохраняющие операции, так как они имеют лучшие показатели скорректированной 5-летней выживаемости. При раке почки рТ3а стадии при размерах новообразования > 4 см предпочтительнее радикальная нефрэктомия. Мы согласны с мнением Н.А. Лопаткина и соавт., что "при технической возможности, достаточной функциональной значимости оставшейся части паренхимы и эффективной чашечно-лоханочной системы целесообразно выполнение резекции почки даже при интактной контралатеральной почке. Данное вмешательство является не менее радикальным, чем нефрэктомия". В настоящее время выбор лечебной тактики в подавляющем числе наблюдений осуществляется на основании из данных УЗИ и МСКТ, которые не позволяют достоверно дифференцировать Т1 и Т3а стадию. В то же время дифференциальная диагностика Т1 и Т3а стадии важна при размерах новообразования > 4 см. Применение этих двух методов для выбора нефрэктомии или резекции почки правомочно, так как они позволяют установить, возможна ли резекция почки в пределах здоровых тканей. Такая возможность определяется исходя из характеристик опухолевого процесса. Считаем, что после выявления объемного новообразования почки при УЗИ целесообразно выполнение МСКТ почек с контрастированием и трехмерной реконструкцией почечных сосудов и чашечно-лоханочной системы (при наличии технической возможности). В подавляющем большинстве наблюдений получаемой информации достаточно для определения лечебной тактики. Томографические методики дают представление о характеристиках опухолевого процесса и позволяют выбрать тактику лечения. Производится сравнение и дополнение данных УЗИ результатами томографии. Какова же точность используемых методов характеристики опухолевого процесса? Чтобы ответить на этот вопрос, мы оценили истинно-положительные и истинно-отрицательные результаты исследований. Точность УЗИ определена у 300 больных опухолью почки, МСКТ — у 250 и МРТ — у 90 (табл. 5). Таблица 5. Точность (%) УЗИ, МСКТ и МРТ при характеристике опухолевого процесса
Можно отметить, что несмотря на широкое внедрение современных методов исследования, включая МСКТ и МРТ, имеются наблюдения (5—8%), когда характеристики опухолевого процесса по данным томографической методики были определены неточно. Полученные данные свидетельствуют о том, что информативность МСКТ и МРТ в отношении характеристик опухолевого процесса примерно одинакова (95%) и выше, чем УЗИ (89%). В то же время у ряда больных возможность осуществления органосохраняющей операции в пределах здоровых тканей окончательно может быть определена только интраоперационно. Мы считаем, что онкологическая операция должна быть радикальной, а лимфаденэктомия — обязательный компонент операции по поводу рака почки, какой бы характер (органосохраняющий или органоуносящий) она не носила. Из 493 больных раком почки, оперированных в нашей клинике за последние 10 лет, у 49 (10%) выявлены лимфогенные метастазы. Лишь у 19 (38%) больных до операции были данные о том, что лимфатические узлы увеличены и что данную клиническую ситуацию следует рассматривать, как распространенный рак почки. Таким образом, до операции у 474 больных раком почки лимфатические узлы не были увеличены. Поясним, почему мы считаем лимфаденэктомию обязательной при неизмененных лимфатических узлах: • метастатическое поражение регионарных лимфатических узлов выявлено у 30 (6,3%) из 474 больных раком почки, которые оперированы при неизмененных лимфатических узлах: • что у 30 (61,2%) из 49 больных лимфогенные метастазы были микроскопическими, свидетельствует о целесообразности лимфаденэктомии даже при внешне нормальных лимфатических узлах; • удаление воротных и превазальных (преаортных или прекавальных в зависимости от стороны поражения) лимфатических узлов в ходе мобилизации магистральных сосудов почки обеспечивает надежный контроль почечных сосудов, что делает оперативное пособие более безопасным; • ни один из методов дооперационного обследования, в том числе УЗИ, МСКТ и МРТ, не позволяет исключить поражение лимфатических узлов микрометастазами; • лимфаденэктомия не увеличивает количество осложнений, а также послеоперационную летальность; • удаление возможных лимфогенных метастазов (в том числе микроскопических) значительно уменьшает вероятность возникновения регионарного рецидива. Вероятность наличия микрометастазов во внешне неизмененных лимфатических узлах — один из основных аргументов в пользу лимфаденэктомии. Таким образом, можно сделать следующие выводы: 1. При рТ1а, рТ1б и рТ3а стадии и размерах новообразования < 4 см резекция почки является не менее радикальной операцией, чем нефрэктомия. 2. При рТ3а стадии и размерах новообразования > 4 см целесообразнее проведение нефрэктомии. 3. Окончательно возможность осуществления органосохраняющей операции в некоторых наблюдениях может быть установлена только интраоперационно после проведения УЗИ. 4. Планирование органоуносящей или органосохраняющей операции при локализованном или местно-распространенном раке почки базируется на анализе размеров, локализации, стадии процесса. Даже при кажущейся большой возможности для выполнения резекции почки интраоперационно могут возникнуть такие ситуации, при которых потребуется нефрэктомия. Поэтому "информированное" согласие пациента означает его осведомленность о возможных вариантах как самой операции, так и прогноза. 5. При локализованном и местно-распространенном раке почки, какой бы характер не носила операция (органосохраняющий или органоуносящий), целесообразно осуществление систематической лимфаденэктомии. Органосохраняющее хирургическое лечение при раке почки С совершенствованием методов диагностики рака почки появилась возможность проводить органсохраняющие операции у многих пациентов с этой патологией. Ранее эта методика применялась только при двухстороннем опухолевом процессе, единственной почке. Со временем показания к резекции почки были расширены: операция выполняется при наличии сопутствующей патологии противоположной почки, такой как мочекаменная болезнь, хронический пиелонефрит, нефросклероз. В последние годы показания к органосохраняющему лечению еще более расширились в связи с выявляемостью опухолей почки на ранних стадиях, когда их размеры не превышают 4 см. Многочисленные результаты исследований, сравнивающие резекцию почки и нефрэктомию при малых опухолях, говорят об одинаковой эффективности этих операций. Наиболее оптимальным доступом для органосохраняющего лечения новобразования почки является лапароскопический, при котором за счет улучшения визуализации операционного поля возможно практически бескровно удалить опухоль. Малая травматизация тканей, небольшая кровопотеря позволяют рано активизировать оперированных. Значительно сокращается срок пребывания в стационаре до 4-6 дней и срок реабилитации. Таким образом, современным лечением рака почки являются лапароскопическая резекция новообразования почки или лапароскопическая радикальная нефрэктомия, которые являются высокоэффективными и в тоже время малоинвазивными, щадящими операциями для пациентов. Лечение Основной метод лечения рака почки – хирургический. Даже при наличии метастазов стараются идти на операцию, т.к. это вполне существенно продлевает жизнь пациента. Одиночные метастазы не являются противопоказанием к операции. На ранних стадиях по возможности проводят органосохраняющие операции, в особенности сохраняющие надпочечник. Обязательным условием оперативного лечения является извлечение опухолевых тромбов из почечной вены и нижней полой вены (их диагностика проводится с помощью УЗИ или компьютерной томографии), а также удаление регионарных лимфатических узлов в которые было возможно метастазирование. Лучевая терапия, химиотерапия и гормонотерапия проводятся редко, в основном как методы паллиативного лечения, т.к. их эффективность в большинстве случаев невысока. Иммунотерапия опухолей с помощью альфа-интерферона, интерлейкина-2, 5-фторурацила примерно в половине случаев дает положительный результат, а у 15% пациентов повышает сроки выживаемости. Прогноз заболевания зависит от стадии опухолевого процесса и степени дифференцировки опухолевых клеток. Плохой прогноз у пациентов при прорастании метастазов в почечную вену. Профилактика Поскольку факторы, предрасполагающие к возникновению злокачественных опухолей почек у взрослых изучены недостаточно и достоверно не установлены, старайтесь вести здоровый образ жизни, исключите вредные привычки, своевременно лечите любые заболевания и заболевания почек в первую очередь. Для раннего выявления желательно возможно более частое ультразвуковое исследование почек практически здоровым людям, поскольку появление симптомов (боли, кровь в моче) свидетельствует чаще всего о неранней стадии заболевания. Обязательно обследуйтесь у уролога и пройдите ультразвуковое исследование если вас начали беспокоить боли в пояснице или вы заметили изменение цвета мочи. Лучевая терапия Несмотря на то, что рак почки резистентен к лучевому воздействию при костных метастазах лучевая терапия (ЛТ) используется с паллиативной целью: для уменьшения болей и предотвращения дальнейшей прогрессии, таким образом улучшая качество жизни. Большинство радиологов не рекомендует применять обычный режим фракционирования (2Гр). Предпочтительнее использование таких режимов как 10 x 3 Гр в течении 2 недель или 5 x 4 Гр в течении 1 недели. Анальгезирующий эффект ЛТ при дозе от 30 до 40 Гр достигается у 80% больных. ЛТ при раке почки применяется не только для уменьшения болевого синдрома, но и для стабилизации и предотвращения патологических переломов, основой чего является реминерализация костной ткани. В основе паллиативного анальгезирующего эффекта ЛТ и рекальцификации лежат разные механизмы. Для достижения рекальцификации показано использование более длительных курсов с более мелким фракционированием и высокими дозами. Spiro & Springfield (2000) при солитарных метастазах и невозможности оперативного лечения предлагают проводить лучевую терапию в дозе 60-66 Гр и разовой дозой 2 Гр 5 дней в неделю. Другие режимы включают дозу 50Гр в 20 фракциях и 39 Гр в 13 фракциях. Выбор схемы зависит от ожидаемой продолжительности жизни пациента и локализации поражения. Список литературы:
СПБ изд. «Эскулап» 1998 год.
Локализованный и местно-распространенный рак почки: нефрэктомия или резекция? Ю.Г. Аляев, А.А. Крапивин, Урологическая клиника ММА им. И.М. Сеченова
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
