демиелинизирующие заболевания. Рассеянный склероз Рассеянный склероз
 Скачать 146.59 Kb. Скачать 146.59 Kb.
|
|
Рассеянный склероз Рассеянный склероз (РС) - хроническое заболевание головного и спинного мозга, характеризующееся развитием рассеянных во времени и пространстве очагов демиелинизации и проявляющееся рассеянной неврологической симптоматикой. Этиология и патогенез. Рассеянный склероз считается полиэтиологичным заболеванием. Предложено несколько теорий, объясняющих происхождение РС: • вирусная инфекция (прямое повреждение олигодендроглии ретровирусами, вирусом простого герпеса 6 типа); • бактерии (наличие перекрестных антигенов); • дефект функции олигодендроглии; • особенности диеты (изменение мембранного состава, функции макрофагов, гиперпродукция простагландинов); • генетическая предрасположенность к иммунным реакциям против антигенов мозга. Многие исследователи предполагали инфекционное происхождение РС. В этой связи изучались все известные микроорганизмы, включая простейшие, спирохеты, риккетсии, бактерии, вирусы и прионы. Наиболее убедительными являются данные о возможном участии вирусов в патогенезе РС. К вирусам, вероятно, вызывающим или провоцирующим РС, относят: парамиксовирусы (корь, собачья чума), герпес-вирусы (1, 2 и 6 типов, а также цитомегаловирус), коронавирусы, ретровирусы, аденовирусы. Особое значение в этиопатогенезе РС придают вирусу кори, поскольку в сыворотке большинства больных РС выявляют повышение антител к этому вирусу; также известно, что он индуцирует демиелинизирующие заболевания. В основе патогенеза РС лежат аутоиммунные реакции, преимущественно клеточно-опосредованные, которые приводят к развитию хронического воспалительного процесса в ЦНС, сопровождающегося разрушением миелина (демиелинизацией). Патоморфология. Многочисленные склеротические бляшки обнаруживаются по всему головному и спинному мозгу, преимущественно в белом веществе. Наиболее часто бляшки расположены в перивентрикулярной области, боковых и задних канатиках шейного и грудного отделов спинного мозга, мозжечке и стволе мозга. Серое вещество поражается в меньшей степени. Склеротические бляшки имеют разный возраст в отличие от монофазного повреждения при постинфекционном и поствакцинальном энцефаломиелите; они распространяются от посткапиллярных венул. Кроме демиелинизации, имеется умеренное повреждение аксонов, приводящее к атрофии. Когда интенсивность иммунных реакций стихает, натриевые каналы перераспределяются вдоль аксона и происходит частичная ремиелинизация. При этом возникает «теневая склеротическая бляшка» с резкой демиелинизацией в центре и меньшей - по краям. Старая, неактивная бляшка сероватого цвета, плотная на ощупь, характеризуется реактивной пролиферацией астроцитов, уменьшением олигодендроцитов. В некоторых случаях по краям старой бляшки могут наблюдаться новые зоны отека и периваскулярной инфильтрации, что указывает на возможность роста старых очагов. Клиническая картина отражает особенности многоочагового деми- елинизирующего процесса. В типичных случаях при ремиттирующем РС симптоматика постепенно развивается в течение нескольких дней, стабилизируется, а затем подвергается полному или частичному регрессу в течение нескольких недель. В большинстве случае заболевание проявляется различными сочетаниями симптомов поражения двигательных и чувствительных проводящих путей, мозжечка, черепных нервов, нарушений функций тазовых органов, аффективных и когнитивных расстройств. Наиболее частая жалоба - повышенная утомляемость (синдром «хронической усталости»). Обычно она провоцируется физической нагрузкой. Температура тела при этом несколько повышается. Эта чрезвычайная чувствительность к перегреванию (феномен Ухтоффа) отражает непрочность демиелинизированных аксонов. К типичным жалобам относится изменение походки. Поражения пирамидного пути. В зависимости от локализаций бляшек на протяжении аксонов пирамидного пути могут наблюдаться гемипарезы и парапарезы, реже монопарезы. Может отмечаться синдром БроунСекара (половинное поражение спинного мозга). Характерен нижний парапарез, развивающийся вследствие расположения склеротических бляшек в боковых столбах спинного мозга. Мышечный тонус повышен по спастическому типу, больше в ногах. Спастичность возрастает при наполнении мочевого пузыря или на холоде. Характерно изменение степени пареза в течение дня: некоторые больные отмечают усиление слабости мышц к вечеру, другие - утром. Сухожильные и периостальные рефлексы асимметрично повышены, выражены патологические стопные рефлексы. Рефлексогенные зоны резко расширены, выявляются клонусы стоп и коленных чашечек. Снижение брюшных рефлексов, особенно асимметричное, является ранним симптомом поражения пирамидного пути. Иногда пирамидные симптомы сочетаются с периферическим парезом. Например, в острейшем периоде образования массивных очагов наблюдается снижение сухожильных рефлексов на стороне пареза, что связано с сочетанным поражением корешка. При длительном тяжелом течении заболевания развиваются сгибательные контрактуры и атрофии мышц от бездействия; тогда сухожильные рефлексы также снижены. Нарушение чувствительности. Жалобы пациентов эмоциональны и разнообразны: покалывание, снижение чувствительности, гиперестезия, «скрепки и иглы», «чувство мертвой кожи», «лед внутри ноги», «положение на разбитом стекле», «что-то не так» и т.д. Типичны парестезии в руке или ноге, дальнейшее их распространение и через несколько дней наличие во всем теле с постепенным исчезновением в течение нескольких недель. С головной боли часто начинается обострение процесса. При сгибании шеи у больных РС возникает чувство про- хождения электрического тока вдоль спины или в конечностях (симптом Лермитта). Хроническая корешковая боль в спине возникает из-за гемипареза или спазма, вынужденного положения и дегенеративных изменений в диске. Она усиливается ночью и при жаркой погоде. При неврологическом осмотре выявляется нарушение глубокой чувствительности в конечностях, снижение болевой и тактильной чувствительности в дистальных отделах конечностей, болевая гипере- стезия и гиперпатия. При локализации очагов в области ствола развиваются симптомы поражения черепных нервов, чаще всего глазодвигательного, отводящего, лицевого и тройничного, а также заднего продольного пучка. Характерно поражение и зрительного нерва. Нарушения зрения при РС вариабельны. Оптический (ретробульбарный) неврит часто является первым симптомом РС. Его диагностируют при остром или подостром снижении остроты зрения одного глаза, сопровождающемся болезненностью при движении глазных яблок. Длительность нарушений составляет не менее 24 ч, в дальнейшем происходит полное или частичное восстановление зрения. Возможно развитие повторных ретробульбарных невритов. Потере зрения обычно предшествует боль внутри или позади глаза, возникающая в покое, при движении глазных яблок и при давлении на них. Может возникать центральная скотома в виде «слепого» пятна. Нарушаются цветовое восприятие и контрастность. Зрение начинает восстанавливаться через 2 нед от начала неврита, а полное восстановление возможно не ранее чем через несколько месяцев. Другие зрительные нарушения («пятна», преобладание серых оттенков и нарушения цветовосприятия - побледнение красного и синего цветов) сохраняются дольше. Яркие огни вызывают длительное «послесвечение», «полет цветов». Нарушение восприятия глубины объектов ухудшается при их перемещении. Повышенная температура тела провоцирует снижение остроты зрения (феномен Ухтоффа). При впервые возникшем оптическом неврите в первые недели на глазном дне изменений, как правило, не отмечается. Картина глазного дна зависит от: 1) локализации процесса в зрительном нерве; 2) интенсивности воспалительных изменений; 3) давности процесса. Диски зрительных нервов могут быть не изме- нены, но в ряде случаев отмечаются гиперемия и стушеванность их границ (при локализации процесса вблизи глазного яблока). Уже в острой фазе может развиваться нисходящая частичная атрофия дисков зрительного нерва: побледнение височных половин диска, сужение артерий, дистрофические изменения в макуле. При распространенном процессе бледнеет весь диск. Иногда отмечаются изменения сетчатки в виде периферического увеита и воспаления перивенозной оболочки. При РС выявляют различные изменения на глазном дне. Для объективизации применяют зрительные вызванные потенциалы, компьютерную периметрию и хронопериметрию. Большую помощь в диагностике оптических невритов оказывает МРТ. При оптическом неврите МРТ в 40-70% случаев выявляет очаги демиелинизации в других отделах мозга. Глазодвигательные нарушения. Тотальная офтальмоплегия - ограничение движений глазного яблока на стороне пораженного заднего продольного пучка. У молодых людей она почти патогномонична для рассеянного склероза. Двусторонняя невралгия тройничного нерва - патогномоничный симптом рассеянного склероза. Невралгия тройничного нерва является следствием появления бляшки в ядре V черепного нерва или в зоне входа волокон нерва. Периферический парез мышц лица и косоглазие возникают при сочетанном повреждении VII и VI нервов соответственно. Нарушения слуха возникают редко. Головокружение иногда столь выражено, что больные не могут встать с постели. Выявляется нистагм, обычно асимметричный, с ротаторным компонентом. Мозжечок или его связи повреждаются у 50% пациентов с рассеянным склерозом. Классическая триада Шарко при поражении мозжечка включает нистагм, скандированную речь и интенционный тремор. При поражении путей мозжечка нарушаются походка и равновесие, наблюдаются дисметрия, гиперметрия, асинергия, интенционное дрожание, мимопопадание при выполнении координаторных проб, мегалография. В тяжелых случаях может появиться дрожание рук, головы и туловища, которое иногда наблюдается и в покое. Тремор обусловлен очагами в стволе мозга в области путей от мозжечка к красным ядрам и таламусу. Для РС характерно резкое нарастание атаксии вплоть до невозможности ходить, мозжечковой гипотонии. Расстройства функции тазовьх органов - частое проявление РС. В ранних стадиях больные отмечают императивные позывы или задержку мочеиспускания, запор. По мере прогрессирования возможно развитие недержания мочи и кала. У большинства больных развивается импотенция, которая обусловлена не только спинальными механизмами, но и психосоциальными факторами. Аффективные нарушения представлены депрессией, маниакально-депрессивным синдромом. Внешняя эйфория, или «настроение веселого самодовольства», может появляться на фоне внутренней депрессии при осознании своей болезни. Пациенты с РС эмоционально лабильны, раздражительны, апатичны, но некоторые личностные реакции остаются неизмененными. Поведение меняется при новых атаках заболевания, стойкие изменения сохраняются при хроническом прогрессирующем течении. Когнитивные функции. Деменция при РС развивается редко (5% случаев). Однако нейропсихологические тесты выявляют те или иные нарушения у 34-65% больных: страдают абстрактное мышление, кратковременная память и внимание. Типично для РС ухудшение симптоматики при повышении температуры тела (например, после приема горячей ванны, питья горячего чая). Эпилептические приступы при РС бывают редко (2-3% случаев). Экстрапирамидные нарушения (ригидность, хорея, атетоз) непродолжительны. Стволовые и мозжечковые симптомы более характерны в детском возрасте. Классификация. Выделяют 4 варианта течения РС. Ремиттирующее течение характеризуется обострениями, сменяющимися ремиссиями с полным исчезновением симптоматики. В периодах между обострениями заболевание не прогрессирует. Длительность течения широко варьирует, но в среднем составляет 10-15 лет. Обострение (острая атака, экзацербация) - это появление нового симптома или симптомов, а также отчетливое ухудшение уже имевшихся ранее у больного симптомов после того, как неврологическое состояние его было стабильным или улучшалось на протяжении не менее 1 месяца. Первично-прогрессирующее течение характеризуется постоянным прогрессированием без четко очерченных обострений, возможна временная стабилизация симптоматики. Вторично-прогрессирующее течение обычно сменяет ремиттирующее течение, характеризуется нарастающей необратимой инвалидизацией. Дополнительно выделяют доброкачественный и злокачественный РС. При доброкачественном РС не наблюдается нарастания симптоматики, а имеет место лишь минимальный неврологический дефицит на протяжении многих лет. При злокачественном РС заболевание характеризуется быстрым прогрессированием, приводящим к значительной инвалидизации или к смерти через относительно короткий период времени. Обычно пациенты умирают в течение года от начала заболевания. Диагноз РС устанавливается на основании характерных клинических симптомов, диссеминированных во времени и пространстве. Выделяют триаду Шарко и пентаду Марбурга, при которой отсут- ствуют брюшные рефлексы, имеются тазовые нарушения, характерно побледнение височных половин диска зрительного нерва. Типичные изменения при МРТ головного мозга выявляют у 90% пациентов, а при МРТ спинного мозга - у 70%. В типичных случаях при МРТ в режиме Т2 выявляют очаги повышенной интенсивности овальной формы в перивентрикулярной области, мозолистом теле, реже - в белом веществе полушарий, стволе и мозжечке. Свежие очаги хорошо усиливает контрастирование. Типичные МР-признаки склеротических бляшек в спинном мозге: располагаются на уровне 1-2 сегментов, диаметром не менее 3 мм, чаще в области задних и боковых столбов, без отечности спинного мозга. Необходимо помнить, что типичный паттерн многоочагового поражения белого вещества с участками гиперинтенсивного сиг- нала на Т2-взвешенных изображениях не является специфичным; у некоторых больных на МРТ не выявляется изменений. Согласно современным представлениям, нормальная МРТ-картина головного мозга не противоречит диагнозу РС, хотя и наблюдается редко. ЗВП позволяют подтвердить наличие субклинического поражения зрительных нервов. При РС выявляется увеличение латентности, но оно не патогномонично для РС. В ЦСЖ увеличена концентрация белка за счет IgG, легкий лимфоцитарный плеоцитоз (до 30-50 клеток в мм3). Характерно наличие не менее двух олигоклональных групп иммуноглобулинов. Таким образом, данные МРТ или спинномозговой пункции подтверждают диагноз и делают его достоверным более чем в 95% случа- ев, хотя на сегодня не существует какого-либо одного лабораторного теста, патогномоничного для РС. Дифференцировать РС необходимо с заболеваниями, сходными по клиническим, КТ- и МРТ-критериям, а также изменениям ЦСЖ (синдром Шегрена, узелковый периартериит, системная красная волчанка, болезнь Бехчета, нейроборрелиоз, саркоидоз, адренолейкодистрофия, острый рассеянный энцефаломиелит, зрительная атрофия Лебера). Лечение. Весь комплекс лечебных воздействий при РС подразделяют на две основные группы: средства патогенетической и симптоматической терапии. Патогенетическая терапия направлена на предупреждение деструкции ткани мозга активированными клетками иммунной системы и токсичными веществами. Симптоматическая терапия направлена на коррекцию и поддержание функций. Симптоматическая терапия может применяться в отношении многих симптомов РС. Она условно делится на две большие группы: 1) медикаментозная терапия; 2) методы физиотерапии, диета, эрготерапия, физическая и психологическая реабилитация. Среди целей симптоматической медикаментозной терапии выделяют коррекцию: - двигательных нарушений (спастичности; патологической утомляемости; координаторных нарушений); - расстройств чувствительности; - нарушений функций тазовых органов; - двигательных и чувствительных пароксизмальных синдромов; - нейропсихологических нарушений. Спастичность уменьшают баклофен, мидокалм, тизанидин (сирдалуд). Их побочными эффектами являются сухость во рту, сонли- вость, слабость. Валиум и дандролен - препараты резерва, поскольку вызывают привыкание и эффект выскальзывания. При локальной спастичности применяют препараты ботулотоксина. Усталость уменьшается у 30-50% пациентов после применения амантадина по 100 мг 2 раза в день. В некоторых случаях лучший эффект наблюдается при назначении пемолина (по 37,5 мг 3 или 4 раза в день), тербуталина (1,25 мг 2 раза в день) или метилфенидата (от 5 до 10 мг 2 или 3 раза в день). Антидепрессанты из группы СИОЗС иногда уменьшают проявления усталости. Следует избегать перегревания. Пациентам, чувствительным к высокой температуре, назначают эффективное средство от усталости - стакан ледяной воды или прохладную ванну. Эффективен массаж. Проприоцептивная чувствительность улучшается после ежемесячного применения витамина В12. Карбамазепин, диамокс или бромокриптин предотвращают парестезии. Боль при невралгии тройнич- ного нерва уменьшается при приеме габапентина, карбамазепина, фенитоина, баклофена в сочетании с амитриптилином и нестероидными противовоспалительными препаратами. Хороший эффект оказывает регулярное применение мизопростола (цитотек) по 200 мг 4 раза в день, даже в случаях, когда больной невосприимчив к другим препаратам. Обычно уменьшенный в размере, спазмированный мочевой пузырь реагирует на лечение антихолинергическими препаратами типа толтеродина по 2 мг 2 раза в день, оксибутинина по 5 мг 2 или 3 раза в день и амитриптилина по 25 мг перед сном. При этом уменьшается частота мочеиспусканий, но может наступить задержка мочи. Десмопрессин, аналог антидиуретического гормона, уменьшает ночные микции. Напряжение внешнего сфинктера иногда уменьшается с приемом баклофена. При задержке мочи важна своевременная катетеризация. Сексуальную функцию улучшают мази, вакуумные эректоры и интра- корпоральное введение простагландина. Колебания настроения и псевдобульбарные расстройства уменьшаются при использовании антидепрессантов. Зрительная память улучшается после терапии бета-интерфероном, мышление - после гормо- нальной терапии. Активное ведение больных с использованием современных возможностей лечения способствует предупреждению осложнений и более благоприятному течению заболевания. Особым вариантом аутоиммунного поражения мозжечка и его связей в детском возрасте является опсоклонус-миоклонус (энцефалопатия Кинсбурна, миоклоническая энцефалопатия у детей, синдром танцующих глаз, детская полимиоклония, острая мозжечковая энцефалопатия). Заболевание манифестирует в основном в детском возрасте - от 4 мес до 6 лет. Основной симптомокомплекс представлен выраженными изменениями поведения, нарушением координации, тремором, миоклонусом и специфическими движениями глазных яблок. Выделяют 2 формы: параинфекционную и паранеопластическую. При параинфекционной энцефалопатии Кинсбурна в основе патогенеза лежит аутоиммунная агрессия нейронов мозжечка собственны- ми антителами. Начальные симптомы появляются через 1-2 нед после вирусной инфекции или иммунизации. Длительность неврологической симптоматики при таких формах составляет от 6 до 15 дней, реже - до нескольких месяцев. Паранеопластическая форма является маркёром нейробластомы и развивается при действии на нейроны мозжечка, имеющие сходный антигенный состав Т-лимфоцитов. У небольшого числа пациентов заболевание может регрессировать спонтанно, без медикаментозной терапии, у ряда пациентов положительный эффект достигается назначением симптоматической терапии. Наиболее распространенными схемами терапии являются применение АКТГ или кортикостероидов. В последние годы доказан эффект от применения иммуноглобулина для внутривенного введения. Острые диссеминированные энцефаломиелиты характеризуются диффузным поражением нервной системы вследствие острой монофазной иммунной реакции. Выделяют псевдотуморозное течение с клиникой объемного образования задней черепной ямки, острый рассеянный энцефаломиелит с многоочаговым поражением спинного и головного мозга и панэнцефалит. Рассеянный энцефаломиелит также характеризуется постепенным началом в течение 7-9 дней. Больные отмечают упорные головные боли, повторную рвоту. Затем развиваются генерализованные клоникотонические судороги, кома или выраженные расстройства психики. Нарушаются ориентация во времени и пространстве, эмоциональноволевые и интеллектуальные функции. Двигательные расстройства характеризуются центральными парезами или гиперкинезами в мышцах лица, рук; выражены расстройства в виде опсоклонуса. Мозжечковая атаксия наблюдаются редко. Миелит проявляется нарушением мочеиспускания по центральному типу (задержка мочи) и нижним спастическим парапарезом. МРТ в остром периоде выявляет отек, сглаженность борозд и извилин большого мозга, а также понижение плотности белого вещества. Спустя 6 нед от начала заболевания на МРТ визуализируются очаги в лобных долях, мозжечке, мозолистом теле, базальных ядрах и спинном мозге. В дальнейшем у детей развивается атрофия головного мозга. Боковой амиотрофический склероз Боковой амиотрофический склероз (БАС) - нейродегенеративное заболевание, сопровождающееся гибелью центральных и периферических мотонейронов и проявляющееся атрофиями скелетных мышц, фасцикуляциями, спастичностью, гиперрефлексией и патологическими пирамидными знаками при отсутствии глазодвигательных и тазовых нарушений; характерно неуклонное прогрессирующее течение, приводящее к летальному исходу. классификация Применяют три классификации: североамериканскую, британскую и отечественную классификацию О.А. Хондкариана. По классификации Исследовательской группы по нервно-мышечным заболеваниям Всемирной федерации неврологов, БАС относят к группе болезней двигательного нейрона с неустановленными причинами. Согласно североамериканской классификации, БАС подразделяют на спорадическую, семейную и западно-тихоокеанскую формы. К спорадической форме относят классический БАС, сопровождающийся поражением центральных и периферических мотонейронов, которое характеризуется первичным поражением одного или нескольких уровней сегментарной иннервации, носит прогрессирующий характер и по мере прогрессирования генерализуется. Термином «прогрессирующий бульбарный паралич» в данной классификации обозначают редкое, не сопровождающееся генерализацией прогрессирующее поражение периферических мотонейронов, иннервирующих бульбарную мускулатуру. Терминами «прогрессирующая мышечная атрофия» и «первичный боковой склероз» обозначают ненаследственный синдром изолированного медленно прогрессирующего поражения периферического или центрального мотонейрона с дебютом на спинальном уровне соответственно. В отечественной классификации, как и в североамериканской, БАС рассматривают как единую нозологическую форму с бульбарным и спинальными дебютами (формами), а прогрессирующая мышечная атрофия и первичный боковой склероз в ней отсутствуют, так как они считаются отдельными нозологическими формами. В зависисмости от первичного уровня поражения и степени вовлечения верхних или нижних мотонейронов выделяют следующие формы: бульбарную, шейно-грудную, пояснично-крестцовую, первично-генерализованную; варианты заболевания: смешанный (классический), сегментарно-ядерный и пирамидный. этиология и патогенез В настоящее время доказано, что БАС является мультифакториальным заболеванием, в развитии которого играют роль как экзогенные, так и генетические факторы. Эпидемиологические исследования последних лет убедительно доказывают значение токсических факторов у определенной группы больных БАС. Например, среди офицеров и солдат армии США - участников активных боевых действий в войне в Ираке заболеваемость в 2,5 раза выше, чем в общей популяции. На роль повторных травм, высоких физических нагрузок указывает высокая заболеваемость среди спортсменов, особенно футболистов, летчиков. В единичных случаях БАС доказана наследственная природа заболевания, при этом число генов, участвующих в инициировании патологического процесса неуклонно возрастает. Широко обсуждается и роль нейротропных вирусов (энтеровирусов, ретровирусов) в этиологии БАС. Мультифакториальная природа заболевания объясняет отсутствие в настоящее время специфической этиотропной терапии при БАС. Экзогенный или эндогенный фактор инициирует развитие целого каскада патологических реакций, приводящих к гибели мотонейрона. К ним относятся: • экзайтотоксичность; • окислительный стресс; • митохондриальная дисфункция и нарушение Са2+-гомеостаза; • конформационные изменения белков и их агрегирование; • дисбаланс протеолитической системы; • нарушение функции белков цитоскелета и аксонального транспорта; • дефицит нейротрофических факторов; • активация микроглии. диагностика Согласно международным критериям El Escorial (1998), для постановки диагноза БАС необходимо наличие признаков поражения периферического мотонейрона по клиническим, электрофизиологическим и патоморфологическим данным, признаков поражения центрального мотонейрона по клиническим данным, а также прогрессирующего распространения симптомов в пределах одной или нескольких областей иннервации, что выявляют при наблюдении за больным. Наряду с этим, чтобы поставить диагноз болезни двигательного нейрона (БАС), необходимо отсутствие электрофизиологических и патологических признаков другого заболевания, которые могли бы объяснить дегенерацию центральных и периферических мотонейронов, а также данных нейровизуализации о наличии других заболеваний, которые могли бы объяснить клинические и электрофизиологические признаки. В табл. 13.2 приведены признаки поражения центрального и периферического мотонейронов в четырех отделах ЦНС, сочетание которых следует учитывать при клиническом обследовании пациента, чтобы установить категорию болезни двигательного нейрона согласно градации диагностической достоверности. Диагностические категории БАС приведены в табл. 13.3. Таблица 13.2. Признаки поражения центральных и периферических мотонейронов в четырех отделах ЦНС 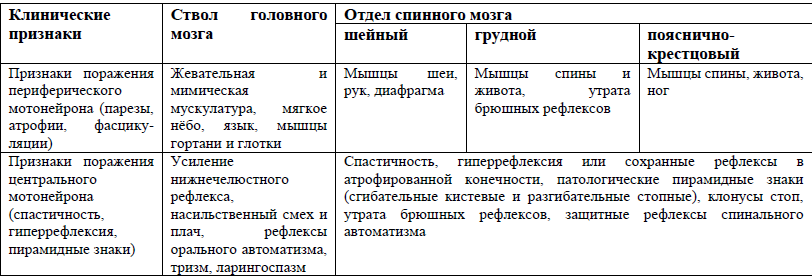 Таблица 13.3. Диагностические критерии и категории БАС  Примечания. ПМН - периферический мотонейрон; ЦМН – центральный мотонейрон. Клинические формы БАС • У больных с шейно-грудной формой в классическом варианте заболевание начинается с формирования асимметричного верхнего вялого парапареза в сочетании с гиперрефлексией и патологическими пирамидными знаками. Одновременно с этим развивается асимметричный нижний спастический парапарез с гиперрефлексией и патологическими пирамидными знаками, отчетливое формирование которого завершается позже верхнего вялого парапареза. Диссоциация в выраженности неврологического дефицита в верхних и нижних конечностях отсутствует. Позднее присоединяется сочетание бульбарного и псевдобульбарного синдромов, и еще позже становятся отчетливыми амиотрофии нижних конечностей с преобладанием в разгибательной группе мышц. = При прогрессировании заболевания развиваются выраженная инспираторная одышка и нарастание дыхательной недостаточности за счет поражения диафрагмы и вспомогательной дыхательной мускулатуры. • У больных с пояснично-крестцовой формой БАС в классическом варианте начинается с формирования асимметричного нижнего вялого парапареза с гиперрефлексией и патологическими пирамидными знаками, преобладающего в разгибателях. Одновременно с этим развивается асимметричный верхний парапарез с амиотрофиями (преобладающими в дистальных мышцах и разгибателях), умеренным повышением мышечного тонуса, гиперрефлексией и патологическими пирамидными знаками. Отчетливое формирование верхнего парапареза завершается позже, чем нижнего парапареза. Обычно имеет место диссоциация в выраженности неврологического дефицита в верхних и нижних конечностях. К моменту развития нижней вялой параплегии больные в течение различного времени сохраняют способность пользоваться руками. Позднее присоединяется сочетание бульбарного и псевдобульбарного синдромов. • У больных с бульбарной формой в классическом варианте заболевание начинается с развития дизартрии, назофонии и дисфагии, атрофии и фибрилляций языка, одно- или двустороннего пареза мягкого нёба с оживлением нижнечелюстного рефлекса и появлением рефлексов орального автоматизма. В дальнейшем развивается верхний вялый асимметричный парапарез с атрофиями преимущественно в проксимальных мышцах и разгибателях, гиперрефлексией и патологическими пирамидными знаками. Затем присоединяется нижний спастический асимметричный парапарез с гиперрефлексией и патологическими пирамидными знаками. Отмечается выраженная потеря массы тела, связанная с дисфагией. Дыхательные нарушения присоединяются на разных стадиях болезни. • У больных с первичногенерализованной формой заболевание начинается с развития вялого асимметричного тетрапареза, в ряде случаев с ранним угасанием сухожильных рефлексов без четких патологических пирамидных знаков. Одновременно развивается преимущественно бульбарный синдром в виде дисфонии без носового оттенка голосаи дисфагии с нечеткими рефлексами орального автоматизма. Развиваются выраженные утомление, инспираторная одышка за счет одновременного вовлечения в патологический процесс вспомогательной дыхательной мускулатуры и диафрагмы, а также выраженная потеря массы тела до развития дисфагии. Инструментальные исследования Нейрофизиологические исследования Игольчатую ЭМГ при БАС проводят для того, чтобы подтвердить вовлечение периферических мотонейронов в наиболее пораженных мышцах и нервах; выявить электрофизиологические признаки поражения периферических мотонейронов в клинически менее пораженных или незаинтересованных мышцах и нервах; стимуляционную ЭМГ проводят для исключения другого патологического процесса. Чтобы подтвердить поражение центральных мотонейронов, необходимо провести ТКМС. Нейровизуализация МРТ головного и спинного мозга необходима для дифференциальной диагностики БАС от потенциально излечимых и/или имеющих доброкачественный прогноз заболеваний. При МРТ головного и спинного мозга у больных БАС в 17-67% случаев выявляют признаки дегенерации пирамидных трактов, что более характерно для классического и пирамидного вариантов БАС. К другим признакам относят атрофию моторной коры головного мозга. У больных с клинически достоверным БАС и наличием бульбарного и/или псевдобульбарного синдромов роль нейровизуализации несущественна. Лабораторные исследования Единственный лабораторный метод, позволяющий подтвердить диагноз БАС, - молекулярно-генетический анализ гена супероксиддисмутазы-1. Наличие мутации этого гена у больного с подозрением на БАС позволяет отнести его в высокодостоверную диагностическую категорию «клинически достоверного лабораторно подтвержденного БАС». Других специфических лабораторных показателей при БАС не существует. Дифференциальная диагностика Дифференциальная диагностика БАС проводится с различными БАС-подобнымисиндромами: • наследственные заболевания (спинальные амиотрофии позднего возраста, бульбоспинальная амиотрофия Кеннеди, ферментопатии - дефицит гексозаминидазы А); • паранеопластические синдромы (рак легкого, яичников); • эндокринопатии (гиперпаратиреоз, тиреотоксикоз); • инфекционные заболевания (ВИЧ-1, HTLV-1, бруцеллез, эпидемический энцефалит и др.); • лимфопролиферативные заболевания (макроглобулинемия Вальденстрема, хронический лимфолейкоз, лимфомы); • мультифокальная двигательная нейропатия с блоками проведения; • спондилогенная шейная миелопатия; • сосудистые заболевания (васкулиты); • экзогенные интоксикации (свинец, ртуть, таллий, мышьяк, марганец, алюминий, пестициды, растительные токсины); • воздействие физических факторов (электрический ток, радиация). лечение Цели терапии • Замедлить прогрессирование болезни и продлить период заболевания, при котором больной не нуждается в постоянном постороннем уходе. • Уменьшить выраженность отдельных симптомов болезни и поддерживать стабильный уровень качества жизни. Показания к госпитализации • Первичное обследование. • Проведение чрескожной эндоскопической гастростомии. Лекарственная терапия Патогенетическая терапия Единственный препарат, достоверно замедляющий прогрессирование БАС, - рилузол*,пресинаптический ингибитор высвобождения глутамата. Применение препарата позволяет продлить жизнь больным в среднем на 3 мес. Рилузол* показан больным с достоверным или вероятным БАС с длительностью болезни менее 5 лет, ФЖЕЛ более 60%, без трахеостомии. Паллиативная терапия Направлена на уменьшение определенных симптомов при БАС и улучшение качества жизни. Паллиативная терапия БАС Фасцикуляции, крампи - Карбамазепин по 100 мг 2 раза в день, баклофен по 10-20 мг в день или тизанидин с постепенным увеличением дозы до 8 мг/сут Спастичность - Баклофен по 10-20 мг в день или тизанидин с постепенным увеличением дозы до 8 мг/сут, диазепам в дозе 2,5-5 мг 3 раза в день Болевой синдром - Парацетамол по 1 г 4 раза в день; Трамадол по 50 мг (не более 400 мг/сут).; Морфин в начальной дозе 2,5 мг перорально каждые 4-6 ч Депрессия, эмоциональная лабильность - Амитриптилин до 100 мг/сут на ночь, флуоксетин по 20 мг/сут на ночь Улучшение метаболизма - Глутоксим* 3% 2,0 мл внутримышечно через день 3 мес.; Кортексин* по 10 мг на 5,0 мл 0,5% прокаина внутримышечно через день 3 мес (глутоксим* и кортексин* чередовать); Левокарнитин 20% раствор по 15 мл 4 раза в день; Курсовая терапия по 2 мес 3 раза в год; Тиоктовая кислота 600 мг ежедневно в течение 2 нед 1-2 раза в год Поливитаминная терапия - Поливитамины (мильгамма* по 2 мл внутримышечно ежедневно в течение 2 нед 1-2 раза в год, нейромультивит* по 2 капсулы 3 раза в день по 2 мес 2 разав год) Перонеальные парезы, эквиноварусная деформация стоп - Ортопедическая обувь Парез разгибателей шеи - Полужесткий или жесткий головодержатель Нарушения ходьбы - Трости, ходунки, коляски Утомление - Амантадин по 100 мг/сут в течение 1 мес, при неэффективности – этосуксимид по 37,5 мг/сут, при неэффективности - гимнастика 2 раза в день по 15 мин (упражнения с пассивным сокращением) Тромбозы глубоких вен нижних конечностей - Эластичное бинтование ног Спастическая контрактура кисти - Расслабляющие лонгеты Плечелопаточный периартроз - Компрессы с диметилсульфоксидом 30% (одна чайная ложка), прокаином 0,25% (две чайные ложки), 3 мл гиалуронидазы (растворить 64 ЕД порошка) на 30-40 мин в течение 3-5 дней Слюнотечение - Механическая или медикаментозная санация полости рта (частые полоскания антисептическими растворами, чистить зубы 3 раза в день). Ограничение кисломолочных продуктов. Амитриптилин, имипрамин до 100 мг/сут на ночь; Атропин 0,1% 1 мл по 2 капли в каждый угол рта за 10-20 мин до приема еды и на ночь. Системное применение атропина чревато побочными эффектами (тахикардия, запор); Портативные отсосы; Бронхолитики и муколитики (ацетилцистеин по 600 мг внутрь в день); Коррекция обезвоживания Дизартрия – Миорелаксанты; Аппликации льда на язык; Речевые рекомендации Британской ассоциации БАС; Электронные пишущие машинки; Таблицы Этрана с буквами или словами; Компьютерная система набора символов сенсорными датчиками; устанавливаемыми на глазные яблоки Дисфагия - Протертые и промолотые блюда, пюре, суфле, студни, каши, загустители жидкостей; Исключение блюд с контрастными по плотности жидким и твердым компонентами; Чрескожная эндоскопическая гастростомия Синдром обструктивного апноэ во время сна - Флуоксетин по 20 мг/сут на ночь Дыхательные нарушения (ФЖЕЛ <60%) - Периодическая неинвазивная ИВЛ Нутритивная поддержка Для оценки нутриционного статуса пациента можно использовать дневник питания, определение индекса массы тела и антропометрические измерения (кожная складка плеча, средняя окружность плеча). Снижение массы тела на 10% является показанием для начала нутриционной поддержки. Вторым показанием для нутриционной поддержки является появление аспирации, которая развивается в результате дисфагии. Для подтверждения аспирации используют контрастную рентгеноскопию акта глотания, однако даже анамнестическое упоминание о поперхивании позволяет с высокой долей вероятности предположить аспирацию. Одним из способов коррекции нарушений глотания является диетический, заключающийся в изменении состава и консистенции пищи. При оценке энергетических потребностей пациента с БАС следует придерживаться калоража из расчета потребляемой энергии в покое у здорового человека на единицу массы тела: для мужчин - 25 ккал/кг, для женщин - 20 ккал/кг. Жидкость следует употреблять в объеме 30 мл/г массы тела. Рекомендуется избегать сухих, волокнистых, твердых продуктов; продуктов, меняющих консистенцию во время глотания (все варианты желе); растительных продуктов, у которых есть пленчатые или твердые части (кукуруза, клубника, семечки и пр.). Рекомендуемая консистенция - пюре, которую можно придавать продуктам путем измельчения, температурной обработки (варка, приготовление на пару), использования специальных загустителей. В случае затруднения потребления жидкости можно рекомендовать потребление жидкости в виде киселей. Стимулирующий способ коррекции нарушений глотания заключается в коррекции глотательных движений, положения головы и тела. Для пациентов с дисфагией во время приема пищи максимально нежелательными являются положение на спине и переразгибание шеи. Если пациент не может находиться в вертикальном положении, ему должно быть придано положение полулежа на боку. Эффективным является маневр - наклон головы во время глотания или втягивание подбородка. Тот же эффект может давать поворот головы в сторону. Прием пищи может быть изнурительным для пациента, в связи с чем рекомендуется глотание небольшого количества пищи, прием пищи маленькими порциями 5-6 раз и более в день. Пациентам с высоким рвотным рефлексом состояние может облегчить охлаждение мягкого нёба прохладным напитком перед и во время еды. При нарастании дисфагии для обеспечения поступления достаточного количества пищи и жидкости необходима установка назогастрального зонда или гастростомы, так называемый заместительный/хирургический метод. Дыхательные нарушения БАС приводит к развитию слабости всех мышц, участвующих в акте дыхания: диафрагмы, мышц верхних дыхательных путей, межреберных мышщ, мышц передней брюшной стенки, вспомогательной дыхательной мускулатуры. В результате у пациента постепенно нарастает дыхательная недостаточность, которая проявляется одышкой, утомляемостью, ортопноэ, нарушениями сна, дневной сонливостью, головной болью. Гиповентиляция, ослабление кашля и нарушение защиты дыхательных путей при глотании увеличивают риск воспалительных осложнений со стороны органов дыхания, которые являются основной причиной смерти больных БАС. Своевременное выявление и комплексная коррекция дыхательных и бульбарных нарушений позволяют продлить жизнь пациентов и улучшить ее качество. Пациент часто не связывает свои симптомы с нарушением дыхания, поэтому врач для выявления клинических проявлений дыхательной недостаточности должен на каждом визите расспрашивать больного о наличии симптомов, ассоциированных со слабостью дыхательных мышц. При обследовании пациентов с целью выявления и мониторинга дыхательных нарушений следует регулярно (1 раз в несколько месяцев) определять ЖЕЛ или максимального инспираторного давления (MIP). При слабости круговой мышцы рта может быть исследовано давление на вдохе носом (SNP). Ночную пульсоксиметрию проводят для выявления эпизодов десатурации во время сна, которые являются ранним признаком дыхательных нарушений. Дневная гиперкапния у пациентов с БАС развивается на самых поздних стадиях заболевания, поэтому определение газового состава крови не следует использовать в качестве скринингового метода. Согласно рекомендациям Европейской федерации неврологических обществ, при появлении первых признаков дыхательной недостаточности следует обсудить с пациентом возможные варианты медицинской помощи - неинвазивную вентиляцию легких (НИВЛ), инвазивную вентиляцию легких (ИВЛ), медикаментозную терапию одышки, которые будут использованы как при начальных признаках дыхательной недостаточности, так и на терминальной стадии болезни. Инвазивную ИВЛ при БАС проводят только по желанию пациента и его родственников в связи с необходимостью постоянного присутствия медицинского персонала и значительными расходами по уходу. Несмотря на увеличение продолжительности жизни, инвазивная ИВЛ имеет ряд недостатков и побочных эффектов: • увеличение слюноотделения; • нарушение глотания; • повышенный риск аспирации; • развитие инфекций в нижних отделах дыхательных путей; • формирование трахеоэзофагогастральной фистулы; • стеноз трахеи или трахеомаляция; • высокая стоимость; • необходимость круглосуточного дежурство медицинского персонала. Симптоматическая терапия при диспноэ определяется характером и длительностью эпизодов дыхательных нарушений. При периодически возникающих диспноэ с длительностью менее 30 с рекомендуется применение лоразепама сублингвально, при длительности более 30 с - морфина. При постоянном диспноэ используется морфин (по 2,5 мг 4-6 раз в сутки перорально илиподкожно либо внутривенные инфузии со скоростью 0,5 мг/ч).__ |
