Физиология. Реферат Антитоксична функція печінки
 Скачать 0.52 Mb. Скачать 0.52 Mb.
|
|
Міністерство освіти і науки України Запорізький державний медичний уніревситет Реферат «Антитоксична функція печінки» Підготувала: студентка 2 курсу 1 медичного факультету 4 групи Спеціальність Лікуввальна справа Чернишева Жанна Запоріжжя 2019 План: Основні функції печінки Детоксикація (антитоксична функція печінки) Етапи біотрансформації : Хімічна модифікація Кон’югація Біотрансформація при захворюваннях печінки Джерела Печінка займає центральне місце в обміні речовин і виконує різноманітні функції: 1. Гомеостатична - регулює вміст в крові речовин, що надходять в організм з їжею, що забезпечує сталість внутрішнього середовища організму. 2. Біосинтетична - здійснює біосинтез речовин «на експорт» (білки плазми крові, глюкоза, ліпіди, кетонові тіла і ін.). 3. Знешкоджуюча - в печінці відбувається знешкодження токсичних продуктів метаболізму (аміак, продукти гниття білків в кишечнику, білірубіну та ін.), чужорідних сполук і лікарських речовин. 4. Травна - пов'язана з синтезом жовчних кислот, утворенням і секрецією жовчі. 5. Видільна (екскреторна) - забезпечує виділення деяких продуктів метаболізму (холестерол, жовчні пігменти) з жовчю в кишечник. 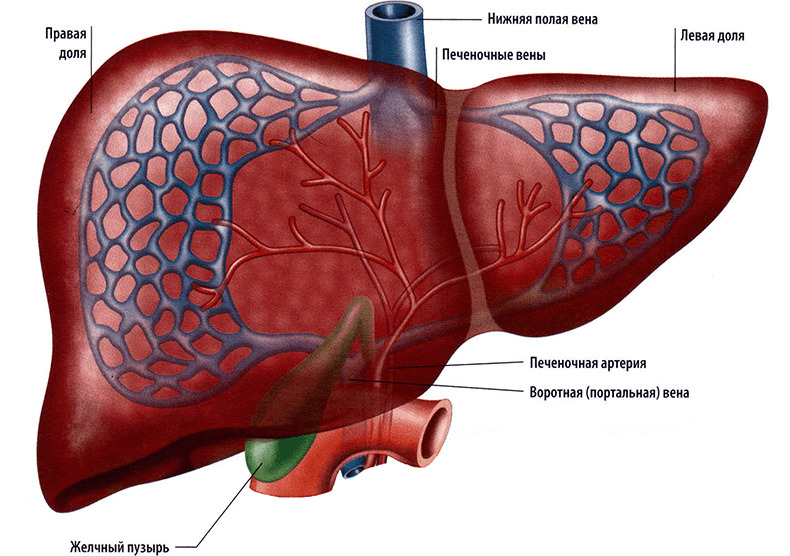 6. Інактивація гормонів, вітамінів. 6. Інактивація гормонів, вітамінів.Велике значення печінки визначається її анатомічним положенням. Це проміжний орган між кишечником і системою загального кровотоку. Завдяки печінки в загальному колі кровообігу зміни концентрації ряду речовин, що надходять в організм з їжею (глюкоза, амінокислоти та ін.), Маса печінки і її хімічний склад схильні до змін, особливо, при патологічних станах. Для здійснення обмінних функцій печінку отримує від 1/4 до 1/3 крові хвилинного обсягу серця, що становить близько 1,5 літра в хвилину. 70% крові надходить в печінку по ворітної вени, 30% - по печінкової артерії. Основна функція печінки - детоксикація. Печінка виступає в ролі губки, яка пропускає через себе все, що в наш організм потрапило. Вона фільтрує ці речовини на шкідливі і корисні, після чого нейтралізує отрути. В останні роки атака токсинів на організм людини зросла в кілька разів, тому печінка часто зі своїми обов'язками впоратися не може. Тому сьогодні захворювання печінки - це не рідкість. Фахівці підрахували, що доросла людина щорічно вживає близько 4 л пестицидів, які містяться сьогодні у фруктах і овочах, а також понад 5 кг консервантів, різних харчових добавок, а також 2 кг твердих шкідливих речовин, які нам доводиться вдихати через легені. Це вкрай важкий вантаж для печінки, якій з кожним днем необхідно працювати все більше і більше. Анатомічне розташування печінки на шляху кровотоку, який несе поживні та інші речовини з травного тракту, особливості кровопостачання, будови, лимфообращения, специфіка функцій клітин печінки визначають функції печінки. Раніше була описана жовчовивідна функція, але вона далеко не єдина. Печінка є головним органом, де про знешкодженні природних метаболітів (білірубін, гормони, аміак) і чужорідних речовин. Чужорідними речовинами, або ксенобіотиками, називають речовини, що надходять в організм з навколишнього середовища і не використовуються ним для побудови тканин або в якості джерел енергії. До них відносять лікарські препарати, продукти господарської діяльності людини, речовини побутової хімії та харчової промисловості (консерванти, барвники). Детоксикационная функція обумовлена в нейтралізації і знезараженні шкідливих речовин, які надходять туди разом з кров'ю по ворітної вени від органів травлення. У складі крові, що надходить в печінку по ворітній вені, містяться з одного боку поживні речовини і токсини, що надійшли туди після перетравлення шлунково-кишковим трактом їжі. У тонкому кишечнику одночасно протікає безліч різних процесів, в тому числі і гнильні. В результаті протікання останніх в результаті утворюються шкідливі речовини - крезол, індол, скатол, фенол тощо. До шкідливих речовин не властивим для нашого організму сполук відносять ще й фармацевтичні препарати, алкоголь, шкідливі речовини, що містяться в повітрі поблизу від жвавих доріг або в тютюновому димі. Всі ці речовини шкідливі, вони всмоктуються в кров і разом з нею надходять в печінку. Головна роль детоксикаційної функції полягає в перероблення та руйнуванні шкідливих речовин і виведення їх разом з жовчю в кишечник. Даний процес (фільтрація) відбувається завдяки проходженню різних біологічних процесів. До таких процесів відносять відновлення, окислення, метилювання, ацетилювання, синтез різних захисних речовин. Ще однією з особливостей детоксикаційної функції є те, що вона знижує активність різних гормонів. Потрапляючи в печінку їх активність знижується. Знешкодження нормальних метаболітів 1. Знешкодження пігментів. У клітинах ретикулоендотеліальної системи печінки протікає катаболізм гема до білірубіну, кон'югація білірубіну з глюкуроновою кислотою в гепатоцитах і розпад в гепатоцитах надходить з кишечника уробилиногена до непігментних продуктів. 2. Знешкодження аміаку. Аміак - високотоксична з'єднання, особливо небезпечне для мозку. Основним механізмом знешкодження аміаку в організмі є біосинтез сечовини в печінці. Сечовина - малотоксична з'єднання і легко виводиться з організму з сечею. 3. Інактивація гормонів. Печінки належить значна роль в інактивації гормонів. Багато пептидні гормони гідролізуються в печінці за участю протеолітичних ферментів. Наприклад, фермент інсулінази гидролизует пептидні ланцюга А і В інсуліну. Катаболізм адреналіну і норадреналіну відбувається в печінці шляхом дезамінування моноамінооксидази, метилування і кон'югації з сірчаною та глюкуроновою кислотами. Продукти метаболізму виводяться з сечею. Термін детоксикація відноситься до цілого ряду гоместатіческіх функцій печінки, що підтримують сталість складу крові. Бактерії та інші патогенні організми видаляються з крові синусоїдів купферовскими клітинами, а токсини, які вони виділяють, знешкоджуються в результаті біохімічних реакцій, що відбуваються в гепатоцитах (клітинах печінки). До знешкодження токсинів призводять такі реакції, як окислення, відновлення, метилування або конденсація з іншого органічної або неорганічної молекулою. Після детоксикації ці речовини, тепер уже у вигляді нешкідливих продуктів, виводяться нирками. Водорозчинні речовини зазвичай виводяться в незміненому вигляді з сечею або жовчю. Жиророзчинні ж з'єднання повинні перетворюватися в менш активні або водорозчинні речовини, в іншому випадку вони можуть накопичуватися в організмі і впливати на його життєдіяльність. Печінка забезпечує елімінацію багатьох екзо- і ендогенних сполук. Інтенсивність елімінації того чи іншого з'єднання залежить від зв'язування його з білками, активності в його відношенні печінкових ферментів і печінкового кровотоку. Елімінація ряду речовин в значній мірі відбувається вже при першому проходженні через печінку крові, що відтікає від шлунково-кишкового тракту через ворітну вену. Відомі два основних механізми детоксикації: Монооксигеназна системи ЕПР і пов'язані з ними реакції кон'югації; цей механізм включається при попаданні в печінку переважно ліпотропних сполук; Позамікросомальні механізми, локалізовані в цитоплазмі, мітохондріях, пероксисомах і лизосомах; активність цих механізмів проявляється переважно в відношенні розчинних з'єднань. Мікросомальні механізми детоксикації. Сукупність метаболічних перетворень ендогенних субстратів і ксенобіотиків в гепатоцитах може бути представлена у вигляді двох фаз: 1. фаза хімічної модифікації; 2. фаза кон'югації. Хімічна модифікація - це процес ферментативної модифікації вихідної структури ксенобиотика, в результаті якої відбувається: 1. розрив внутрішньо молекулярних зв'язків; 2. приєднання до молекули додаткових функціональних груп (-СН3, ОН, -NH2),3. видалення функціональних груп шляхом гідролізу. 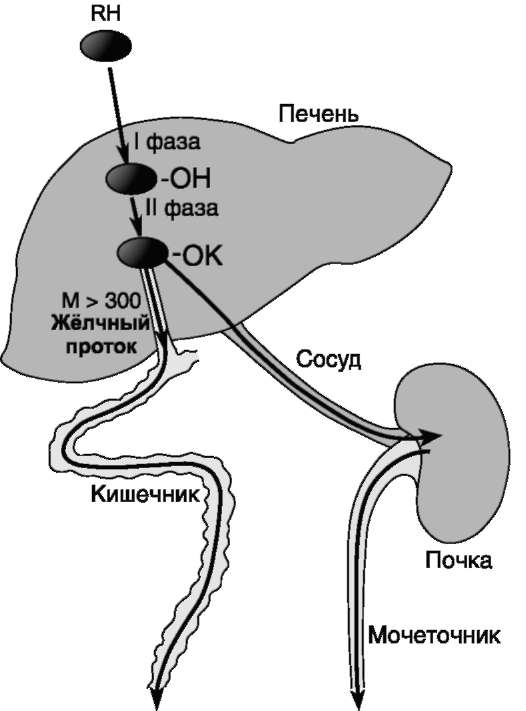 Типи модифікацій: Типи модифікацій:окислення (мікросомальне, пероксісомальное) відновлення ізомеризація ацетилювання, метилювання, гідроксилювання гідроліз і т.д. Система знешкодження включає безліч різноманітних ферментів (оксидоредуктаз, ізомерази, ліази, гідролази), під дією яких практично будь-який ксенобіотик може бути модифікований. Найбільш активні ферменти метаболізму ксенобіотиків в печінці. І. В результаті хімічної модифікації, як правило, ксенобіотики стають більш гідрофільними, підвищується їх розчинність, і вони легше виділяються з організму з сечею. Крім цього, додаткові функціональні групи необхідні, щоб речовина вступило в фазу кон'югації. Знешкодження (біотрансформація) ліпідорозчинним речовин досягається, як правило, у дві фази, за допомогою переведення їх в водорозчинні метаболіти. У фазі 1 знешкодження ліпідорозчинні речовини піддаються окисленню, відновленню або гідролізу. Продукти, утворені в 1-й фазі знешкодження нерідко в 2-й фазі піддаючись реакцій кон'югації. Таким чином, виникають водорозчинні кон'югати, які виділяються нирками або в жовч. Як правило, токсичні речовини проходять обидві фази знешкодження, до того, як вони в виглядікон'югатів елімінуються з організму людини. За допомогою ферментативних реакцій 1-ї фази, таких як окислення, відновлення або гідроліз, функціональні групи, такі як, наприклад, гідроксильні групи, переводяться в ліпідорозчинним стан. Найважливіша ферментативна система 1-ї фази знешкодження - це цитохром-Р450 -монооксігеназная система. Вона локалізується в ЕПР і складається з двох ферментів; НАДФН-цитохром-Р450-редуктази і Р450. Окислення органічних сполук за допомогою цитохром-Р450 - монооксигеназной системи в якості 1-ї фази знешкодження досягається за допомогою розміщення підлягає знешкодженню сполуки на активному центрі цитохрому Р450. Цитохром-450 являє собою містить гем фермент, який відповідальний за активацію кисню і приєднання кисневого атома в органічне з'єднання при утворенні гідроксісоедіненіе. Відновлювальні еквіваленти поставляються НАДФН-цитохром-Р450-редуктазой, причому НАДФН переводиться в НАДФ +. Таким чином, цитохром Р450 - монооксигеназная система відіграє центральну роль не тільки при знешкодженні чужорідних речовин, але також і при біосинтезі стероїдних гормонів і жовчних кислот. Виникаючі таким чином гідроксильованого продукти 1-ї фази знешкодження можуть, нарешті, піддаватися реакцій кон'югації 2-ї фази знешкодження, наприклад, глюкуронированию. У цих процесах беруть участь ферменти (монооксигенази, пов'язані з цитохромом Р450 і b5), цитоплазматические глутатіонтрансферази і т. Д. В результаті цих біохімічних реакцій зазвичай відбувається інактивація лікарських речовин (наприклад, бензодіазепінів). Однак деякі метаболіти бувають активними (наприклад, метаболіт кортизону кортизол, преднизона - преднізолон, имипрамина - дезипрамін), а іноді - токсичними (наприклад, метаболіти ізоніазиду і парацетамолу). В ході першої фази завдяки біотрансформації субстрат втрачає початкові токсичні або фармакодинамічні властивості (феномен «детоксикації»). В процесі мікросомального окислення відбувається деградація холестерину, вільних жирних кислот, стероїдних гормонів, жовчних кислот, ароматичних вуглеводнів. Активність мікросомального окислення у людей похилого віку знижена, тому підвищується ризик аутоінтоксикацією і знижується стійкість до ксенобіотиків. Більшість реакцій біотрансформації пов'язано з процесами окислення, при цьому провідним ферментом є цитохром Р450 (гемсодержащих білок), локалізований в глибоких шарах мембран ЕПР, а також цитохром β5, розташований на його поверхні. Цитохроми Р450 і β5 функціонально пов'язані. Утворені ними гемопротеїдні комплекси забезпечують підвищення швидкості каталізуючих реакцій. У каскадному ферментативном процесі цитохром р450 грає роль кінцевої оксидази, що приймає електрони, необхідні для подальшої активації кисню, використовуваного в окисленні метаболізуються субстратів. Отже, він виконує ключову функцію в універсальної окислювальному системі. На частку Р450 припадає приблизно 1% печінкових білків або 20% білка ЕПР гепатоцитів. Утворення особливої форми Р450 - LM3a індукується етанолом. При цьому вміст загального Р450 підвищується. Підсилюється окислювання спиртів, в тому числі етанолу, з утворенням ацетальдегіду. Морфологічно визначається проліферація ЕПР гепатоцитів. Ця форма цитохрому володіє також найвищою каталітичної активністю щодо аніліну. Цитохром Р450 бере участь в метаболізмі арахідонової кислоти, при розпаді якої утворюються біологічно активні ейкозаноїди - простагландини, лейкотрієни. Цитохром Р450 надзвичайно лабилен. В експерименті показано, що під дією таких речовин, як сечовина, лизолецитин, фосфоліпази, трипсин, детергенти відбувається його перетворення активну форму - цитохром Р420. При патології мембран (активація утворення продуктів ПОЛ, інтоксикація чотирьоххлористим вуглецем, при тиреотоксикозі) також можливе перетворення Р450 в Р420. Таким чином, конкурентні відносини за цитохром Р450 ендогенних метаболітів і ксенобіотиків проявляються їх незавершеним метаболізмом. В організмі накопичуються токсичні сполуки, що викликають ураження інших органів і систем. В ході детоксикації субстрат може придбати нові біологічні властивості (феномен «модифікації»). В результаті біологічної модифікації в печінці з потенційно безпечних ксенобіотиків можуть утворюватися метаболіти з токсичними, некрозогенного, канцерогенними, проканцерогенов, мутагенними властивостями (феномен «токсикації»). Так, при мікросомального окислення парацетамолу синтезуються продукти, здатні пошкоджувати мембрани гепатоцитів. N-оксіпроізводних фенацетину і фенітідіна є метгемоглобінобразователі і канцерогенами. Справжні канцерогени утворюються з ароматичних вуглеводнів бензопірену і 7,12-діметілбензантрацена. Результатом микросомальной біотрансформації хлорованих вуглеводнів є утворення реактивних метаболітів, таких як епоксиди і карб. Токсичними властивостями володіє СС13-радикал, що утворюється з тетрахлорметана. Метаболізм його відбувається на мембрані ЕПР шляхом послідовного освіти хлороформу, фосгену, СоСl2, СО і СО2. Саме активні продукти біотрансформації тетрахлорметана визначають його токсичність в результаті різкого зниження і мікросомальної фракції Р450. Індукують дією на систему мікросомальних монооксідаз мають вітаміни С, Е, біотин, поліненасичені жирні кислоти. Система мікросомальних монооксідаз надзвичайно чутлива до дефіциту вітаміну С. Так, при виключенні його з раціону тільки на дві доби відзначається зниження вмісту цитохрому Р450 в гепатоцитах приблизно на 20%. Це має певне значення в клініці, так як при дефіциті вітаміну C сповільнюється процес детоксикації лікарських речовин і токсичних метаболітів. У печінки можуть, з одного боку, утворюватися висококанцерогенні епоксидні сполуки, з іншого - знешкоджуватися багато канцерогенів. Деякі речовини (барбітурати, галоперидол, глутетимід) індукують ферменти печінки, особливо цитохром Р450; інші речовини (хлорамфенікол, циметидин, дисульфірам, декстропропоксифен, алопуринол) інгібують їх. Етанол може надавати обидва ефекту. Одночасний прийом двох препаратів, що метаболізуються одними і тими ж мікросомальними ферментами, може призвести до посилення або ослаблення фармакологічної дії одного з них або обох. Активність ферментів, які беруть участь в даних реакціях, залежить від віку.  ІІ. Коньюгація - процес утворення ковалентних зв'язків між ксенобіотиком і ендогенних субстратом. Освіта зв'язків відбувається, як правило, по ОН або NH2-групи ксенобиотика. Утворився коньюгат малотоксичний і легко виводиться з організму з сечею. ІІ. Коньюгація - процес утворення ковалентних зв'язків між ксенобіотиком і ендогенних субстратом. Освіта зв'язків відбувається, як правило, по ОН або NH2-групи ксенобиотика. Утворився коньюгат малотоксичний і легко виводиться з організму з сечею.Виділяють глюкуронідну, сульфатну, тіосульфатну, ацетильную кон'югації. У них беруть участь ендогенні сполуки, що утворюються в організмі з витратою енергії: УДФ-глюкуронати, ФАФС, тіосульфат, ацетил-КоА. Це переклад жиророзчинних речовин в водорозчинні (глюкуроніди, сульфати, ацетильную, тауріновие і гліціновие похідні), які потім виводяться з сечею або жовчю. Найбільш часто відбувається реакція кон'югації з глюкуроновою кислотою, катализируемая глюкуронилтрансфераза. Як правило, кон'юговані форми більш водорозчинні і менш активні, ніж вихідні. З реакцій кон'югації при знешкодженні ендогенних і екзогенних речовин глюкуронирование у людей є найважливішим процесом. При цій реакції кон'югації за допомогою УДФ-глюкуронілтрансферази глюкуроновая кислота від УДФ-глюкуронової кислоти переноситься на чужорідну речовину або ендогенна речовина (білірубін, жовчні кислоти, стероїдні гормони) при звільненні УДФ. Оскільки кон'югати глюкуронової кислоти розчинні у воді, у вигляді глюкуронирования, яке можливо як в печінці, так і поза печінки, елімінація ліпідорозчинним речовин стає можливою через нирки і жовч. Глюкуронова кон'югація З глюкуроновою кислотою в реакцію кон'югації вступають феноли, спирти (первинні, вторинні, третинні), ароматичні і аліфатичні карбонові кислоти, кетони, гідроксіаміни, карбаматів, сульфонаміни, аріламіни, арілмеркаптани, дітіокарбоновие кислоти, фенілбутазін, речовини, що мають в своєму складі пірол і піразол . Глюкуроніди зазвичай менш токсичні в порівнянні з вступає в реакції субстратом. Вони добре розчиняються у воді, тому легко виводяться з організму через нирки і жовчний шунт. Білірубін є основним представником групи білірубіноідов. Детоксикація білірубіну відбувається шляхом утворення моно- та біглюкуронідов. У фізіологічних умовах утворення білірубіну збільшується при посиленні гемолізу еритроцитів, пов'язаного з фізичним навантаженням. Однак резервні можливості гепатоцитів настільки значні, що гипербилирубинемии при цьому не спостерігається. При різних формах печінкової недостатності, що супроводжується зменшенням вмісту глікогену в цитоплазмі, знижуються синтез УДФ-глюкуронової кислоти і активність глюкуроновою кон'югації. При цьому втрачається здатність пов'язувати ендогенні метаболіти, що призводить до дискоординації метаболізму і поглибленню патологічного процесу. Швидкість глюкуроновою кон'югації пропорційна ступеню розчинності ксенобіотиків в ліпідах. Сульфатна кон'югація У сульфатную кон'югацію вступають феноли, спирти, ароматичні аміни, гідроксиламін, аріламіни, деякі стероїди. В окремих випадках сульфатна кон'югація не призводить до утворення нетоксичних продуктів. Але це відбувається тільки при виснаженні глюкуроновою кон'югації. Тому освіту канцерогену можливо лише при виснаженні глюкуроніду. Глутатіонова кон'югація До числа з'єднань, що вступають в реакції кон'югації з глутатионом, відносяться епоксиди, альдегіди, нітрили, прості і складні ароматичні сполуки, нітрофурани та ін. Етанол надає дозозалежне зниження глутатіон-5-трасферазной активності. Фенобарбітал активує всі види глутатіонтрансферази. Кон'югація з амінокислотами Кон'югація з амінокислотами є механізмом знешкодження ароматичних з'єднань, що містять карбоксильні групи (ароматичні карбонові кислоти та їх похідні, секріловие кислоти і їх похідні, похідні оцтової кислоти, гетероциклічні та поліциклічні карболової кислоти). Аналогічний механізм використовується для детоксикації жовчних кислот. Істотну роль у визначенні характеру реакції кон'югації з амінокислотами грає хімічна структура ксенобиотика. Так, кон'югація з гліцином дає арілкіслоти (наприклад, бензойна кислота), кон'югація з глутамином - арілуксусной кислоти (наприклад, фенилуксусная і індолілуксусная кислота), а таурин утворює кон'югати з жовчними кислотами. Найбільш докладно досліджено освіту гиппуровой кислоти - кон'югату гліцину з бензойної кислотою. Нетоксичний кон'югат гиппуровой кислоти надходить в плазму крові, потім виводиться з сечею. У клініці дослідження швидкості утворення гиппуровой кислоти після введення в організм бензоату натрію використовується в якості одного з тестів для оцінки антитоксичної функції печінки. При захворюваннях печінки інтенсивність процесу кон'югації з гліцином знижується. Метилювання Метилюванню піддаються ксенобіотики і їх метаболіти, що містять гідроксильні, сульфгідрильні і аміногрупи (алкілфеноли, метоксіфеноли, галогенофеноли, Меркаптани, первинні і вторинні аміни). На відміну від інших реакцій при метилировании не завжди змінюється розчинність і токсичність вихідної сполуки. Крім органічних сполук метилірованої може і ряд неорганічних речовин. До їх числа відносяться сірка, селен, телур, ртуть, миш'як. В результаті метилювання неорганічних сполук утворюються діметільние летючі похідні, що виділяються з організму або вступають в подальші реакції кон'югації. Наприклад, метилірованої похідне ртуті утворює кон'югат з глутатионом - метілртутьглутатіон, екскретіруемие жовчю. Ацетилювання Ацетилювання піддаються ендогенні і екзогенні сполуки, що містять аміно-, гідрокси- та сульфгідрильні групи (ароматичні і аліфатичні аміни - серотонін, триптаміну, гістамін, α-нафтиламин; гідрозин, гідрозіди, сульфаніламіди). Характерно, що при ацетилюванні сульфаніламідів утворюються погано розчинні сполуки і з'являється загроза їх конденсації в сечовивідних шляхах. У зв'язку з цим процес ацетилювання не можна повністю вважати процесом детоксикації. Швидкість ацетилювання ксенобіотиків у людей різна, тому виділяють групи осіб, здатних до швидкого ( «швидкі ацетілатори») і повільного ( «повільні ацетілатори») ацетилювання ксенобіотиків. Належність до тієї чи іншої групи визначається активністю ацетилтрансферазою, які генетично детерміновані. «Повільні ацетілатори» менш стійкі до токсичної дії ксенобіотиків, які піддаються детоксикації шляхом ацетилювання. Тому терапевтичні дози ізоніозіда виявляються для них токсичними. В окремих випадках в результаті реакції кон'югації утворюються токсичні продукти. Для їх усунення в організмі виробилася здатність пов'язувати одні і ті ж хімічні сполуки за допомогою різних механізмів кон'югації. Макрофагальні механізми детоксикації Клітини Купфера в значній мірі обумовлюють резистентність тканини печінки до дії патогенних агентів. Вони елімінує з крові продукти розпаду і життєдіяльності аутологічних тканин, в тому числі еритроцити, бактерії, антигени, імунні комплекси, лізосомальні гідролази, активовані фактори згортання IX-XI, тромбопластин, поглинають з крові до 90% сполук заліза, срібла, ртуті, ліпідів. Великі колоїдні частинки, які потрапляють в кров, видаляються макрофагами печінки, селезінки, легенів. Стан поглотительной функції макрофагів залежить від інтенсивності печінкового кровотоку, гормонального статусу організму, процесу опсонізації. Функції опсонінов можуть виконувати α2-макроглобулин, тромбоцити, специфічні антитіла. На поверхні макрофагів можливо рецепторное взаємодія з Ig G і C3 компоненту комплементу через гликокаликс. Здійснення метаболічної функції макрофагів можливо завдяки клітинної кооперації гепатоцита, макрофаги, ендотеліоцита. Відомості про роль гормонального статусу незначні. Відомо, що естрогени і тироксин стимулюють макрофагальну активність. В обміні жовчних пігментів макрофагів відводиться провідна роль. У них за участю кислих гідролаз руйнуються поглинені еритроцити і білкова частина гемоглобіну. Подальше перетворення протопорфірінового кільця за допомогою мікросомальної гемоксігеназной системи здійснюється з утворенням білірубіну-IXа, який транспортується в гепатоцит, де відбувається його кон'югація. У макрофагах під дією ліпаз відбувається попереднє розщеплення холестерину і хіломікронів. В подальшому продукти їх розпаду траспортується в гепатоцити, в яких є висока активність холінестерази. Кінцевий продукт обміну ліпідів - ліпопротеїди секретируются в синусоїди. У макрофагах і гепатоцитах утворюється сечовина, тобто до певної міри ці клітини дублюють один одного. Макрофаги беруть участь в обміні кортикостероїдів, надаючи, таким чином, що регулює вплив на ріст і регенерацію гепатоцитів. Зниження антитоксичної функції печінки у хворих на цироз, системним портальних шунтом, печінковою недостатністю призводить до потрапляння в загальний кровотік біогенних амінів, які утворюються в кишечнику і не знешкоджуються в печінці. Деякі з них (октопамин, тирамін, етаноламіі, фенілетиламін, фенілетіноламін) накопичуються в нервових закінченнях, витісняючи природні нейротрансмітери (норадреналін, дофамін). Ці симпатомиметические аміни мають меншу активність в порівнянні з норадреналіном, дофамином, так як октопамин як передавач нервових імпульсів становить лише 1% від активності норадреналіну. Біотрансформація при захворюваннях печінки У той час як при легкому гепатиті активність ферментів біотрансформації в печінці незначно відрізняється від такої у здорових людей, у хворих з важким гострим гепатитом і важким активним хронічним гепатитом або цирозом печінки спостерігається зниження Р450 в печінці. Активність УДФ-глюкуронілтрансферази жовчних кислот печінки людини знижується при цирозі печінки. З цієї причини при важких захворюваннях печінки, особливо, при цирозі, метаболізм і елімінація ліків можуть бути значно знижені. При захворюваннях печінки, проте, змінюється не тільки біотрансформація медикаментів, але медикаменти можуть також необоротно ушкоджувати печінку  При хронічних захворюваннях печінки в різного ступеня змінюються захоплення, метаболізм і елімінація ряду лікарських засобів. При портокавальном шунтування знижується елімінація при першому проходженні через печінку деяких препаратів, що приймаються всередину. Зміна архітектоніки печінки і порушення внутрішньопечінкової гемодинаміки при цирозі печінки також можуть привести до зниження елімінації лікарських речовин. При гіпоальбумінемії зростає частка вільної фракції препаратів, що зв'язуються з альбуміном, а внаслідок цього - їх активність. Зниження активності ферментів може привести до уповільнення інактивації і елімінації протисудомних (фенітоїн, фенобарбітал) і протизапальних (парацетамол, фенілбутазон, глюкокортикоїди) коштів, транквілізаторів, кардіотропних засобів (лідокаїн, хінідин, пропранолол), антибіотиків (нафциллин, хлорамфенікол, тетрациклін, кліндаміцин, триметоприм, рифампіцин, піразинамід) і багатьох інших препаратів. Це веде до зниження терапевтичної дози і терапевтичного діапазону. При хронічних захворюваннях печінки в різного ступеня змінюються захоплення, метаболізм і елімінація ряду лікарських засобів. При портокавальном шунтування знижується елімінація при першому проходженні через печінку деяких препаратів, що приймаються всередину. Зміна архітектоніки печінки і порушення внутрішньопечінкової гемодинаміки при цирозі печінки також можуть привести до зниження елімінації лікарських речовин. При гіпоальбумінемії зростає частка вільної фракції препаратів, що зв'язуються з альбуміном, а внаслідок цього - їх активність. Зниження активності ферментів може привести до уповільнення інактивації і елімінації протисудомних (фенітоїн, фенобарбітал) і протизапальних (парацетамол, фенілбутазон, глюкокортикоїди) коштів, транквілізаторів, кардіотропних засобів (лідокаїн, хінідин, пропранолол), антибіотиків (нафциллин, хлорамфенікол, тетрациклін, кліндаміцин, триметоприм, рифампіцин, піразинамід) і багатьох інших препаратів. Це веде до зниження терапевтичної дози і терапевтичного діапазону.У хворих з хронічними захворюваннями печінки можуть змінюватися не тільки фармакокінетичні властивості, а й активність лікарських засобів - так, зростає чутливість ЦНС до наркотичних анальгетиків і транквілізаторів. При гострих і хронічних захворюваннях печінки іноді буває дуже важко підібрати лікування. Так, бензодіазепіни в подібних випадках нерідко викликають печінкову кому. При цьому часто буває дуже нелегко зрозуміти, чим викликані збудження, сплутаність свідомості і зміни поведінки - ранньою стадією печінкової енцефалопатії або бензодіазепінами, наркотичними анальгетиками, барбітуратами і т. Д. Необхідно враховувати, що кліренс лікарських засобів у хворих з ураженням печінки може бути найрізноманітнішим , і тому дози слід підбирати індивідуально, орієнтуючись на сироваткову концентрацію Зниження антитоксичної функції печінки пов'язано з порушенням її метаболічної функції: 1. синтезу сечовини (знешкодження токсичної аміаку), 2. окислення (ароматичних вуглеводнів), 3. відновлення (нітробензолу в параамінофенол), 4. ацетилювання (сульфаніламідних препаратів), 5. гідролізу (алкалоїдів, серцевих глікозидів), 6. кон'югації (утворення парних сполук з глюкуроновою кислотою, глікоколу, цистеїном, таурином - для зв'язування непрямого білірубіну, скатола, фенолу, індолу і ін.). Крім того, при патології печінки порушується ще один шлях детоксикації - перетворення водонерозчинних (аполярних) речовин в розчинні (полярні) з'єднання, які можуть бути виведені з організму з жовчю і сечею. До ослаблення антитоксичної функції печінки призводить пошкодження гепатоцитів як локусів знешкодження, зменшення активності ферментів, які каталізують реакції детоксикації, і дефіцит енергії. Порушення антитоксичної функції печінки при її ураженні може призводити до підвищення чутливості організму до різних лікарських засобів - хініну, морфіну, барбітуратів, наперстянці і ін. Це пов'язано з тим, що при зменшенні їх розщеплення в печінці токсичність цих речовин для організму збільшується, викликаючи отруєння. Крім того, в процесі метаболічних перетворень токсичних з'єднань в гепатоцитах можуть утворитися ще більш токсичні речовини (синтез гепатотоксичних речовин - метаболітів ряду медикаментів, наприклад ізоніазиду; утворенню канцерогенних речовин). Порушення екскреторної функції печінки при скруті виділення жовчі також може привести до накопичення токсичних речовин в організмі. При ряді захворювань печінки, особливо при цирозах, її знешкоджуюча функція, як правило, пригнічується. Випадає функція ретикулоендотеліальної системи ( «блокада» фагоцитозу продуктами розпаду клітин), з'являються гемодинамічні зміни (портокавальние анастомози, зниження кровопостачання печінки). Результати цих порушень порівнюють з наслідками портокавального шунтування, коли системний кровотік наповнюється продуктами, які надійшли з кишечника по ворітної вени. Це призводить до ендотоксемії - виникають лихоманка, лейкоцитоз, гемоліз еритроцитів, ниркова недостатність, що є особливо актуальним при печінковій комі. Вимкнення антитоксичної функції печінки призводить до розвитку гепатоцеребральной синдрому (печінкової енцефалопатії) і найбільш важкої форми клінічного прояву печінкової недостатності - печінкової коми. Гепатоцеребральной синдром, який характеризується порушеннями психіки, свідомості і руховими розладами (тремтіння, атаксія, ригідність м'язів), може перейти в печінкову кому. Джерела: https://studfiles.net/preview/3099111/page:7/ Печень [1974 Ермолаев М.В. - Биологическая химия] http://muvrasil.ru/pechen/funkcii-pecheni http://humbio.ru/humbio/har3/001f6c8a.htm https://lektsia.com/3x7428.html |
