класс лиаз. основные представители. класс лиаз биохимия. Реферат по дисциплине Биологическая химия Класс лиаз. Основные представители, строение и роль СанктПетербург, 2020
 Скачать 81.47 Kb. Скачать 81.47 Kb.
|
|
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РФ ДЕПАРТАМЕНТ НАУЧНО-ТЕХНОЛОГИЧЕСКОЙ ПОЛИТИКИ И ОБРАЗОВАНИЯ ФГБОУ ВО «САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ВЕТЕРИНАРНОЙ МЕДИЦИНЫ» Факультет ветеринарной медицины Кафедра биохимии и физиологии РЕФЕРАТ по дисциплине Биологическая химия Класс лиаз. Основные представители, строение и роль Санкт-Петербург, 2020 ОглавлениеВведение 3 Глава 1. Номенклатура 4 Глава 2. Классификация 5 2.1. Декарбоксилазы (карбокси-лиазы) 6 2.1.1Декарбоксилазы кетокислот 6 2.1.2. Декарбоксилазы аминокислот 7 Глава 3.Механизм катализа 8 Глава 4. Биологическое значение 9 4.1. Клиническое значение 9 5. Аденилатциклаза 10 5.1. Активация 11 5.2. Инактивация 12 Заключение 14 Список литературы 15 ВведениеК этому классу относятся ферменты, действие которых удаляет определенные группы (например, аминогруппы, альдегидные группы, но чаще всего СО2) с субстратов путем простого расщепления без участия воды. В соответствии с уходящей группой эти ферменты могут называться дезаминазами, декарбоксилазами, дегидратазами и т.п. Лиазы также ускоряют присоединение определенных групп атомов в точке разрыва двойной связи. Подкласс декарбоксилазы или карбоксилазы включает два подкласса - декарбоксилазу кетокислот и декарбоксилазу аминокислот. Глава 1. НоменклатураВ общем виде названия ферментов образуются по схеме «субстрат + лиаза». Однако чаще в названии учитывают подкласс фермента. Лиазы отличаются от других ферментов тем, что в катализируемых реакциях в одном направлении участвуют два субстрата, а в обратной реакции только один. В названии фермента присутствуют слова "декарбоксилаза" и "альдолаза" или "лиаза" (пируват-декарбоксилаза, оксалат-декарбоксилаза, оксалоацетат-декарбоксилаза, треонин-альдолаза, фенилсерин-альдолаза, изоцитрат-лиаза, аланин-лиаза, АТФ-цитрат-лиаза и др.), и для ферментов, которые катализируют реакцию поглощения воды субстратом - «дегидратаза» (карбонатдегидратаза, цитратдегидратаза, сериндегидратаза и т. д.). В тех случаях, когда обнаруживается только обратная реакция или это направление реакций более значимо, слово «синтаза» присутствует в названии ферментов (малатсинтаза, 2-изопропилмалатсинтаза, цитратсинтаза, гидроксиметилглутарил-КоА-синтаза и т.д.). [1] Глава 2. КлассификацияСистематические названия ферментов этого класса образуются от названия субстрата, затем указывается расщепляемая группа, а через дефис добавляется слово лиаза. С--С-Лиазы. К этому подклассу принадлежит фруктозодифосфат-альдолаза, оксалоацетатдекарбоксилаза, аспартат -- 4-декарбоксилаза. По международной классификации и номенклатуре ферментов лиазы принадлежат к 4 классу, в пределах которого выделяют семь подклассов: КФ 4.1. - включает ферменты, которые расщепляют углерод-углеродные связи, например, декарбоксилазы (карбокси-лиазы); КФ 4.2 — ферменты, расщепляющие углерод-кислородные связи, например, дегидратазы; КФ 4.3 — ферменты, расщепляющие углерод-азотные связи (амидин-лиазы); КФ 4.4 — ферменты, расщепляющие углерод-серные связи; КФ 4.5 — включает ферменты, расщепляющие связи углерод — галоген, например, ДДТ-дегидрохлориназа; КФ 4.6 — ферменты, расщепляющие фосфор-кислородные связи, например, аденилатциклаза; КФ 4.99 — включает другие лиазы. Одна из наиболее важных групп этих ферментов - углерод-углеродные лиазы. Среди них большое значение имеют карбоксилазы. А альдегид - лиазы. Эти ферменты являются двухкомпонентными, их простетические группы во многих случаях представляют собой фосфорные эфиры водорастворимых витаминов: тиамин (B1) - карбокси - кетокислоты и пиридоксаль (B6) лиазы - в лиазы карбоксиаминокислот. [2] 2.1. Декарбоксилазы (карбокси-лиазы)2.1.1Декарбоксилазы кетокислотДекарбоксилазы кетокислот—двухкомпонентные ферменты, коферментом которых является тиаминдифосфат (витамин B1, связанный с двумя остатками фосфорных кислот). Связь между апоферментом и коферментом осуществляется за счет ионов магния. Название образуется в зависимости от кетокислоты, на которую действует данная декарбоксилаза. [3] Представителем декарбоксилаз кетокислот является пируватдекарбоксилаза (ПДК), которая осуществляет декарбоксилирование пировиноградной кислоты, с образованием уксусного альдегида. Такая реакция осуществляется только в микробных клетках, а в клетках млекопитающих и человека ПДК работает в составе мультиферментного комплекса, называемого пируватдегидрогеназой (ПДГ). В составе этого комплекса находится большое число ферментов, основными же составными частями комплекса являются пируватдекарбоксилаза, ацетилтрансфераза и НАД-зависимый пиридинфермент. 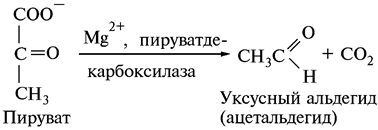 Указанные ферменты катализируют каждый свою реакцию. ПДК, например, отщепляет углекислый газ, пиридинфермент отнимает один атом водорода от карбоксильной группы пирувата, а второй атом водорода от кофермента ацетилтрансферазы. При этом выделяется энергия, которая аккумулируется в макроэргическую связь, посредством которой ацетилтрансфераза присоединяется к остатку уксусной кислоты. В результате образуется активная форма этой кислоты, которая называется ацетилКоА или АУК (активная уксусная кислота). [2] 2.1.2. Декарбоксилазы аминокислотПо химической природе декарбоксилазы аминокислот – это сложные ферменты, коферментами которых могут являться фосфопиридоксаль и пирролохинолинохинон (PQQ). ДК аминокислот являются ферментами бактерий, например, в толстом отделе кишечника у животных и человека. Эти ферменты в толстом кишечнике вызывают гниение белков, декарбоксилируя аминокислоты. В клетках человека и животных ДК аминокислот мало. Они необходимы для образования биогенных аминов, веществ, влияющих на жизнедеятельность организма. Декарбоксилирование аминокислот также происходит при разложении трупа, когда под действием катепсинов белки тканей распадаются до аминокислот, а ДК аминокислот проводят дальнейшие изменения их. Например, при декарбоксилировании гистидина образуется гистамин, триптофана – триптамин, глу – ГАМК. [4] 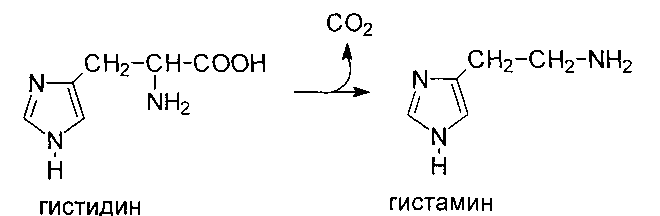 Глава 3.Механизм катализаМеханизм каталитического декарбоксилирования с помощью пиридоксальфосфата (PLP) в качестве кофактора. HDC декарбоксилирует гистидин с использованием кофактора PLP, первоначально связанного как основание Шиффа, с лизином 305. Гистидин инициирует реакцию, вытесняя лизин 305 и образуя альдимин с PLP. Затем карбоксильная группа гистидина покидает молекулу, образуя углекислый газ. Наконец, PLP повторно образует свою исходное основание Шиффа в лизине 305, и гистамин высвобождается. Этот механизм очень похож на тот, который используется другими пиридоксальзависимыми декарбоксилазами. В частности, альдимин-промежуточное соединение является общей чертой всех известных PLP-зависимых декарбоксилаз. HDC является высокоспецифичной для её гистидинового субстрата. [3]  Глава 4. Биологическое значениеГистидиндекарбоксилаза является основным биологическим источником гистамина. Гистамин является важным биогенным амином, который замедляет многочисленные физиологические процессы. Существует четыре разных рецептора гистамина: H1, H2, H3 и H4, каждый из которых несёт различное биологическое значение. H1 модулирует несколько функций центральной и периферической нервной системы, включая суточный ритм, температуру тела и аппетит. Активация H2 рецептора приводит к секреции желудочной кислоты и релаксации гладких мышц. H3 контролирует оборот гистамина путем ингибирования синтеза гистамина и его высвобождения. Наконец, H4 играет роль в хемотаксисе тучных клеток и производстве цитокинов. [5] 4.1. Клиническое значениеАнтигистаминные препараты — это класс препаратов, предназначенных для снижения нежелательных эффектов вызванных избыточной секрецией гистамина в организме. Типичные антигистамины блокируют специфические рецепторы гистамина, в зависимости от того, какую физиологическую цель они выполняют[20]. Например, дифенгидрамин, нацелен и ингибирует Н1-рецептор гистамина, и как следствие происходит облегчение симптомов аллергических реакций. Ингибиторы гистидиндекарбоксилазы могут быть предположительно использованы в качестве нетипичных антигистаминов. Было показано, что тритокуалин, а также различные катехины, такие как эпигаллокатехин-3-галлат, основной компонент зелёного чая, нацелены на HDC и гистамин-секретируемые клетки (тучные клетки, базофилы, эозинофилы и др.), снижая уровни гистамина и обеспечивая противовоспалительные, противоопухолевые и антиангиогенные эффекты. [3] 5. АденилатциклазаФермент аденилатциклаза, катализирующий превращение АТФ в цАМФ, - ключевой фермент аденилатциклазной системы передачи сигнала. Аденилатциклаза обнаружена во всех типах клеток. Фермент относят к группе интегральных белков клеточной мембраны, он имеет 12 трансмембранных доменов. Внеклеточные фрагменты аденилатциклазы гликозилированы. Цитоплазматические домены аденилатциклазы имеют два каталитических центра, ответственных за образование цАМФ - вторичного посредника, участвующего в регуляции активности фермента протеинкиназы А На активность аденилатциклазы оказывают влияние как внеклеточные, так и внутриклеточные регуляторы. Внеклеточные регуляторы (гормоны, эйкозаноиды, биогенные амины) осуществляют регуляцию через специфические рецепторы, которые с помощью α-субъединиц G-белков передают сигналы на аденилатциклазу. αs-Субъединица (стимулирующая) при взаимодействии с аденилатциклазой активирует фермент, α-субъединица (ингибирующая) ингибирует фермент. В свою очередь, аденилатциклаза стимулирует проявление ГТФ-фосфатазной активности α-субъединиц. В результате дефосфорилирования ГТФ образуются субъединицы αs-ГДФ и αi-ГДФ, не комплементарные аденилатциклазе. Из 8 изученных изоформ аденилатциклазы 4 - Са2+-зависимые (активируются Са2+). Регуляция аденилатциклазы внутриклеточным кальцием позволяет клетке интегрировать активность двух основных вторичных посредников цАМФ и Са2+. При участии аденилатциклазной системы реализуются эффекты сотни различных по своей природе сигнальных молекул - гормонов, нейромедиаторов, эйкозаноидов. Функционирование системы трансмембранной передачи сигналов обеспечивают белки: Rs-рецептор сигнальной молекулы, которая активирует аденилатциклазу, и Ri-рецептор сигнальной молекулы, которая ингибирует аденилатциклазу; Gs-стимулирующий и Gj-ингибирующий аденилатциклазу белки; ферменты аденилатциклаза (АЦ) и протеинкиназа А (ПКА). [1]  Адреналин вызывает в организме эффект, называемый «fight or flee» (бей или беги) — усиливается тонус мышц, увеличивается частота сердечных сокращений. Для мобилизации организма требуется повышение концентрации глюкозы в крови. Связывание адреналина с рецепторами на поверхности клеток печени запускает распад гликогена, запасенного в клетках печени и высвобождение глюкозы. [4] 5.1. АктивацияАдреналин связывается с β2-адренорецептором на плазматической мембране клеток печени. В результате связывания лиганда с внешней стороны плазматической мембраны, изменяется конформация всего адренорецептора и активируется сопряженный с адренорецептором, внутриклеточный G-белок. В неактивном состоянии G-белок связан с молекулой ГДФ. После активации ГДФ заменяется на ГТФ, а G-белок разделяется на две части (на α- и βγ-субъединицы). Активная часть G-белка (α-субъединица) присоединяется к ферменту аденилатциклазе и активирует её. Аденилатциклаза катализирует превращение АТФ в цАМФ. цАМФ — является вторичным посредником этой цепи передачи сигнала в клетке. Далее цАМФ распространяется по всей клетке и связывается с цАМФ-зависимой протеинкиназой А, причем с одной молекулой протеинкиназы связывается 4 молекулы цАМФ. Активированная протеинкиназа А разделяется на четыре части, две из которых обладают каталитическими активностями. Каждая из каталитических субъединиц способна фосфорилировать киназу фосфорилазы, активируя её. Наконец, киназа фосфорилазы фосфорилирует гликогенфосфорилазу. Активированная гликогенфосфорилаза расщепляет гликоген, при этом образуется глюкозо-6-фосфат, который затем дефосфорилируется и превращается в глюкозу, которая поступает в кровь. Особенность этой системы передачи сигнала в клетке состоит в том, что сигнал на большинстве этапов (кроме этапа активации протеинкизаны А молекулами цАМФ) усиливается, например, активированная аденилатциклаза синтезирует множество молекул цАМФ. В результате взаимодействия одной молекулы адреналина с рецептором в плазматической мембране клетки печени, в кровь выводится около 10 миллионов молекул глюкозы. [2] 5.2. ИнактивацияДля поддержания корректного уровня метаболизма требуется не только быстрое поступление глюкозы в кровь, но и механизм выключения этой системы. Для этого используется несколько способов. Когда концентрация адреналина в крови уменьшается, молекулы адреналина естественным образом отсоединяются от β2-адренорецептора Если адреналин не отсоединяется от β2-адренорецептора, то рецептор фосфорилируется киназой β2-адренорецептора, а затем инактивируется β-аррестином. G-белок сам обладает ферментативной активностью и медленно (в течение секунд или минут) превращает ГТФ в ГДФ. После этого он отходит от аденилатциклазы, и она инактивируется Фермент фосфодиэстераза катализирует превращение цАМФ в АМФ Ферменты фосфатазы дефосфорилируют киназу фосфорилазы и гликогенфосфорилазу. Результат действия адреналина на другие типы клеток зависит от того, какие рецепторы находятся в их плазматических мембранах. Так, например, в результате связывания адреналина c альфа-2 адренорецептором, количество цАМФ внутри клетки уменьшается. [1] ЗаключениеЭтот класс включает ферменты, при действии которых определенные группы (например, аминогруппы, альдегидные группы, но чаще СО2) удаляются из субстратов путем простого отщепления без участия воды. Соответственно удаляемой группе эти ферменты можно назвать дезаминазы, декарбоксилазы, дегидратазы и т.п. лиазы ускоряют и реакции присоединения некоторых групп атомов по месту разрыва двойной связи. Подкласс декарбоксилазы, или карбоксилиазы включает два подподкласса – декарбоксилазы кетокислот и декарбоксилазы аминокислот. Эти ферменты играют важную роль в обмене углеводов. Лиазы кетокислот (изоцитрат-лиаза) катализируют синтез ди- и трикарбоновых кислот из двух и более фрагментов. Многие из них играют важную роль в цикле трикарбоновых кислот и в глиоксилатном цикле. Углерод-кислород лиазы катализируют реакции, протекающие с расщеплением связи С—О. В этот подкласс входит группа гидро-лиаз, например, фумарат-гидратаза и энолаза, катализирующие соответствующие обратимые реакции гидратации фумаровой кислоты с образованием яблочной кислоты и фосфоенолпировиноградной кислоты с образованием 2-фосфо-D-глицерина. Ферменты этой группы катализируют также распад полисахаридов путем реакции элиминирования, например, алъгинат-лиаза деполимеризирует альгиновые кислоты с элиминированием остатков D4,5-D-мануроновой кислоты. Список литературыДиксон М., Уэбб Э., Ферменты, пер. с англ., т. 1, Москва: «Мир», 1982, с. 325-29; Е.С. Северин, Т.Л. Алейникова, Е.В. Осипов, С.А. Силаева, Биологическая химия, Москва: «Медицинское информацинное агенство», 2008, с. 396; Нельсон Д., Кокс М., Основы биохимии Ленинджера. Том 3, Москва: «Лаборатория знаний», 2011, с. 372; Чиркин А.А., Данченко Е.О., Биохимия, Москва: «Новое знание, Инфра-М», 2010, с. 604; Кухта В.К., Морозкина Т.С., Таганович А.Д., Биологическая химия, Москва: «Бином», 2008, с. 668. |
