Решение перечисленных задач возможно только при наличии достаточного количества зарегистрированных и доступных для измерения показателей, отражающих уровень качества продукции.
 Скачать 253.46 Kb. Скачать 253.46 Kb.
|
 состояние коммуникаций; состояние коммуникаций;-электрические и магнитные поля; -персонал. 
Рис. 2.9. Факторы, влияющие на качество работы аналитического прибора Температура является одним из главных управляющих воздействий на состояние объекта контроля. Она влияет на измерения характеристик состава и свойств веществ и выражается температурной погрешностью. Повышение точности измерения достигается за счёт компенсации температурной погрешности. Учёт температурной погрешности в автоматизированных системах возможен аппаратными и программными средствами, которые разрабатываются после изучения влияния температуры на процесс измерения. С этой целью снимаются зависимости изменения косвенных параметров от температуры и строятся соответствующие графики. На графике, представленном в виде прямой ( y = T ), влияние температуры на процесс измерения не отмечается, поэтому в структуре аналитического прибора система компенсации температурной погрешности не предусматривается. Из анализа других графиков следует, что влияние температурной погрешности значительное, а значит, в цепь анналитического прибора должен встраиваться соответствующий компенсатор, учитывающий температурные условия протекания технологических процессов. Встроенный компенсатор перед началом измерений всегда настраивается первым до задания режима работы аналитического канала. Для компенсации температурной погрешности в аналитических приборах применяются три способа: классический, эталонный, программный. Классический способ устранения температурной погрешности состоит в измерении температуры и параметра xi, расчёте по математической модели погрешности ∆х ср. и значения параметра х ,выражение 2.3. x = xi - ∆х ср (2.3) Для реализации этого способа аналитический прибор содержит усилитель с переменным температурным резистором (рис. 2.11), который преобразует величину выходного сигнала. При реализации этого способа в микропроцессорном аналитическом приборе в него встраивается термодатчик, преобразующий температуру в код F, рис. 2.11,а. Информация в цифровой форме заводится в микропроцессор (МП), в котором по математическим моделям рассчитывается измеренное значение xi и погрешность ∆х. Искомый параметр х отображается на индикаторе аналитического прибора. При наличии обратной связи погрешность используется для аппаратной компенсации измеренного значения. Второй способ (эталонный) термокомпенсации заключается в использовании двухканальной структуры, один канал в ней является «эталонным» (сравнительным), рис. 2.12. Измеренные параметры по двум каналам сопоставляются между собой для исключения погрешности. В микропроцессорном аналитическом приборе во второй канал включается первичный измерительный преобразователь с веществом, параметры которого нормированы. Способ программного типа состоит из сопоставления исследуемого параметра с расчетом его по математической модели. При этом в математической модели могут использоваться температурные зависимости любого из ранее перечисленных способов (классического или «эталонные»), который подходит для данного процесса. Для реализации третьего способа требуется достаточно мощное программное обеспечение, но он отличается точностью и скоростью получения результата. 3. Оптические методы анализа Оптические методы аналитического контроля относятся к группе спектрометрических методов (см. тему 1). Они основаны на использовании известных законов распространения света – поглощения, рассеяния, свечения, преломления. Явления и эффекты, возникающие при взаимодействии анализируемого вещества, и электромагнитного излучения регистрируются электронными оптическими приборами – спектрофотометрами, фотоколориметрами, нефелометрами, флуориметрами, рефрактометрами, поляриметрами. С помощью оптических методов определяются в лабораториях и контролируются на технологических линиях концентрации растворов различных веществ. 3.1 Общие сведения о спектроскопии В основе спектроскопии лежит явление испускания электромагнитного излучения атомами или молекулами определяемого вещества. Спектр электромагнитного излучения в зависимости от длины волн делят на ультрофиолетовую-180-400 нм (1 нанометр=10-9м), видимую-400-700нм, ближнюю инфрокрасную-700-1100нм области. Электромагнитное излучение - свет - имеет двойственную природу - волновую и корпускулярную (волна - частица) и для его описания используют два вида характеристик - волновые и квантовые. К волновым характеристикам относятся частота колебаний, длина волны, волновое число, а к квантовой характеристике относится энергия квантов, Частота колебаний - ν - показывает число колебаний электромагнитного излучения (света) в 1 секунду, измеряется в с-1. Длина волны λ - это путь, который проходит волной за время полного периода колебаний.  λ   Длина волны измеряется в метрах и его долях: сантиметрах – см; миллиметрах-мм; микронах-μ; миллимикронах – mμ; наномикронах - нμ (1нм =10-9 м = 10-7 см = 10-6 мм). Например, зеленый свет представляет собой электромагнитные излучения с длиной волны λ == 500 - 550 нм или 5,0 · 10 -5 - 5,5 · 10 -6 см. Частота колебаний и длина волны связаны между собой выражением 3.1; 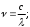 (3.1) (3.1)где: С - скорость света = 3 · 108 м/с = 3 · 1010 см/с Величина, обратная длине волны называется волновым числом – ν и может быть рассчитана по выражению 3.2. 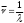 (3.2) (3.2)Для зеленого света волновое число составит 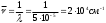 Если скорость света выражена в см/сек, длина волна в см - то частота колебаний будет выражена в герцах — Гц. Для зеленого света: 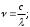 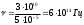 Энергия электромагнитного излучения определяется по выражению 3.3 E = h · ν , (3.3) где h - постоянная Планка, равная 6,62 · 10-34 Дж с 3.2 Атомные спектры Испускание света атомами происходит, за счет изменения энергии атомов. Атомы могут обладать только строго дискретными запасами внутренней энергии: Е0, Е1, Е2 и т.д., т.е. атомы не могут иметь энергию, промежуточную между Е0 и Е1 или между Е1 и Е2. В невозбужденном, т. е. нормальном состоянии атомы обладают минимальной энергией Е0. При подведении энергии, достаточной для возбуждения атома — электроны атома переходят на более высокий энергетический уровень Е1, Е2 и т.д. и через очень короткое время 10-8 с они самопроизвольно возвращаются в нормальное состояние и освобождающая при этом энергия излучается в виде светового кванта hν. Совокупность излучаемых частот связана с энергетическими состояниями атома. Чем меньше длина волны, тем больше волновое число или частота, тем больше энергия электромагнитного излучения. Наблюдаемые в природе электромагнитные излучения охватывают диапазон волн от десятков километров до тысячных долей ангстрема, распределение энергий излучения по длинам волн представляет спектр, который подразделяется на ряд областей, при взаимодействии с веществом излучение каждой области изменяет состояние молекулы по-разному. Это объясняется тем, что волны разных областей спектра имеют разную энергию, эта энергия действует на атом или молекулу, находящуюся в нормальном, невозбужденном состоянии и возбуждают их. Характер спектров, наблюдаемых при взаимодействии электромагнитного излучения и строением энергетических уровней атомов и молекул исследуемых веществ, различен. Основными характеристиками спектров является положение линий или полос, в шкале длин волн, а также их форма и интенсивность. Положение спектральных линий и полос зависит от расстояния между энергетическими уровнями, переходы между этими уровнями обуславливают эти линии и полосы. Строение энергетических уровней является индивидуальной характеристикой молекул (атомов, ионов) данного вещества, поэтому по положению тех или иных линий и полос в спектре можно судить о природе вещества, взаимодействующего с излучением. Интенсивность спектральных линий и полос определяется тем, сколько квантов излучения данной частоты поглощается, испускается или рассеивается веществом в единицу времени, т.е. сколько молекул вещества участвуют в данном квантовом переходе. Это позволяет проводить количественные определения различных веществ по интенсивности линий и полос спектра. Таким образом, действуя на вещество электромагнитным излучением, обладающим достаточной энергией, способной возбудить атомы - можно получить через короткий промежуток времени излучение в виде светового кванта hv (ΔЕ = hν ) Каждая спектральная линия отражает переход с одного энергетического уровня на другой. Наиболее яркой в спектре будет линия, отвечающая переходу с первого возбужденного уровня на основной уровень. Линия, отвечающая этому переходу, называется резонансной. Например, у натрия 11Na Is22s22p63s1
При возбуждении атома натрия (нагревании, облучении и т.д.) валентный электрон (3s1) может переходить на уровни р и d, находиться на них очень короткое время и возвращаться вновь на основной. Этим переходам отвечают линии с длиной волны 588, 996 и 589, 593 нм. Это излучение окрашивает пламя в желтый цвет при введении солей натрия в пламя. Это свойство атомов и ионов излучать свет в газообразном состоянии положено в основу методов эмиссионного и спектрального, где анализ основан на измерении длины волны, интенсивности и других характеристик излучений, испускаемых атомами за счет изменения их энергии. Совокупность пространственно разделенных линий называют спектром. Спектр, излучаемый раскаленными газами и парами, называется линейчатым или прерывистым, а спектр, который испускают раскаленные жидкие и твердые тела - сплошной. Линейчатый спектр каждого элемента содержит ряд спектральных линий, соответствующих испускаемым лучам, характеризующихся определенной длиной волны λ или частотой колебания ν. Наличие в спектре излучения таких линий дает возможность судить о наличии искомых элементов в исследуемом веществе, а интенсивность этих линий характеризует их количественное содержание. Цвет испускаемого или поглощаемого света зависит от длины волны. Например, наибольшая длина волны видимого света соответствует красному, а наименьшая – фиолетовому свету. При проведении качественного спектрального анализа пользуются атласом спектральных линий. В количественном анализе рассматривается связь между интенсивностью спектральной линии и концентрацией элемента в пробе. 3.3 Молекулярный спектр Появление полос поглощения обусловлено дискретностью энергетических состояний частиц, которые поглощают энергию, а также от природы электромагнитного излучения. Интенсивно поглощаются кванты света, которые соответствуют энергии возбуждения частицы. Любая молекула, в соответствии с квантовыми законами, является устойчивой в определенных стационарных состояниях. Переход молекулы из одного состояния в другое связан с получением и отдачей энергии (также как у атома). Молекула сложная система, в молекуле имеют место различные виды движения составляющих ее частиц - колебательные и вращательные. Если молекуле сообщать разные количества энергии, действуя электромагнитным излучением, то каждому из этих количеств Е=hv - будут соответствовать различные виды спектров. В отсутствии внешнего магнитного поля энергию молекулы можно представить выражением 3.4: Е = Еэл + Екол + Евр , (3.4) где: Еэл — электронная энергия молекулы, обусловлена движением электронов, принимающих участие в образовании связей, так и локализованных вокруг ядра. Екол — колебательная энергия молекулы, обусловленная колебательным движением молекул, когда при неизменном положении центра тяжести молекул - периодически изменяется положение ядер и составляющих ее частиц. Евр — вращательная энергия молекулы, обусловленная вращательным движением молекулы, когда периодически происходит изменение ориентации молекулы в пространстве и ее частей относительно друг друга. Электронная энергия значительно превышает колебательную, а колебательная – вращательную. Еэл·>> Екол > Евр По порядку величин отношение этих энергий составляет: 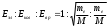 , ,где: mе- масса электрона; М –масса молекулы . Для большинства молекул mе =10-4 М = 10-5-10-5 Еэл : Екол : Езр = 1 : 10-2 : 10-4 На основании этого можно представить энергетические уровни молекул, когда каждому электронному состоянию отвечает своя система колебательных уровней, а каждому колебательному своя система вращательных уровней: Еэл вр кол вр кол 0 Еэл1 Чисто вращательные переходы, т.е. переход между вращательными уровнями соответствует наименьшему изменению энергии от единиц до сотен Дж /моль или 10-5 –10-3 Дж/моль. ΔЕвр = 10-5 · 10-3 Дж/моль При этих переходах возникает чисто вращательный спектр, которому соответствует излучение микроволновой и части дальней ИК-области шкалы электромагнитных волн. Переходам между колебательными уровнями одного и того же электронного состояния соответствует изменению энергии от единиц до сотен десятков КДж/м. При этих переходах наблюдается колебательные спектры в ближней и дальней ИК - области. Обычно при таких переходах изменяется и вращательная энергия молекул и происходит много переходов между вращательными подуровнями нижнего и верхнего колебательных уровней. В результате таких явлений в спектре возникает не одна линия, а совокупность близкорасположенных линий - образуя вращательную структуру колебательных полос (вращательно-колебательные спектры). Переход молекулы из одного электронного состояния в другое составляет сотни КДж/моль, при этом возникают электронные спектры, наблюдаемые в видимой части спектра, а также в УФ - ближней и дальней. Изменение электронного состояния молекулы сопровождается изменением колебательной и вращательной энергии, поэтому электронный молекулярный спектр состоит из совокупности колебательных полос, каждая из которых имеет вращательную структуру. Из-за существования в молекуле переходов электронного, колебательного, вращательного - возникают и соответствующие спектры (молекулярные), они называются полосатыми. Электронные спектры атомов газообразных веществ состоят из отдельных линий. Объясняется это тем, что атом не имеет колебательных и вращательных уровней энергии, а разрешенные значения электронной энергии - дискретны. Спектры атомов более просты по сравнению со спектрами молекул. Возвращение электрона в атоме из возбужденного состояния (с более высокого энергетического уровня на основной) в стабильное сопровождается выделением кванта энергии примерно равного поглощенному. Спектральные линии таких переходов лежат в области больших частот и малых длин волн. Поглощение или испускание энергии можно определить по энергетическому состоянию молекулы в начальном и конечном энергетическом переходах, выражение 3.5. ΔЕ = Е1 - Е2 = h · v, (3.5) где: Е1 — начальное состояние молекулы; Е2 — конечное состояние молекулы; h — постоянная Планка (Дж/с); v — частота излучения, поглощаемого или испускаемого при данном переходе (с-1). Если Е2 > Е1 - происходит поглощение излучения. Если Е1>Е2 - происходит испускание (эмиссия)излучения. Каждому переходу соответствует своя частота излучения и своя длина волны. Каждое вещество обладает способностью поглощать лучистую энергию в виде квантов энергии, соответствующих определенным длинам волн. В практической спектрофотометрии поглощение проводят' в ультрафиолетовой (200 - 400 нм), видимой (400 - 700 нм) и инфракрасной областях (700 - 2000 нм) спектра. Спектрофотометрический анализ основан на определении спектра поглощения или измерении светопоглощения при строго определенной длине волны, которая соответствует максимуму кривой поглощения данного вещества. Характер спектров, которые можно наблюдать при взаимодействии электромагнитного излучения с веществом, определяется энергией излучения и строением энергетических уровней молекул исследуемых веществ. Основными характеристиками спектров является положение линий или полос в шкале длин волн, их форма и интенсивность. 3.4 Классификация оптических методов анализа В оптических методах анализа используется зависимость между оптическими свойствами системы и её составом, рассматривается взаимодействие световой энергии (электромагнитного колебания) с веществом. Поглощая электромагнитные излучения, атомы или молекулы переходят в новое состояние, возбуждённое, и избыточная энергия атомов и молекул может выделяться в виде вторичного излучения или расходоваться на повышение вращательной, колебательной и др. энергии. В зависимости от вида частиц, поглощающих энергию и характера взаимодействия их с электромагнитным излучением, различают: атомно – абсорбционный анализ; молекулярно – абсорбционный анализ; флуориметрический (люминисцентный) анализ. Атомно-абсорбционный анализ, основывается на том, что атом, поглощая подведённую энергию, переходит в возбуждённое состояние и примерно через 10-8 с спонтанно переходят в нормальное состояние электроны на нижележащие энергетические уровни, при этом происходит выделение (эмиссия) в виде дискретных и характеристических для каждого вида атомов электромагнитных колебаний в видимой, ультрафиолетовой или рентгеновской областях спектра. При этом спектры носят линейчатый характер. Характеристичность линейчатых спектров лежит в основе качественного эмиссионного спектрального анализа, а функциональная зависимость между концентрацией элемента в пробе и интенсивностью его спектральных линий положена в основу количественного анализа. Молекулярно-абсорбционный анализ основан на поглощении электромагнитного излучения молекулами и сложными ионами анализируемого вещества в оптическом диапазоне спектра (ультрафиолетовой, видимой и инфракрасной областях ). В молекулярно-адсорбционной спектроскопии наблюдают и исследуют аналитические сигналы, вызванные электронными переходами внешних валентных электронов. Поглощение излучения в инфро - красной области, связанно с изменением вращения и колебания молекул. Это свойство молекул часто использует в целях идентификации различных соединений. Анализ по поглощению и рассеиванию электромагнитного излучения взвешенными частицами анализируемого вещества подразделяется на турбидиметрию и нефелометрию. При прохождении света через дисперсную гетерогенную систему происходит ослабление светового потока в результате рассеивания и поглощения этого потока частицами дисперсной фазы, выражение 3.6. J0 = Jn + Jр + J , (3.6) где: J0 — интенсивность падающего светового потока; Jn — интенсивность поглощаемого светового потока; Jр — интенсивность рассеянного светового потока; J — интенсивность прошедшего светового потока. Турбидиметрия основана на измерении интенсивности светового потока, проходящего через дисперсную систему — J. Нефелометрия основана на измерении интенсивности света, рассеянного дисперсной системой — Jр. Флуориметрический (люминесцентый) анализ, основан на измерении излучения, возникающего в результате выделения избытка энергии возбуждёнными молекулами анализируемого вещества. Для возникновения явления люминесценции молекулы вещества облучаются и переводятся из основного в возбуждённое состояние. Энергия возбуждения должна быть достаточной для осуществления излучательного электронного перехода из возбуждённого состояния в основное. Это возможно для молекул с отрицательным устойчивым возбуждённым состоянием. Фотометрия Из методов молекулярного абсорбционного анализа наибольшее распространение получили фотометрические методы анализа — фотометрия. Они основаны на избирательном поглощении электромагнитного излучения молекулами анализируемого вещества. В зависимости от используемой аппаратуры в фотометрическом анализе различают спектрофотометрический и фотоколориметрический методы анализа. Спектрофотометрический метод анализа заключается в поглощении монохроматического излучения, в котором все волны имеют одинаковую частоту — γ или длину волны — λ, а фотоколориметрический - поглощении полихроматического излучения. Оба эти метода основаны на общем принципе существования пропорциональной зависимости между светопоглощением и концентрацией поглощающего вещества, являющегося однородной системой. Любое вещество, способное отражать или поглощать электромагнитное излучение оптического диапазона (λ = 400 — 700 нм), имеет окраску. Непрерывное электромагнитное излучение в области длин волн 400 — 700 нм воспринимается глазом как белый цвет. Окраска раствора обусловлена цветом той части светового потока (потока электромагнитного излучения), которая прошла через раствор непоглощённой. Визуально наблюдаемый цвет раствора является дополнительным к цвету поглощённого излучения. Например, раствор, поглощающий жёлто-зелёную часть спектра, имеет длину волны λ = 560 — 570 нм, табл. 3.1. Сущность фотометрии заключается в том, что определяемое вещество переводится в окрашенное состояние и с помощью оптического прибора определяется степень поглощения (электромагнитного излучения) окрашенным соединением, которая зависит от концентрации определяемого вещества. Основные оптические характеристики окрашенных растворов — цвет раствора и интенсивность окраски. Фотометрический метод количественного анализа основан на способности определяемого вещества или его окрашенной аналитической формы поглощать электромагнитные излучения. Поглощение при определённой длине волны является материальным воплощением информации о качестве и количестве определяемого вещества, составляет аналитический сигнал. Возможность получения волны является материальным воплощением информации о качестве и количестве определяемого вещества, составляет аналитический сигнал. Возможность получения множества интенсивно окрашенных органических и неорганических соединений расширяют границы применения фотометрических определений в видимой области спектра с помощью довольно несложных и относительно недорогих приборов. Таблица 3.1 Цвет раствора в зависимости от поглощённой части спектра
Фотометрические методы анализа высоко чувствительны и избирательны, а используемая в них аппаратура разнообразна. Эти методы широко применяются: в системах автоматического контроля технологических процессов и готовой продукции; при анализе исходных материалов в химической и металлургической промышленности, а также горных пород и природных вод; при контроле продукции в сертификационных лабораториях,; при экологической проверке состояния окружающей среды (воздуха, почвы, воды); при диагностировании состояния людей и животных; при определении примесей (10-4 – 10-6 %) в веществах высокой чистоты. 3.5.1 Основной закон светопоглощения — закон Бугера – Ламберта – Бера Атом, ион или молекула вещества, поглощая квант света, переходит в более высокое энергетическое состояние. Обычно это — переход с основного, невозбуждённого уровня на один из более высоких уровней, чаще всего на первый возбуждённый уровень. Если часть излучения поглощается веществом, то интенсивность излучения, по мере прохождения через слой вещества, падает. Закон Бугера – Ламберта – Бера — основной закон светопоглощения связывает уменьшение интенсивности света, прошедшего через слой светопоглощающего вещества с толщиной его слоя и концентрацией в растворе. Механизм поглощения монохроматического излучения, проходящего через стеклянный сосуд с раствором, проиллюстрирован на рис. 3.1. |


 онцентрация
онцентрация