Решение перечисленных задач возможно только при наличии достаточного количества зарегистрированных и доступных для измерения показателей, отражающих уровень качества продукции.
 Скачать 253.46 Kb. Скачать 253.46 Kb.
|
|
Хроматографические Электрохимические Спектрометрические Фотометрический Электрографиметрический Газовый Люминисцентный Жидкостной Потенциометрический Газово-жидкостной Нефелометрический Кондуктометрический Турбидиметрический Ионообменный Полярографический Рефрактометрический Бумажный Вольтамперметрический Поляриметрический Тонкослойный Диэлькометрический Термокондуктометрический Радиоизотопный Рис 2. Схема классификации физических и физико - химических методов анализа Спектрометрические методы предоставляют широкие возможности для получения аналитических сигналов в различных областях спектра электромагнитного излучения – это γ–лучи, рентгеновское излучение, ультрафиолетовое (УФ), видимое и инфракрасное излучение, а также микроволновые и радиоволновые области спектра. Энергия квантов, перечисленных видов излучения, охватывает очень широкий диапазон энергии от 108 до 10-6 эВ, соответствующий диапазону частот от 1020 до 106 Гц. Природа взаимодействия столь различающихся по энергии квантов с веществом принципиально разная, этим объясняется большое число разнообразных спектрометрических методов анализа. Для решения разнообразных аналитических задач наибольшее значение имеют спектральные методы анализа, оперирующие с излучением видимого, ИК и УФ диапазонов. Эта группа относится к оптическим (фотометрическим) методам анализа и включает: спектро – фотометрический и фотоколориметрический методы, нефелометрический метод; абсорбционно – оптический метод; люминесцентный метод; поляризационно – оптический метод; рефрактометрический метод. В оптических (фотометрических) методах анализа используется связь между составом системы и ее оптическими свойствами: светопоглощением; светорассеянием; преломлением света; вращением плоскости поляризации плоско поляризованного света; вторичным свечением вещества и т.д. Спектрофотометрический и фотоколориметрический анализы основаны на способности окрашенных растворов, поглощать ультрафиолетовый, видимый или инфракрасный свет. Степень поглощения излучения зависит от концентрации вещества в растворе (абсорбционная спектроскопия). Нефелометрия основана на способности мутных растворов (содержащих взвесь – меловой раствор, дым и др.) суспензий рассеивать падающий на них пучок света. Интенсивность света рассеянного частицами зависит от концентрации и фиксируется фотоэлементами. Люминесцентный метод анализа основан на способности свойства веществ, излучать свет под воздействием различных возбуждающих факторов, установлении зависимости этого излучения от концентрации вещества. Рефрактометрический метод анализа основан на использовании явления преломления света на границе двух сред, на измерении показателя преломления или разницы показателей преломления веществ. Поляриметрический метод анализа основан на определении содержания вещества по вращению плоскости поляризации. Метод применим только для оптически активных веществ, т.е. способных вращать плоскость поляризации света. 1.3.2 Электрохимические методы анализа Электрохимические методы анализа: основаны на использовании электрохимических процессов между составом системы и ее электрохимическими характеристиками электропроводностью; электродным потенциалом; поляризацией; количеством электричества и т.д. Для протекания электрохимических процессов используются электролитические ячейки, представляющие собой систему, состоящую из электролитов и электродов, контактирующих между собой. На границе раздела фаз электрод – электролит протекает электрохимическая реакция, в результате которой образуется электродный потенциал. Электрохимические методы анализа классифицируются в зависимости от процессов происходящих на электродах: 1) методы, не связанные с электродной реакцией, измеряемый сигнал в них является откликом на изменения электрохимических свойств в объёме раствора ( низко- и высокочастотная кондуктометрия ); 2) методы, основанные на электродной реакции, в результате которой ток через границу раздела фаз не протекает и на границе раздела фаз устанавливается равновесный потенциал, величина которого зависит от концентрации компонентов, участвующих в электродной реакции (потенциометрия). 3) методы, основанные на электродной реакции между электродом и приэлектродной частью раствора, в ходе которой электроны или ионы переходят через границу раздела фаз, обуславливая возникновение тока (вольтамперметрия, амперметрия, кулонометрия, электрографиметрия). Широкий круг задач, решаемых с помощью электрохимических методов анализа, делает их конкурентоспособными по отношению к другим инструментальным методам, а в ряде случаев единственно возможными. Методы характеризуются: высокой чувствительностью (10-3 – 10-7 массовых долей определяемого компонента) - полярография, кулонометрия; широким интервалом определяемых концентраций (1 – 10-9 моль/л), избирательностью и экспрессивностью – ионометрия и ионографиметрия; относительной простотой проведения анализа и невысокой стоимостью аппаратуры – кондуктометрия и потенциометрия; возможностью концентрирования в рамках самого метода (инверсионная вольтамперметрия) или сочетания с другими методами (например, хроматографией, экстракцией); лёгкостью автоматизации всего аналитического цикла – все методы. 1.3.3 Хроматографические методы анализа Хроматографические методы анализа (хроматография) предназначены для определения качественного и количественного состава газообразных и жидких веществ. Они широко применяются в научных целях для изучения физико-химических свойств газов и растворов, а в промышленной и лабораторной практике для анализа смеси газообразных, жидких и твёрдых веществ. Методы основаны на разделении исследуемой смеси веществ между двумя несмешивающимися фазами - подвижной и неподвижной. Подвижная фаза представляет собой поток газа или жидкости, которая непрерывно перемещается вокруг неподвижной фазы (сорбента) – жидкости или твёрдого тела. В результате перемещения подвижной фазы исследуемая смесь разделяется на компоненты за счёт различной поглощаемости (сорбируемости) её составных частей при движении по слою сорбента. В зависимости от признаков классификации различаются следующие виды хроматографии: I. По агрегатному состоянию применяемой подвижной фазы: - жидкостная, газовая; 2. По состоянию неподвижной фазы газовой хроматографии - газотвердая, газожидкостная; 3 . По механизму разделения: ионообменная; адсорбционная; распределительная; осадочная; 4. По способу проведения процесса или аппаратному оформлению: колоночная; капиллярная; плоскостная. Многие физико-химические методы анализа отличаются скоростью проведения определений вследствие высокой их селективности. Чувствительность физико-химических методов анализа превосходит чувствительность графиметрического и титрометрического. Так, чувствительность спектрофотометрических определений составляет 10-3-10-4 , люминесцентного - 10-5-10-6 , полярографического метода анализа – 10-3-10-7 массовых долей (% ) определяемого компонента. Чтобы получить надежные результаты при использовании физико-химических методов анализа и наиболее полно использовать возможности этих методов, необходимо понимать как процессы химического взаимодействия, так и закономерности возникновения и измерения физических сигналов. Каждая стадия анализа, каждая его операция может быть источником случайных ошибок. Поэтому очень важно уметь оценить с помощью методов математической статистики достоверность полученных результатов анализа. Физико-химические методы анализа широко используются в практике аналитического контроля протекания химико-технологических процессов на предприятиях, в ходе анализа веществ в производственных и научных лабораториях, а также лабораториях по контролю качества и сертификации продукции. Особенности физико - химических методов аналитического контроля Первая особенность заключается в высокой скорости получения результата с помощью физических и физико-химических методов анализа. Скорость анализа на многих производствах имеет большое значение, так как позволяет корректировать технологические процессы, снижать энергетические и др. затраты. На особо опасных производствах, в гражданской обороне в военном деле скорость получения информации о выбросе (появлении или применении) токсичных веществ в воздушное пространство позволяет предотвратить появление неоправданных жертв. Современные приборы, работающие на принципах физических и физико-химических методов анализа, позволяют получать результаты, как на месте контроля, так и через несколько минут после поступления пробы в лабораторию. Вторая особенность физических и физико-химических методов анализа не связана с непосредственным определением качества продукции, но благодаря ей представляется возможностью проведения анализа веществ на расстоянии. Примерами таких анализов могут служить: анализ лунного грунта, выполненный рентгенофлуоресцентным устройством, установленным на луноходе; определение состава атмосферы, окружающей планету Венера; исследования атмосферы и грунта на Марсе, которые в настоящее время проводят специалисты США и Евросоюза с использованием методик и средст, разработанных российскими учёными. Разновидностью такого анализа является дистанционный контроль объектов нашей планеты с высокой радиоактивностью или токсичностью, а также на больших глубинах. Такие анализы находят все большее применение для контроля экологической обстановки в промышленно нагруженных районах, особенно при наличии в них ядерных и химических производств. Третья особенность физических и физико-химических методов анализа позволяет автоматизировать процесс контроля химико-технологических и других производств. Используемые оборудование и приборы работают автоматически и на основании данных анализа регулируют подачу компонентов, поддерживая определенную среду (рН-, концентрацию) в технологическом процессе. Например, при производстве NН4NОз автоматические датчики дозируют подачу NН3 и НNОз на основании автоматического анализа среды в реакторе - нейтрализаторе (NH3 + НNОз = NH4NO3+ Q). В настоящее время широко применяются автоматические газоанализаторы для контроля воздушной среды, воздуха в шахтах и колодцах, а также для определения мест утечки газов из трубопроводов или ёмкостей и решения других задач. Четвертая особенность физических и физико-химических методов анализа заключается в возможности исследования веществ без отбора пробы из анализируемого образца, т. е. без его разрушения (недеструктивный анализ). Такие виды анализа проводятся в археологии, медицине, криминалистике и т.д. Иногда такой анализ проводится в какой-то определенной точке образца - локально. Локальный анализ выполняется чаще рентгеноспектральным методом, и широко применим в археологии, криминалистике, минералогии и др. Для целей локального анализа успешно применяется техника лазерной микроспектроскопии. Пятая особенность физических и физико-химических методов анализа определяется возможностью работать с малыми количествами и концентрациями анализируемых (контролируемых) веществ, составляющих в образце менее 10-3%. Применение в этих случаях классических методов анализа невозможно. Многие приборы, применяемые в физических и физико-химических методах анализа, совмещены с компьютерами, с помощью которых осуществляется управление химико-технологическими процессами, проводятся расчеты, статистическая обработка полученных данных и решаются другие аналитические задачи. 1.5 Выбор метода анализа Выбор более рационального и точного метода лабораторного анализа вещества зависит от многих факторов и представляет довольно трудную задачу, так как обычно связан с необходимостью решения многовариантных задач. Поэтому для его проведения привлекаются специалисты высокой квалификации, знающие методики и особенности проведения анализа, а также умеющие пользоваться соответствующим оборудованием. Аналитический контроль производимого вещества в ходе протекания автоматизированных химико-технологических процессов, как правило, одновариантен для точки контроля, которых может быть достаточно много. Он осуществляется в соответствии с заранее отработанной и, как правило, отлаженной программой выпуска продукции (технологией). Вместе с тем, изменение химического состава перерабатываемых веществ и образование новых веществ, отвечающих заданным требованиям, обязывает операторов постоянно контролировать режимы процессов. При этом измеряются параметры, как промежуточных продуктов, так и соответствие выпускаемой продукции заданным требованиям, что позволяет судить о её качестве. В лабораторных условиях наиболее просто решить задачу об определении количественного содержания одного элемента (вещества) в анализируемом продукте. Если определяемый элемент является основным компонентом анализируемого объекта и его содержание велико, применяются химические методы анализа - гравиметрический или титриметрический. Если концентрация определяемого элемента очень мала, то анализ проводится с помощью физико-химических методов анализа - оптическим, электрохимическим, хроматографическим или каким либо другим. Выбор метода зависит также от того, какое количество проб подлежит анализу и с какой частотой. Единичные анализы или небольшое их количество, как правило, целесообразно проводить химическими методами. Применение инструментальных методов для единичного анализа - нецелесообразно, т.к. много времени займет предварительная калибровка аппаратуры построение градуировочных графиков, стандартных образцов для сравнения и т.д. При необходимости проведения анализа большой серии проб приблизительно одинакового состава применение инструментальных методов не только оправдано, а просто необходимо. Например, большое количество кальция в исследуемом образце определяется гравиметрическим или титриметрическим методом, относящимся к химическим методам. Причем, если нужна высокая точность, а длительность анализа не регламентируется – применяется гравиметрический (весовой) метод анализа. Если не требуется высокой точности, но нужен срочно результат - применяется титриметрический (объемный) метод анализа, в этом случае можно быстро оттитровать кальций комплексонометрически - это быстро, хотя точность анализа ниже. Очень малые содержания кальция в большой серии однотипных проб определяется инструментальными методами анализа, однако выбор метода будет зависеть от наличия соответствующей аппаратуры. Выбор метода осложняется, если анализируемое вещество содержит много сопутствующих компонентов в различных количественных соотношениях, так как приходится учитывать их химическую природу. Микроколичества цинка легко определяются полярографически, но большие количества меди и кадмия мешают этому определению, т.к. они восстанавливаются раньше цинка, поэтому медь и кадмий нужно предварительно удалить. Для проведения таких операций нужно знать свойства определяемых катионов. Если нужно провести такой анализ – применяется экстракционно-фотометрический метод с дитизоном, который образует с цинком окрашенный комплекс, экстрагируемый тетрахлоридом углерода. Этот прием проводится в присутствии насыщенного раствора тиосульфата, который образует тиосульфатные комплексы с медью и кадмием, не способные экстрагироваться тетрахлоридом углерода, а потому остаются в водном растворе. Окрашенный экстракт соединения цинка с дитизоном в среде тетрахлорида углерода - фотометрируется. Железо в растворе можно легко анализируется, применением гравиметрического метода, при этом в качестве осадителя используется гидрат аммиака. Однако этот метод нельзя применять в присутствии титана, который тоже образует нерастворимый гидроксид.В этом случае целесообразнее применить 8-оксихинолин, который полностью осаждает железо уже при рН=3, в то время как титан остается в растворе. Одним из ответственных моментов в титриметрическом методе является фиксация эквивалентной точки. Фиксация проводится, обычно, по изменению окраски индикатора. Иногда применение цветных индикаторов оказывается затруднительным или вовсе невозможным, например, при титровании мутных, сильноокрашенных или очень разбавленных растворов. А для некоторых реакций вообще не найдены соответствующие индикаторы. В таких случаях используются физико-химические методы, т.е. в ходе титрования наблюдаются не изменение окраски индикатора, а изменение электрохимических показателей титруемого раствора: электропроводности (кондуктометрическое титрование), окислительно-восстановительного потенциала (потенциометрическое титрование) и т.д. Точка эквивалентности определяется не путем визуального наблюдения за изменением окраски индикатора, а с использованием специального прибора, дающего объективные показания. Сложная аппаратура и приборы, применяемые в практике контроля качества продукции, требуют высокой эрудиции и знаний в области химии, физики, математики, знаний принципиальных схем работы применяемых приборов, умения правильно применять аппаратуру и приборы для получения объективных данных. Всё это позволит своевременно принять меры для выпуска качественной продукции, оценить её безопасность и возможные изменения при использовании, а также разрешать возникающие споры между производителем и потребителем, и при необходимости защитить интересы одной из сторон. 1.6 Сигнал как информативная функция состава вещества В основе физико-химических методов анализа лежит измерение соотношений между составом и свойствами исследуемых продуктов. В большинстве случаев эта зависимость очень сложная. Часто одно и то же свойство соответствует различным значениям состава, т.е. является многозначной функцией состава, что затрудняет использование его для аналитических целей. Поэтому в физико-химических методах анализа результаты исследований выражаются в виде диаграммы “состав-свойства” и используются только те участки, где состав определяет свойство. В ходе физических и физико-химических методах анализа измеряются величины, отражающие физико-химические свойства веществ, такие как электрическая проводимость, поглощение и преломление света и т.д. Каждое изменение регистрируется в виде аналитического сигнала, являющегося информативной функцией состава вещества, которую строят с использованием стандартных образцов. Эти сигналы регистрируются специальными приборами, позволяющими в зависимости от их интенсивности определять количество вещества в исследуемом продукте. Например, в прямой кондуктометрии таким регистрируемым аналитическим сигналом является электропроводность, которая зависит от концентрации растворенного вещества, а в методе прямой потенциометрии - сигналом является потенциал индикаторного электрода, который также зависит от концентрации определяемого вещества. В фотоколориметрии в качестве аналитического сигнала измеряется оптическая плотность серии стандартных растворов, имеющих разные концентрации, в потенциометрии – электродный потенциал и т.д. Для решения практических задач по определению качества веществ возникает специфическая, ответственная и достаточно сложная задача стандартизации (эталонирования) самих объектов анализа. Сложность задачи объясняется многообразием веществ, отличием их химического состава и физико- химических свойств. Отсутствие эталонов, идентичных анализируемым пробам, как правило, приводит к ошибкам, поэтому в лабораторной практике применяют корректирующие методы. Под стандартным образцом понимается специально приготовленное вещество, предназначенное для обеспечения правильности химического анализа. К стандартам наиболее высокого класса точности относятся образцы изготовленные централизовано, более низкий класс точности имеют стандартные образцы предприятий и лабораторий. Химический состав и физико- химические свойства стандартного образца официально аттестованы, и данные о содержании компонентов и области его применения указаны в аттестате. Если стандартный образец не имеет официального статуса, то он называется веществом сравнения. Часто в качестве эталона используются химически чистые вещества, содержащие не более 0,05% примесей. Число типов стандартных образцов, имеющих официальный статус, ограничено. Острый дефицит эталонов ощущается в таких отраслях, как органический синтез производство, пластмасс, синтетических смол и других отраслях химической промышленности. Крайне необходимы эталоны для целей мониторинга за состоянием окружающей среды. На предприятиях пищевой промышленности также должны быть соответствующие стандарты, но, судя по изменяющейся продукции, поступающей в продажу, они явно не всегда принимаются в качестве эталонов. Вероятно, контроль качества продукции производится статистическими методами, в основе которых лежит объём продажи. 1.7. Основные приемы получения результата физико-химическими методами контроля Практически во всех физико-химических методах аналитического контроля применяются два основных приема получения результата - прямыми измерениями и косвенными измерениями. 1.7.1 Прямые измерения При прямых измерениях используется зависимость аналитического сигнала от природы анализируемого вещества и его концентрации. В спектроскопии, например, длина волны спектральной линии, определяет свойство природы вещества, а количественной характеристикой является интенсивность спектральной линии. Поэтому, при проведении качественного анализа фиксируют сигнал, а при проведении количественного анализа - измеряют интенсивность сигнала. Между интенсивностью сигнала и концентрацией вещества всегда существует зависимость, которая может быть представлена выражением 1.7.1. I =K · С, (1.7.1) где: I — интенсивность аналитического сигнала; K — константа; С — концентрация вещества. В аналитической практике прямые измерения применяются наиболее часто, к ним относятся: метод градуировочного графика; метод молярного свойства; метод добавок. Метод градуировочного графика Метод градуировочного графика, применяется в большинстве физико- химических методов анализа. Для его реализации измеряется интенсивность аналитического сигнала у серии стандартных образцов или растворов и строится градуировочный график(рис.3, рис.4) функции 1.7.2. I=f (C), (1.7.2) где:I — интенсивность сигнала; C — концентрация компонента, определяемого в стандартном образце или растворе. Затем в этих же условиях измеряется интенсивность аналитического сигнала, в анализируемой пробе - Iх , и по градуировочному графику находится концентрация анализируемого образца – Сх. Если градуировочный график описывается уравнением y = b•C, то он может быть построен по одному эталону, а прямая будет выходить из начала координат. В этом случае измеряются аналитические сигналы для одного стандартного образца и пробы. Далее рассчитываются погрешности, и строится корректирующий график. Если градуировочный график строится по уравнению y = a + b•C, то необходимо использовать как минимум два эталона. Реально для уменьшения погрешности используются от двух до пяти эталонов. Интервал концентраций на градуировочном графике должен охватывать предполагаемую область анализируемых концентраций, а состав стандартного образца или раствора должен быть близок к составу анализируемого. На практике это условие редко достигается, поэтому желательно иметь широкий набор стандартных образцов разнообразного состава. В уравнении прямой y = a + b•C величина b характеризует наклон прямой и называется коэффициентом инструментальной чувствительности. Чем больше b , тем больше наклон графика и тем меньше погрешность определения концентрации. Может применяться и более сложная зависимость, кроме того, перевод функций в логарифмические координаты позволяет ослабить влияние побочных процессов и предотвращает появление ошибки. Градуировочный график должен строиться непосредственно перед измерениями, однако в аналитических лабораториях при выполнении серийных анализов используют постоянный, заранее полученный график. В этом случае необходимо проводить периодические проверки правильности результатов анализов во времени. Частота контроля зависит от величины серии проб. Так, для серии из 100 проб выполняют один контрольный анализ на каждые 15 проб. Метод добавок Когда состав пробы неизвестен или о нём имеется недостаточно данных, а также когда отсутствуют адекватные стандартные образцы, применяется метод добавок. Он позволяет в значительной степени устранить систематические погрешности, когда существует несоответствие между составом эталонов и проб. Метод добавок основан на введении в серию одинаковых по массе и объёму проб анализируемого раствора (Ах) точно известного количества определяемого компонента (а) с известной концентрацией (Са). При этом измеряется интенсивность аналитического сигнала пробы до введения ( Ix ) и после введения дополнительного компонента (Iх+а). Концентрация вещества (Сх) в исследуемом растворе рассчитывается по выражению 1.7.3 или находится графически. Ах/Ах+а = Сх/Ах+Са или Сх = Са Ах / Ах+а – Ах Число проб с добавками переменных количеств определяемого компонента может варьироваться в широких пределах. Метод молярного свойства В этом методе измеряется интенсивность аналитического сигнала нескольких стандартных образцов или растворов и рассчитывается среднее молярное свойство по выражению 1.7.4. Ā=1/ni∑I/С , (1.7.4) где: Ā – среднее молярное свойство; ni – количество измерений i-х стандартных образцов; I – интенсивность сигнала; С – концентрация Для определения концентрации анализируемого компонента измеряется интенсивность сигнала у анализируемой пробы, а расчет проводится с использованием выражения 1.7.5. 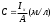 (1.7.5) (1.7.5)Метод предполагает строгое соблюдение соотношения I = А · С в области анализируемых концентраций. 1.7.2 Косвенные измерения Косвенные измерения применяются при титровании анализируемой пробы кондуктометрическим, потенциометрическим и некоторыми другими методами. В этих методах в процессе титрования измеряется интенсивность аналитического сигнала - I и строится кривая титрования в координатах I - V, где V - объем добавляемого титранта в мл. По кривой титрования находится точка эквивалентности и проводится расчет, по соответствующим аналитическим выражениям 1.7.6. Q в-ва = Т г/мл · Vмл(экв) 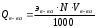 (1.7.6) (1.7.6)Виды кривых титрования весьма многообразны, они зависят от метода титрования (кондуктометрическое, потенциометрическое, фотометрическое и т.д.), а также от интенсивности аналитического сигнала, зависящего от отдельных влияющих факторов. 2. Автоматизация аналитического контроля продукции химико-технологических производств Автоматизированный аналитический контроль является обязательным элементом управления химико-технологическими процессами автоматизированных производств различной продукции. Он выполняется проведением определённой совокупности операций, контролирующих протекание технологических процессов непрерывного получения продукции заданного качества Контроль представляет собой процесс измерения параметров продукции, объединённый с принятием решения на применение предупреждающих и корректирующих действий, рис. 2.1., Технологическая система производства Управляющий орган |
