Химия задача. Решение в данном соединении комплексообразователь Fe
 Скачать 183.02 Kb. Скачать 183.02 Kb.
|
Р е ш е н и еа) Реакция гетерогенная, тогда согласно закону действующих масс для химической кинетики кинетическое уравнение будет иметь вид: v = k ∙ {C(H2)}1 (твердые вещества не входят в кинетическое уравнение, кинетический порядок по реагентам для элементарных реакций совпадает со стехиометрическими коэффициентами). Данная реакция является реакцией первого порядка по водороду, общий кинетический порядок реакции – первый. Увеличение давления приводит к пропорциональному увеличению концентрации газообразных участников процесса, тогда после увеличения давления в 2 раза v´ = k ∙ {2 ∙ C(H2)}1 = 2 ∙ k ∙ C(H2) = 2v, т.е. скорость реакции увеличится в 2 раза. б) Реакция гомогенная, кинетическое уравнение имеет вид: v = k ∙ {C(H2)}1 ∙ {С(С2Н4)}1. Данная реакция является реакцией первого порядка по водороду и первого порядка по этилену, общий кинетический порядок реакции – второй. После увеличения давления в 2 раза: v´ = k ∙ {2 ∙ C(H2)}1 ∙ {2 ∙ С(С2Н4)}1 = 4 ∙ k ∙ C(H2) ∙ С(С2Н4) = 4v, т.е. скорость реакции увеличится в 4 раза. Пример 4.2. Для реакции аА + bB → Продукты при увеличении концентрации вещества А в 2 раза скорость реакции выросла в 4 раза, а при увеличении концентрации вещества В в 3 раза скорость реакции не изменилась. определите кинетический порядок по реагентам и общий кинетический порядок реакции; рассчитайте константу скорости реакции, если при концентрациях веществ А и В, равных 0,25 и 1,2 моль/л соответственно, скорость реакции составила 31,25 моль/(л ∙ мин); 3) приведите кинетическое уравнение реакции. Р е ш е н и еСогласно закону действующих масс для химической кинетики кинетическое уравнение для приведенной реакции в общем виде будет иметь вид:  v = k ∙ {C(A)} x ∙ {C(B)} y, v = k ∙ {C(A)} x ∙ {C(B)} y, где х – кинетический порядок реакции по веществу А, у – кинетический порядок реакции по веществу В. х и у найдем на основе данных о влиянии изменения концентрации каждого реагента на скорость реакции. а) Для вещества А: Рассчитаем константу скорости, используя данные из условия задачи и приведенное выше кинетическое уравнение:  v = k ∙ {C(A)}2; v = k ∙ {C(A)}2; 31,25 = k ∙ 0,252, откуда k = 500 л/(моль ∙ мин). Единицу измерения константы скорости определили, исходя из анализа размерностей: [моль/(л ∙ мин)] = [k] ∙ [моль/л]2. Откуда [k] = [л/(моль ∙ мин)]. Окончательный вид кинетического уравнения приведенной реакции имеет вид:  v = 500 ∙ {C(A)}2. v = 500 ∙ {C(A)}2. Оно позволяет рассчитать скорость реакции при заданных значениях концентраций реагентов А и В. Пример 4.3. а) Как изменится скорость химической реакции при изменении температуры от 10 до 50 оС, если температурный коэффициент этой реакции γ = 2. б) При температуре 20 оС реакция заканчивается за 24 мин. Определите время протекания этой реакции при температуре 50 оС, если температурный коэффициент γ = 2. в) При повышении температуры с 20 до 50 оС скорость реакции увеличилась в 81 раз. Рассчитайте температурный коэффициент γ этой реакции. Пример 4.4. а) Вычислите энергию активации некоторой реакции второго порядка, если ее константа скорости при 647 К и 700 К равна 8,97 ∙ 10‒5 и 1,21 ∙ 10‒3 л/(моль ∙ с) соответственно. б) Константа скорости реакции первого порядка при Т = 405 К равна 4,15 ∙ 10‒5 с‒1. Вычислите константу скорости при 450 К, если энергия активации этой реакции равна 125,0 кДж/моль. Пример 5.1. Найдите массу AlCl3, необходимую для приготовления 2 л (2·10-3 м3) раствора с массовой долей хлорида алюминия равной 12 %. Плотность раствора 1090 кг/м3. Вычислите молярную концентрацию эквивалента и молярную концентрацию этого раствора. Р е ш е н и е 1. Определяем молярную массу и молярную массу эквивалента AlCl3: M (AlCl3) = 133,5 г/моль, MЭ (AlCl3) = 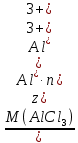 . . 2. Находим массу AlCl3, необходимую для приготовления 2 л его раствора с массовой долей 12 %. Преобразуем формулу 1: 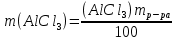 Масса раствора равна произведению объема раствора (Vр-ра) на его плотность (ρ): 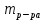 = 2 л · 1090 г/л = 2180 г. = 2 л · 1090 г/л = 2180 г. Тогда 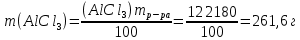 3. Рассчитаем молярную концентрацию раствора: 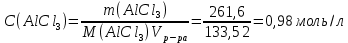 4. Определим молярную концентрацию эквивалента: 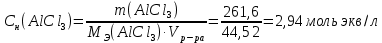 Пример 5.2. Вычислите водородный показатель (рН): а) раствора соляной кислоты HCl, содержащей 0,0365 г HCl в 100 мл раствора; б) раствора гидроксида калия КОН, содержащего 0,056 г КОН в 100 мл раствора. Известно, что степень диссоциации α = 1 для обоих растворов. Р е ш е н и е а) Рассчитаем концентрацию раствора НСl. В первую очередь определим, сколько молей HCl содержится в 100 мл данного раствора. Молярная масса HCl равна 36,5 г/моль. n(HCl) 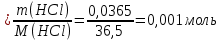 . .Найдем, сколько молей НСl содержится в 1 л раствора по пропорции: В 100 мл раствора содержится 0,001 моль НСl, в 1000 мл раствора содержится х моль НСl, х = 0,01 моль Таким образом получили, что концентрация соляной кислоты C(HCl) = 0,01 моль/л. Учитывая, что соляная кислота является сильным электролитом при диссоциации которой образуется 1 моль H+ по уравнению HCl  H+ + Cl, то можно записать: C(HCl) C(H+) = 0,01 моль/л. H+ + Cl, то можно записать: C(HCl) C(H+) = 0,01 моль/л.Зная молярную концентрацию раствора можно рассчитать его рН по формуле: рН = –lg C(H+) = –lg 0,01 = –lg 10-2 = 2. б) Находим концентрацию раствора КОН. В первую очередь рассчитаем, сколько молей КОН содержатся в 100 мл данного раствора. Молярная масса КОН равна 56 г/моль. n(KOH) = 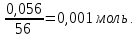 Найдем, сколько молей КОН содержится в 1 л раствора. В 100 мл раствора содержится 0,001 моль КОН. В 1000 мл раствора содержится х моль КОН, х = 0,01 моль. Таким образом получили, что концентрация КОН: С(KOH) = 0,01 моль/л. Учитывая, что гидроксид калия является сильным электролитом при диссоциации которого образуется 1 моль OH по реакции KOH 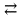 K+ + OH, то можно записать: C(KOH) С(OH)= 0,01 моль/л. K+ + OH, то можно записать: C(KOH) С(OH)= 0,01 моль/л.Исходя из ионного произведения воды (5.11), находим концентрацию ионов водорода: 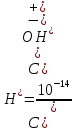 рН раствора рассчитываем по формуле (5.12): рН = –lg C(H+) = –lg 10-12 = 12. Пример 5.3. Составьте молекулярные и ионно-молекулярные уравнения гидролиза солей: а) нитрата аммония NH4NO3; б) сульфита лития Li2SO3; в) ацетата алюминия Al(CH3COO)3. Напишите выражение для константы гидролиза и оцените рН среды. Р е ш е н и е а) При растворении в воде соль NH4NO3 диссоциирует на ионы: NH4NO3 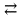 NH + NO. NH + NO.В первую очередь определим какие ионы соли связывают ионы воды (Н+ и ОН  ) в малодиссоциирующее соединение. В приведенном примере ион NH связывает гидроксид ион образуя молекулы слабого основания NH4OH. ) в малодиссоциирующее соединение. В приведенном примере ион NH связывает гидроксид ион образуя молекулы слабого основания NH4OH. Уравнение гидролиза в молекулярной форме NH4NO3 + Н2О 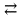 NH4OH + HNO3. NH4OH + HNO3.Полное молекуляно-ионное уравнение 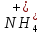 + + 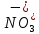 + Н2О + Н2О 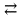 NH4OH + H+ + NH4OH + H+ + 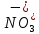 Сократим одинаковые ионы в разных частях уравнения и получим сокращенное ионное уравнение гидролиза NH4NO3 NH + Н2O 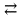 NH4OH + H+. NH4OH + H+.Реакция среды кислая, рН < 7, т.к. в продуктах реакции в свободном виде присутствует ион H+. Запишем константу гидролиза для сокращенного ионного уравнения учитывая, что данная система находится в состоянии равновесия: 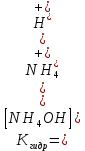 б) Сульфит лития при растворении в воде диссоциирует Li2SO3 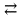 2Li+ + SO. 2Li+ + SO.Ионы SO связывают Н+ - ионы воды ступенчато, образуя вначале кислые ионы HSO, далее молекулы слабой кислоты H2SO3. Практически гидролиз соли ограничивается первой ступенью Li2SO3 + H2O 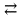 LiHSO3 + LiOH LiHSO3 + LiOH2Li+ + SO+ H2O 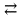 Li+ + HSO + Li+ + OH Li+ + HSO + Li+ + OHSO + H2O 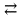 HSO + OH, HSO + OH,Из сокращенного ионного уравнения следует, что при гидролизе соли Li2SO3 в растворе накапливаются ионы OH, среда щелочная, рН > 7. Запишем выражение константы гидролиза: 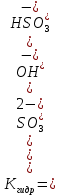 в) Соль ацетата алюминия диссоциирует, образуя ионы Al(CH3COO)3 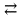 Al3+ + 3CH3COO. Al3+ + 3CH3COO.Ионы Al3+ и ион СН3СОО  взаимодействуют с ионами воды, образуя малорастворимое соединение Al(OH)3 и малодиссоциирующее соединение СН3СООН. Соли, образованные при взаимодействии слабой кислоты и слабого основания, гидролизуются необратимо и полностью. взаимодействуют с ионами воды, образуя малорастворимое соединение Al(OH)3 и малодиссоциирующее соединение СН3СООН. Соли, образованные при взаимодействии слабой кислоты и слабого основания, гидролизуются необратимо и полностью.Al(CH3COO)3 + 3H2O Al(OH)3 + 3CH3COOH. рН раствора Al(CH3COO)3 зависит от соотношения 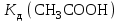 и и 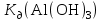 . Сравним константы диссоциации полученных веществ (табл. П.6) . Сравним константы диссоциации полученных веществ (табл. П.6) 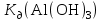 < < 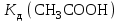 1,3810-9 1,7510-5, следовательно, реакция среды слабо-кислая, поэтому у таких солей часто обозначается рН 7. Константа гидролиза: 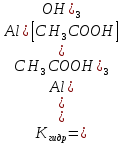 . .Пример 5.4. Образуется ли осадок малорастворимого соединения CaF2, если смешать равные объемы растворов Ca(NO3)2 и HF с молярной концентрацией 0,003 моль/л? Р е ш е н и е Запишем реакцию, которая происходит при смешивании двух растворов в молекулярном и сокращенном ионно-молекулярном виде: Ca(NO3)2 + 2HF CaF2 + 2HNO3 Ca2+ + 2 F CaF2 Тогда произведение растворимости CaF2: ПР(CaF2) = [Ca2+]·[ F]2 = 4,0· 10-11 . Найдем концентрацию ионов в растворе. При смешении равных объемов двух растворов общий объем увеличился в 2 раза, а следовательно концентрация каждого из растворенных веществ уменьшилась вдвое, т.е.: С(Ca(NO3)2)= 1,5·10-3 моль/л; C(HF) = 1,5·10-3 моль/л. Концентрации ионов Са2+ и F соответственно равны С(Ca2+) = 1,5·10-3 моль/л; C(F) = 1,5·10-3 моль/л; Находим произведение концентраций ионов Са2+ и F с учетом выражения ПР: С(Ca2+) ·C2(F) = 1,5·10-3 (1,5·10-3)2 = (1,5·10-3)3 = 3,3710-9. Получаем значение 3,37·10-9 ПР(CaF2) = 4,0· 10-11, т.е. осадок CaF2 образуется. |
