Химия задача. Решение в данном соединении комплексообразователь Fe
 Скачать 183.02 Kb. Скачать 183.02 Kb.
|
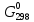 участников реакции участников реакции (табл. П 1): Zn(т) + 2Cu(OH)2(т) = ZnO(т) + Cu2O(т) + 2H2O(ж) ∆ 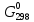 ,кДж/моль, 0 –356,9 –318,2 –146,4 – 237,3 ,кДж/моль, 0 –356,9 –318,2 –146,4 – 237,3Рассчитываем Δ 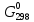 реакции согласно закону Гесса: реакции согласно закону Гесса:Δ 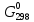 = [Δ = [Δ 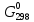 (ZnO (т))+ Δ (ZnO (т))+ Δ 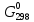 (Cu2O (т)) + 2·Δ (Cu2O (т)) + 2·Δ 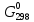 (H2O (ж))] – (H2O (ж))] –– Δ 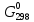 (Zn (т)) – 2 Δ (Zn (т)) – 2 Δ 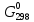 (Cu(OH)2 (т)) = [(–318,2) + (–146,4) + (Cu(OH)2 (т)) = [(–318,2) + (–146,4) ++ 2·(– 237,3)] – 2·(–356.9) = –225,6 кДж/моль. Полученное отрицательное значение ∆G0298 показывает, что реакция протекает самопроизвольно в прямом направлении. Величину ЭДС рассчитываем по формуле Томсона: ЭДС = 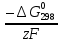 = – = – 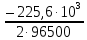 = 1,1658 B. = 1,1658 B.Определим степени окисления всех элементов в уравнении реакции 0 +2 –2 +1 +2 –2 +1 –2 +1 –2 Zn(т) + 2 Cu(OH)2 (т) → ZnO(т) + Cu 2O(т) + 2 H2O(ж) Поскольку большая часть веществ находится в твердой фазе, реакции на электродах сначало укажем схематически: Анод: Zn – 2ē = Zn+2 – окисление Катод: Cu+2 + ē = Cu + – восстановление  Суммарная реакция Zn0 + 2Cu2+ = Zn2+ + 2Cu+. Суммарная реакция Zn0 + 2Cu2+ = Zn2+ + 2Cu+.2 ē Более полно реакции на электродах имеют вид: Анод: Zn0(т) + 2OH–(р) – 2е = ZnO (т) + Н2О (ж). Катод: 2Cu(OH)2 (т) + 2Н+(р) + 2е = Cu2O (т) + 3Н2О (ж). Cхема гальванического элемента: (А) Zn | ZnO(т), H2O(ж) || Cu(OH)2(т) | Cu2O(т), H2O(ж) (К). Пример 6.4. Составьте схему работы гальванического элемента, образованного двумя данными металлами, погруженными в растворы солей с известными концентрациями ионов, рассчитайте ЭДС этого элемента. Дано: Cr, Pb; растворы CrCl3 и Pb(NO3)2; С(Сr3+) = 0,01 M; С(Pb2+) = 0,001 M. Р е ш е н и е Для составления схемы гальванического элемента, необходимо рассчитать значения потенциалов двух электродов при данных условиях по уравнению Нернста (6.4). Для первого электрода: E(Cr3+/Cr) = E0(Cr3+/Cr) + 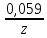 lg C(Cr3+) = lg C(Cr3+) = –0,740 + 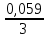 lg0,01 = –0,70 B. lg0,01 = –0,70 B.Для второго электрода: E(Pb2+/Pb) = E0(Pb2+/Pb) + 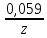 lg C(Pb2+) = lg C(Pb2+) = –0,126 + 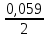 lg 0,001 = –0,124 B. lg 0,001 = –0,124 B.В данном гальваническом элементе более отрицательным электродом является система Cr|Cr3+, более положительным – Pb|Pb2+. На электродах протекают следующие реакции: Анод: Cr – 3ē = Cr+3 – окисление; Катод: Pb+2 + 2ē = Pb0 – восстановление. Электродвижущая сила этого элемента рассчитывается по формуле 6.1: ЭДС = Е(Pb2+/Pb) – E(Cr3+/Cr) = –0,124 – (–0,70) = 0,576 B. Схема гальванического элемента примет вид: (А) Cr | CrCl3 (0,01 M) || Pb(NO3)2 (0,001 M) | Pb (К). Пример 6.5. При электролизе раствора CoSO4 током I = 4,25 А масса катода возросла на 1,50 г. Рассчитайте количество электричества, если выход по току металла Bi = 75 % и время, за которое оно пропущено. Составьте схему электролиза раствора CoSO4: а) c нерастворимым анодом; б) с растворимым анодом. Р е ш е н и е Составим схему электролиза с нерастворимым анодом. В растворе присутствуют следующие ионы: CoSO4 → Co2+ + 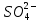 (электролитическая диссоциация); (электролитическая диссоциация);Следовательно, при составлении схемы электролиза необходимо учитывать ионы Со2+, 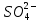 – и молекулы воды. – и молекулы воды. Так как стандартный потенциал кобальта равен E0(Co2+/Co)= – 0,28В (табл. П 2), то на катоде будет восстанавливаться металл и выделяться водород (табл.6.1). На аноде 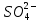 (кислородсодержащий анион) не может окисляться (табл.6.2), поэтому будет окисляться вода с выделением кислорода. Образовавшиеся ионы водорода при взаимодействии с сульфат-анионами образуют в растворе серную кислоту. (кислородсодержащий анион) не может окисляться (табл.6.2), поэтому будет окисляться вода с выделением кислорода. Образовавшиеся ионы водорода при взаимодействии с сульфат-анионами образуют в растворе серную кислоту. Схема электролиза водного раствора CoSO4 с нерастворимым (инертным) анодом:
CoSO4 + 2Н2О → Со + H2 + О2 + H2SO4. Из-за выделения водорода на катоде совместно с восстанов-лением ионов Со(II) выход по току металла меньше 100 %. Рассмотрим схему электролиза с растворимым кобальтовым анодом:
Co + 2Н2О → Со(OH)2 + H2 . Количество электричества по закону Фарадея составит: Q = 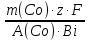 = = 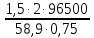 = = 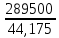 = 6553,48 Кл. = 6553,48 Кл.Оно пропущено в течение времени τ: Q = I∙ τ τ = 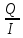 = = 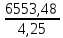 = 1541,9 c (0,43 ч.) = 1541,9 c (0,43 ч.)Решение типовых задач Пример 6.1. Определите тип окислительно-восстановительной реакции, степень окисления окислителя и восстановителя. Рассмотрим три окислительно-восстановительной реакции: а) 2KMnO4 + H2O2 + 2NaOH → Na2MnO4 + K2MnO4 + O2 +2H2O Р е ш е н и е Определим степени окисления всех элементов: +1 +7 -2 +1 -1 +1 -2 +1 +1 +6 -2 +1 +6 -2 0 +1 -2 2K Mn O4 + H2O2 + 2Na O H → Na2 Mn O4 + K2 Mn O4 + O2 +2H2O Степень окисления марганца понижается от Mn+7 до Mn+6, следовательно, марганец принимает электрон, восстанавливается, является окислителем. Степень окисления кислорода повышается от O–1 до O0, следовательно, кислород отдает электрон, окисляется, является восстановителем. Данная ОВР является межмолекулярной, протекает с изменением степени окисления 2-х элементов (марганца и кислорода) содержащихся в разных молекулах. б) (NH4 )2Cr2O7 → N2 + Cr2O3 + 4H2O Определим степени окисления всех элементов: –3+1 +6 –2 0 +3 –2 +1 –2 (NH4 )2Cr2O7 → N2 + Cr2O3 + 4H2O Видим, что степень окисления поменяли два элемента в одной молекуле. Степень окисления хрома понизилась от Cr+6 до Cr+3, следовательно, хром принимает 3 электрона, восстанавливается, является окислителем. Степень окисления азота повысилась от N–3 до N0, следовательно, азот отдает 3 электрона, окисляется, является восстановителем. Данная ОВР является внутримолекулярной, изменяют степени окисления разные элементы (хром и азот) в одной молекуле. в) 3HNO2 → HNO3 + 2NO + H2O Определим степени окисления всех элементов: +1 +3 –2 +1 +5 –2 +2 –2 +1 –2 3 H N O2 → H N O3 + 2 N O + H2O Степень окисления поменял один и тот же элемент – азот. В первом случае степень окисления азота повысилась от N+3 до N+5, следовательно, азот отдает 2 электрона, окисляется, является восстановителем. Во втором случае степень окисления азота понизилась от N+3 до N+2, следовательно, азот принимает электрон, восстанавливается, является окислителем. Данная ОВР является реакцией диспропорционирования – один и тот же элемент (азот) меняет степень окисления.   Р е ш е н и е Метод ионно-электронного баланса, который так же называют методом полуреакций, учитывает не отдельные атомы, а ионы и молекулы, которые входят в окислительно-восстановительную систему и среду. Этот способ рассматривает реально происходящие процессы, при изменении состава и зарядов, реально существующих в растворах молекул и ионов. В ходе ОВР происходит изменение не только зарядов ионов и их состава, но и среды. Поэтому, в реакцию с молекулами или ионами окислителя и восстановителя могут вступать или быть продуктами реакций: 1) молекулы воды, ионы H+ (в кислой среде) 2) молекулы воды, ионы H+ и OН– (в нейтральной среде) 3) молекулы воды, ионы OН– (в щелочной среде). Основные этапы при составлении ионно-электронного баланса: 1. Определить степень окисления каждого элемента, указав окислитель и восстановитель; 2. Составить ионно-молекулярную схему данной реакции, в которой сильные электролиты записываются в виде ионов, слабые электролиты, нерастворимые вещества и газы в молекулярном виде; 3. Написать раздельно процессы окисления и восстановления, уравнивая число атомов кислорода; 4. Уравнять заряды с помощью прибавления электронов в правую и левую часть и установить баланс электронов; 5. Суммировать ионно-молекулярные реакции с полученными коэффициентами; 6. Уравнять реакцию в молекулярном виде, добавляя в правую и левую часть одинаковое число ионов, не участвующих в процессах окисления и восстановления. 1) Рассмотрим метод ионно-электронного баланса для ОВР, которая протекает в кислой среде. HNO3 + H2S → NO + S + H2O. Определив степень окисления каждого элемента, видим, что HNO3 – окислитель (N+5), H2S – восстановитель (S-2). +1 +5 –2 +1 –2 +2 –2 0 +1 –2 H N O3 + H2 S → N O + S + H2 O. Составив ионно-молекулярную схему данной реакции, получаем: H+ + NO3– + H2S → NO + S + H2O Затем напишем полуреакции окисления-восстановления. В кислой среде для уравнивания используются ионы водорода, добавляемые к окисленной форме, и молекулы воды, добавляемые к восстановленной форме. Справа от линии указываются коэффициенты, которые уравнивают количество отданных и принятых электронов. Общее число электронов, участвующих в окислительно-восстановительной реакции равно 6. Затем записывается суммарное уравнение с учетом коэффициентов:
Сократив ионы водорода и подставив найденные коэффициенты, уравниваем реакцию: 2NO3– + 2H+ + 3H2S → 2NO + 4H2O + 3S 2HNO3 + 3H2S → 2NO + 3S + 4H2O. Находим значения стандартных электродных потенциалов окислителя и восстановителя (табл.П 2): потенциал окислителя Е0 (NO3–,4H+/NO,2H2O) = 0,957 B; потенциал восстановителя Е0 (H2S/S,2H+) = 0,171 B. Так как потенциал окислителя больше потенциала восстановителя, делаем вывод, что реакция протекает слева направо. Это подтверждают и расчёты, используя формулы (6.1 и 6.2): ЭДС = Е0 (NO3–,4H+/NO,2H2O) – Е0 (H2S/S,2H+) = 0,957 – 0,171 = = 0,786 B. Δ | ||||||||||||||||
