Химия задача. Решение в данном соединении комплексообразователь Fe
 Скачать 183.02 Kb. Скачать 183.02 Kb.
|
Р е ш е н и е(Твердые вещества не входят в выражение константы равновесия!) 2) В соответствии с принципом смещения химического равновесия Ле Шателье: а) Увеличение концентрации одного из веществ, участвующих в равновесном процессе, ускоряет тот процесс, в котором это вещество расходуется. Равновесие смещается в том же направлении. В данном случае увеличение концентрации СО ускоряет реакцию по его расходованию (т.е. слева направо) и приведет к смещению равновесия вправо, в сторону продуктов реакции; б) Повышение температуры приводит к смещению равновесия в сторону эндотермической реакции. В рассматриваемом случае прямая реакция экзотермическая (). Соответственно, обратная реакция будет эндотермической. Таким образом, при повышении температуры равновесие в данном случае сместится влево, в сторону реагентов. в) Увеличение внешнего давления приводит к смещению равновесия в сторону меньших объемов (меньшего числа молей газообразных участников равновесного процесса). В данном случае в левой части уравнения 2 моль газов, в правой части – 1 моль. Следовательно, повышение давления приведет к смещению равновесия вправо, в сторону продуктов реакции. Решение типовых задач Пример 6.1. Определите тип окислительно-восстановительной реакции, степень окисления окислителя и восстановителя. Рассмотрим три окислительно-восстановительной реакции: а) 2KMnO4 + H2O2 + 2NaOH → Na2MnO4 + K2MnO4 + O2 +2H2O Р е ш е н и е Определим степени окисления всех элементов: +1 +7 -2 +1 -1 +1 -2 +1 +1 +6 -2 +1 +6 -2 0 +1 -2 2K Mn O4 + H2O2 + 2Na O H → Na2 Mn O4 + K2 Mn O4 + O2 +2H2O Степень окисления марганца понижается от Mn+7 до Mn+6, следовательно, марганец принимает электрон, восстанавливается, является окислителем. Степень окисления кислорода повышается от O–1 до O0, следовательно, кислород отдает электрон, окисляется, является восстановителем. Данная ОВР является межмолекулярной, протекает с изменением степени окисления 2-х элементов (марганца и кислорода) содержащихся в разных молекулах. б) (NH4 )2Cr2O7 → N2 + Cr2O3 + 4H2O Определим степени окисления всех элементов: –3+1 +6 –2 0 +3 –2 +1 –2 (NH4 )2Cr2O7 → N2 + Cr2O3 + 4H2O Видим, что степень окисления поменяли два элемента в одной молекуле. Степень окисления хрома понизилась от Cr+6 до Cr+3, следовательно, хром принимает 3 электрона, восстанавливается, является окислителем. Степень окисления азота повысилась от N–3 до N0, следовательно, азот отдает 3 электрона, окисляется, является восстановителем. Данная ОВР является внутримолекулярной, изменяют степени окисления разные элементы (хром и азот) в одной молекуле. в) 3HNO2 → HNO3 + 2NO + H2O Определим степени окисления всех элементов: +1 +3 –2 +1 +5 –2 +2 –2 +1 –2 3 H N O2 → H N O3 + 2 N O + H2O Степень окисления поменял один и тот же элемент – азот. В первом случае степень окисления азота повысилась от N+3 до N+5, следовательно, азот отдает 2 электрона, окисляется, является восстановителем. Во втором случае степень окисления азота понизилась от N+3 до N+2, следовательно, азот принимает электрон, восстанавливается, является окислителем. Данная ОВР является реакцией диспропорционирования – один и тот же элемент (азот) меняет степень окисления.   Р е ш е н и е Метод ионно-электронного баланса, который так же называют методом полуреакций, учитывает не отдельные атомы, а ионы и молекулы, которые входят в окислительно-восстановительную систему и среду. Этот способ рассматривает реально происходящие процессы, при изменении состава и зарядов, реально существующих в растворах молекул и ионов. В ходе ОВР происходит изменение не только зарядов ионов и их состава, но и среды. Поэтому, в реакцию с молекулами или ионами окислителя и восстановителя могут вступать или быть продуктами реакций: 1) молекулы воды, ионы H+ (в кислой среде) 2) молекулы воды, ионы H+ и OН– (в нейтральной среде) 3) молекулы воды, ионы OН– (в щелочной среде). Основные этапы при составлении ионно-электронного баланса: 1. Определить степень окисления каждого элемента, указав окислитель и восстановитель; 2. Составить ионно-молекулярную схему данной реакции, в которой сильные электролиты записываются в виде ионов, слабые электролиты, нерастворимые вещества и газы в молекулярном виде; 3. Написать раздельно процессы окисления и восстановления, уравнивая число атомов кислорода; 4. Уравнять заряды с помощью прибавления электронов в правую и левую часть и установить баланс электронов; 5. Суммировать ионно-молекулярные реакции с полученными коэффициентами; 6. Уравнять реакцию в молекулярном виде, добавляя в правую и левую часть одинаковое число ионов, не участвующих в процессах окисления и восстановления. 1) Рассмотрим метод ионно-электронного баланса для ОВР, которая протекает в кислой среде. HNO3 + H2S → NO + S + H2O. Определив степень окисления каждого элемента, видим, что HNO3 – окислитель (N+5), H2S – восстановитель (S-2). +1 +5 –2 +1 –2 +2 –2 0 +1 –2 H N O3 + H2 S → N O + S + H2 O. Составив ионно-молекулярную схему данной реакции, получаем: H+ + NO3– + H2S → NO + S + H2O Затем напишем полуреакции окисления-восстановления. В кислой среде для уравнивания используются ионы водорода, добавляемые к окисленной форме, и молекулы воды, добавляемые к восстановленной форме. Справа от линии указываются коэффициенты, которые уравнивают количество отданных и принятых электронов. Общее число электронов, участвующих в окислительно-восстановительной реакции равно 6. Затем записывается суммарное уравнение с учетом коэффициентов:
Сократив ионы водорода и подставив найденные коэффициенты, уравниваем реакцию: 2NO3– + 2H+ + 3H2S → 2NO + 4H2O + 3S 2HNO3 + 3H2S → 2NO + 3S + 4H2O. Находим значения стандартных электродных потенциалов окислителя и восстановителя (табл.П 2): потенциал окислителя Е0 (NO3–,4H+/NO,2H2O) = 0,957 B; потенциал восстановителя Е0 (H2S/S,2H+) = 0,171 B. Так как потенциал окислителя больше потенциала восстановителя, делаем вывод, что реакция протекает слева направо. Это подтверждают и расчёты, используя формулы (6.1 и 6.2): ЭДС = Е0 (NO3–,4H+/NO,2H2O) – Е0 (H2S/S,2H+) = 0,957 – 0,171 = = 0,786 B. Δ 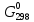 = – z∙F ∙ЭДС∙10–3 = –6 ∙ 96500 ∙0,786 ∙ 10–3 = – 455,1 кДж; = – z∙F ∙ЭДС∙10–3 = –6 ∙ 96500 ∙0,786 ∙ 10–3 = – 455,1 кДж; 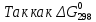 < 0, то реакция протекает в прямом направлении. < 0, то реакция протекает в прямом направлении. 2) Рассмотрим метод ионно-электронного баланса для ОВР, которая протекает в нейтральной среде. KMnO4 + K2SO3 + H2O = K2SO4 + MnO2↓ + KOН. Определим степень окисления каждого элемента: +1 +7 -2 +1 +4 -2 +1 -2 +1 +6 -2 +4 -2 +1 -2 +1 K Mn O4 + K2 S O3 + H2O = K2 S O4 + MnO2↓ + K O Н. Видим, что KMnO4 – окислитель (Mn+7), K2SO3 – восстановитель (S+4). Написав реакцию в диссоциированном виде, получаем: К+ + MnO4– + 2К++ SO32– +H2O → 2К++SO42– + MnO2↓ + К++ OН–. Затем напишем полуреакции окисления-восстановления. Общее число электронов, участвующих в ОВР: 6. В нейтральной среде для уравнивания используются молекулы воды, ионы H+ и OН–:
Получили сокращенное ионно-молекулярное уравнение. В правой части 6H+ и 8OН– образуют 6 молекул воды и 2OН–. Сократив молекулы воды в левой и правой части и подставив найденные коэффициенты, уравниваем реакцию: 2KMnO4 + 3Na2SO3 + H2O → 2MnO2↓ + 2KOН + 3Na2SO4. Находим значения стандартных электродных потенциалов окислителя и восстановителя (табл. П 2): потенциал окислителя Е0(MnO4–,2H2О/MnО2,4OН–) = 1,23 B; потенциал восстановителя Е0(SO42–,H2O/SO32–,2H+) = 0,172 B. Так как потенциал окислителя больше потенциала восстановителя, делаем вывод, что реакция протекает слева направо. Это подтверждают и расчёты: ЭДС = Е0 (MnO4–,2H2О/MnО2,4OН–) – Е0(SO42–,H2O/SO32–,2H+) = = 1,23 – 0,172 = 1,06 B. Δ 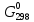 = – z∙F ∙ЭДС∙10–3 = –6 ∙ 96500 ∙1,06 ∙ 10–3 = – 613,7 кДж; = – z∙F ∙ЭДС∙10–3 = –6 ∙ 96500 ∙1,06 ∙ 10–3 = – 613,7 кДж;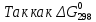 < 0, то реакция протекает в прямом направлении. < 0, то реакция протекает в прямом направлении. 3) Рассмотрим метод ионно-электронного баланса для ОВР, которая протекает в щелочной среде. NaNO2 + KMnO4 + KOH → NaNO3 + K2MnO4 + H2O. Определив степень окисления каждого элемента, видим, что KMnO4 – окислитель (Mn+7), NaNO2 – восстановитель (N+3). +1 +3 –2 +1 +7 –2 +1 –2 +1 +1 +5 –2 +1 +6 –2 +1 –2 Na N O2 + K Mn O4 + K O H → Na N O3 + K2 Mn O4 + H2O. Написав реакцию в диссоциированном виде, получаем: Na+ +NO2– + К+ + MnO4– + К++ OH– → Na+ +NO3– + 2К+ + MnO42– +H2O Напишем полуреакции окисления-восстановления: в щелочной среде баланс частиц уравнивается ионами OH–, которые добавляются к восстановленной форме, и молекулами воды, добавляемыми к окисленной форме. Общее число электронов, участвующих в окислительно-восстановительной реакции: 2.
Получили сокращенное ионно-молекулярное уравнение. Подставив найденные коэффициенты, уравниваем реакцию: NaNO2 + 2KMnO4 + 2KOH → NaNO3 + 2K2MnO4 + H2O. Находим значения стандартных электродных потенциалов окислителя и восстановителя (табл. П 2): потенциал окислителя Е0 (MnO4–/ MnO42–) = 0, 56 B; потенциал восстановителя Е0(NO2–,2OH– /NO3–,H2O) = 0,01 B. Так как потенциал окислителя больше потенциала восстановителя, делаем вывод, что реакция протекает слева направо. Это подтверждают и расчёты: ЭДС = Е0(MnO4–/MnO42–) – Е0(NO2–,2OH– /NO3–,H2O) = = 0,56 – 0,01 = 0,55 B. 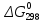 = – z∙ F ∙ЭДС∙10–3 = –2 ∙ 96500 ∙0,55 ∙ 10–3 = – 105,15 кДж; = – z∙ F ∙ЭДС∙10–3 = –2 ∙ 96500 ∙0,55 ∙ 10–3 = – 105,15 кДж; 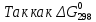 < 0, то реакция протекает в прямом направлении. < 0, то реакция протекает в прямом направлении. Пример 6.3. Рассчитайте электродвижущую силу гальванического элемента по стандартным значениям энергии Гиббса (Δ 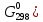 для реакции: для реакции: Zn (т) + 2Сu(OH)2 (т) = ZnO (т) + Cu2O (т) + 2H2O (ж). Напишите реакции, происходящие на электродах, составьте схему гальванического элемента. Р е ш е н и е Находим табличные значения Δ | ||||||||||||||||||||
