Химия задача. Решение в данном соединении комплексообразователь Fe
 Скачать 183.02 Kb. Скачать 183.02 Kb.
|
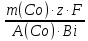 = = 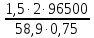 = = 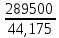 = 6553,48 Кл. = 6553,48 Кл.Оно пропущено в течение времени τ: Q = I∙ τ τ = 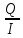 = = 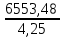 = 1541,9 c (0,43 ч.) = 1541,9 c (0,43 ч.)1) Составить схему реакции: Записать исходные вещества и продукты реакции: Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O 2) Записать уравнение в ионном виде В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления: SO32- + MnO4— + 2H+ = Mn2+ + SO42- + H2O 3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления. В приведенной реакции окислитель — MnO4— принимает 5 электронов восстанавливаясь в кислой среде до Mn2+. При этом освобождается кислород, входящий в состав MnO4—, который, соединяясь с H+ образует воду: MnO4— + 8H+ + 5e— = Mn2+ + 4H2O Восстановитель SO32- — окисляется до SO42-, отдав 2 электрона. Как видно образовавшийся ион SO42- содержит больше кислорода, чем исходный SO32-. Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H+: SO32- + H2O — 2e— = SO42- + 2H+ 4) Найти коэффициенты для окислителя и восстановителя Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления: MnO4— + 8H+ + 5e— = Mn2+ + 4H2O |2 окислитель, процесс восстановления SO32- + H2O — 2e— = SO42- + 2H+ |5 восстановитель, процесс окисления 5) Просуммировать обе полуреакции Предварительно умножая на найденные коэффициенты, получаем: 2MnO4— + 16H+ + 5SO32- + 5H2O = 2Mn2+ + 8H2O + 5SO42- + 10H+ Сократив подобные члены, находим ионное уравнение: 2MnO4— + 5SO32- + 6H+ = 2Mn2+ + 5SO42- + 3H2O 6) Записать молекулярное уравнение Молекулярное уравнение имеет следующий вид: 5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O Пример 2. Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде. Na2SO3 + KMnO4 + H2O = Na2SO4 + MnO2 + KOH В ионном виде уравнение принимает вид: SO32- + MnO4— + H2O = MnO2 + SO42- + OH— Также, как и предыдущем примере, окислителем является MnO4—, а восстановителем SO32-. В нейтральной и слабощелочной среде MnO4— принимает 3 электрона и восстанавливается до MnО2. SO32-— окисляется до SO42-, отдав 2 электрона. Полуреакции имеют следующий вид: MnO4— + 2H2O + 3e— = MnО2 + 4OH— |2 окислитель, процесс восстановления SO32- + 2OH—— 2e— = SO42- + H2O |3 восстановитель, процесс окисления Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе: 3SO32- + 2MnO4— + H2O =2MnO2 + 3SO42- + 2OH— 3Na2SO3 + 2KMnO4 + H2O = 2MnO2 + 3Na2SO4 + 2KOH Пример 3. Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде. Na2SO3 + KMnO4 + KOH = Na2SO4 + K2MnO4 + H2O В ионном виде уравнение принимает вид: SO32- + MnO4— + OH— = MnO2 + SO42- + H2O В щелочной среде окислитель MnO4— принимает 1 электрон и восстанавливается до MnО42-. Восстановитель SO32-— окисляется до SO42-, отдав 2 электрона. Полуреакции имеют следующий вид: MnO4— + e— = MnО2 |2 окислитель, процесс восстановления SO32- + 2OH—— 2e— = SO42- + H2O |1 восстановитель, процесс окисления Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе: SO32- + 2MnO4— + 2OH— = 2MnО42- + SO42- + H2O Na2SO3 + 2KMnO4 + H2O = 2K2MnO4 + 3Na2SO4 + 2KOH Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов. Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно -восстановительные реакции |
