Решение задач на вывод химических формул
 Скачать 446 Kb. Скачать 446 Kb.
|
|
22. На полное сгорание 0,2 моль алкена израсходовано 26,88 л кислорода (н.у.). Установите название, молекулярную и структурную формулу вещества. Решение: 0,2моль 26,88л СnH2n + О2— СО2+Н2О 1моль хл 1  .v(О2) =? .v(О2) =? 2. γ (О2)-? . γСnH2n: . γ (О2) = 0,2 : 1,2 = 1:6 отсюда на 1 моль СnH2n надо 6 моль О2. СnH2n + 3  . γ (О2)-. в левой части известно — 12 атомов, а в правой — в СО2 2n и в - Н2Оn, отсюда 2n+n=12; Зn=12; n=4; С4Н8; С-С-С=С; С-С=С-С; С-С=С . γ (О2)-. в левой части известно — 12 атомов, а в правой — в СО2 2n и в - Н2Оn, отсюда 2n+n=12; Зn=12; n=4; С4Н8; С-С-С=С; С-С=С-С; С-С=СС Н    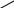 3С СН3 Н3С Н 3С СН3 Н3С Н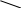 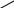 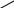  С=С С=С С=С С=СН Н Н СН3 II способ: СnH2n + 23. При полном сжигании вещества, не содержащего (О), образуется азот и вода. D(NxHу)Н2=16. Объем необходимого на сжигание кислорода равен объему выделившегося азота. Определите общую формулу соединения и истинную формулу вещества. NxHу + O2 → N2 + H2O; Мr (NxHу) = 16 Так как (O) в левой части 2 атома, то перед водой в схеме уравнения запишем коэффициент 2. Тогда количество (Н) будет в 2 раза больше количества атомов (N). Если количества атомов (N). выразим через х, то количество (Н) =2х. Составим алгебраическое выражение. NxHу = 32. Аr (N)= 14. Аr(Н)=1 => 14х+2х=32; 16х=32; х=2); => N2H4 24. Найти простейшую формулу оксида ванадия зная, что в оксиде массой 2,73г содержится, 1,53 г метала. Д  ано: Решение: ано: Решение:m (vxoу)=2,73г т экв. (О)=16/2 = 8; m (v)=1,53г т(О) =2,73- 1,53 = 1,2  VxOу=? тэкв(V) = Ar(V) = 51 B(V) = Или: т (О) =2,73 – 1,53 = 1,2; х : у = 25. Объем СО2, выделившегося при сжигании предельного одноатомного спирта, в 8 раз превосходит объем водорода, выделившегося при действии избытка натрия на такое же количество спирта. Установите строение спирта, если известно, что при его окислении образуется кетон. Решение: СnH2n+2О + 2СnH2n+1ОН + 2Na = H2 + 2 СnH2n+1ONa (2) 1 моль H2 из 2-х моль спирта 8 моль СО2 должно приходиться на то же количество спирта, следовательно 1 моль спирта при горении дает 4 моль СО2, => nСО2 = 4(1 уравнение). n ( Н2О) = n+1 = 5; n (O2) = 6. СnH2n+2О + 6О2. = 4СО2 + 5Н2О, т. к. СО2 из 1 моль, следовательно в спирте 4 атома углерода. т. е. С4НI0О; Н3С-НCOH-СН2-СН3 26. Из I,16 г предельного углеводорода получили 1,85 г монохлорпроизводного. Определите молекулярную формулу предельного углеводорода. Решение: 1.16 1.85 СnH2n+2 + С12 = СnH2n+1СI + НСI 14n+2 14n+1+З5.5 следовательно, n=4, значит С4Н10 II способ через массу приращения (.∆m) СnH2n+1СI стал тяжелее, чем СnH2n+2 на m(С1) и меньше на m(Н). 1.16 1.85 СnH2n+2 + С12 = СnH2n+1СI + НСI 71 1  ) ∆m по задаче. =. 1,85-1,16=0,65; ∆m по уравнению 35,5(С1)-1(Н)=34.5. ) ∆m по задаче. =. 1,85-1,16=0,65; ∆m по уравнению 35,5(С1)-1(Н)=34.5.2) mСI2-? ∆ mЗ4,5г----7IгС12 ∆ m0,65г --- х гСI2 х = 1,42 3)Мг(СnH2n+2)-? I  II Способ; II Способ; ∆m 0,65 1,16 СnH2n+2 x =62 ∆m 34,5-------x СnH2n+2 СnH2n+2 = 62; 14n+2 = 62; 14n = 60; n = 4, значит С4Н10 27. Из I,74 г предельного углеводорода получили 4,11г монобромпроизводного. Определите молекулярную формулу предельного углеводорода. 1,74 4,11 СnH2n+2 + Br2 = СnH2n+1Br + НBr 14n+2 14n+1+80 I,74 24,36n+140,94= 57,54n+8,22 132,72= 33,18n; n=4. следовательно, С4Н10 28.При гидрогалогенировании одинакового количества алкена получили 7,85 г хлорпроизводного и 12,3 г бромопроизводного. Вывести формулу а Решение: 7.85 12.3 Количество алкена одинаково, следовательно, n(СnH2n+1СI) = n(СnH2n+1Br) 14n+36.5 14n+81 Тогда Или через массу прирощения; 1) ∆m зад. 12,3-7,85 = 4,5 2) ∆m у-я 81(HВr) – 36,5(НСI)=44,5 С  nH2n + НСI = СnH2n+1СI nH2n + НСI = СnH2n+1СI3) Мг-? ∆m 4,45 --- 7,85 г СnH2n+1СI ∆ m44,5------хг СnH2n+1СI х=78,5 4) n-? СnH2n+1СI = 78,5; 14n+1+35,5=78,5; n=3 5 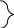 ) СnH2n + HBr = СnH2n+1Br ) СnH2n + HBr = СnH2n+1BrМг -? ∆m 4,45 г ------ 12,3 СnH2n+1Br х = 123 ∆m44,5г----------х СnH2n+1Br 6) n —? СnH2n+1Br = 123; I4n+1+80=123; n=3, следовательно, С3Н6 29. Определите формулу одноатомного спирта ω(С) и ω(Н) = 60% и 13,3%. Если при взаимодействии с кислотой образуется вещество, относительная плотность которого по H2 = 58. Решение:При взаимодействии спирта и кислоты образуется сложный эфир(СnH2nО2) 1)Мг (СnH2nО2) = 58 2)n=? (СnH2nО2) = 116; 14n+32=116; n=6. следовательно, С6H12O2. 3) (СnH2n+2О) спирт (СxНуО,) %(O)= 100 - (60+13.3) = 26,7 Х : у : z = 30. Массовая доля «О» в одноатомном предельном спирте = 26,67%. Выведите химическую формулу вещества. Решение. ω% = 1600 = 373n +480; n = 3 =>C3H7OH; II Способ: 31.На сгорание одноатомного предельного спирта потребовалось 84л. Кислорода (н.у.). В результате реакции получилось СО2 и 60г. водяных паров. Определите молекулярную формулу исходного спирта. Решение: СnH2n+2О + γ(О2) = γ(Н2О) = 3) 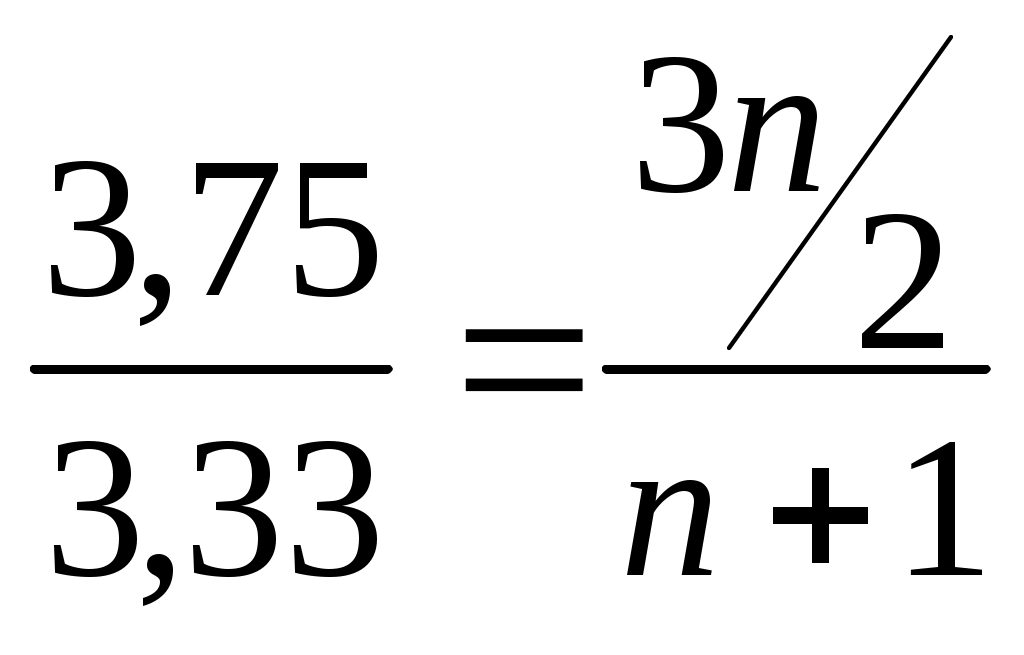 ; 3,75(n+1) = 3,33 ; 3,75(n+1) = 3,33 3,75n + 3,75 = 5n; 3,75 = 1,25n; n = 3 =>C3H7OH; 32. Определите формулу ацетиленового углеводорода, если малярная масса продукта его реакции с избытком бромоводорода в 4 раза больше, чем молярная масса углеводорода. Решение: CnH2n-2 +2HBr = CnH2nBr2 Мr(CnH2n-2)< в 4 раза Мr(CnH2n-Br2) 14n+160 = 56n -8; 42n = 168; n = 4=>C4H8 33.10л. смеси алкена с избытком водорода (н.у.) пропустили над катализатором. Объём смеси уменьшился до 7,2л.. При пропускании той же смеси через избыток бромной воды масса склянки увеличилась на 5,25г. Определите состав смеси. СnH2n + Н2 = СnH2n+2 СnH2n + Br2 = СnH2nBr2 т.к. Н2 в избытке => весь алкен прореагировал. Т.к. γ (СnH2n) = γ (Н2) => V (СnH2n) = V(Н2) Объём уменьшился за счёт удаления водорода V (СnH2n) = V (Н2) = 10 – 7,2 = 2,8л. Т.к. бром в избытке => весь алкен прореагировал, склянка увеличилась за счёт алкена m 1 моль =? 5)φ%(СnH2n) =? φ%(СnH2n) = 34.Смесь 3-х мл. газообразного углеводорода и 10мл. О2 взорвали. После приведения условий к первоначальным и конденсации паров воды объём смеси газов составил 8,5 мл. После пропускания полученной смеси через избыток щёлочи объём её уменьшился до 2,5мл., оставшийся газ поддерживает горение. Определите формулу взорванного углеводорода. 3мл. 10мл. СхHу + О2 = СО2 + Н2О; СО2 + 2NaOH = Na2CO3 + Н2О; 1)Рассчитаем объём О2 вступившего в реакцию; т. к 25мл. осталось => 10-2,5=7,5; γ(О2) = 2)Т.к. из 8,5мл. 2,5 осталось => V(СО2)=8,5-2,5=6мл; γ(СО2)= 3) γ (СхHу) =? γ(СхHу) = 2СхHу + 5О2 = 4СО2 + 2Н2О; γ(С): γ(Н) = 4:4, но т.к. СхHу 2 моль =>С2Н2 35.При разложении 1,68 г неизвестного карбоната получилось 0,8г углекислого газа, какой это карбонат? 1,68 г 0,8г Мех (СО3)у→ СО2 + МехОу 44г 1)γ(СО2) = γ(СО32-); γ(СО2) = 2)Рассчитаем массу СО32- в количестве 0,02моль 3) Рассчитаем массу М (Мех(СО3)У); 4)m(Ме) =84- (1,2 + 48)= 24; Аr(Me) =24 =>это Mg |
