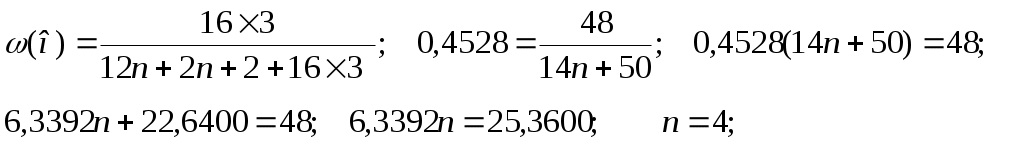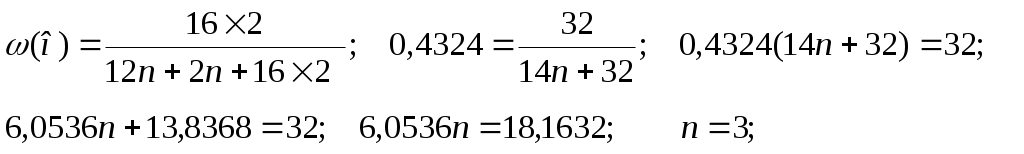Решение задач на вывод химических формул
 Скачать 446 Kb. Скачать 446 Kb.
|
|
36 Вывести химическую формулу вещества если, ω% (Mg) =20%; ω%(О)=53,33%; , ω%(Э)=26,67%. 1)√ (Mg)=?  100% 100%20% 3)X:Z=0, 83:3, 33=1:4 => Mg ЭО4 4) Мr (Mg ЭО4) =? 5) m (Э)=120-(24+64)=32; Аr(Э)=32 =>S; Mg SО4 37.При обработке предельного одноатомного спирта натрием получено 2,24л водорода (н.у.), а при дегидратации такой же порции спирта получено 11,2г алкена. Определите состав спирта. 2,24л 2СnH2n+1ОН + 2Na = H2 + 2 СnH2n+1ONa 11,2г СnH2n+1ОН→ СnH2n+ Н2О 1) √( H2)=? И  ли: ли: 2,24л 11,2г СnH2n+1ОН→ H2 → СnH2n х=112; 22,4л х Это 2 моль=> m 1моль=112/ 2=56 и т.д. 38.Сложный эфир массой 30г. Подвергнут щелочному гидролизу. При этом получено 34г. Натриевой соли предельной одноосновной кислоты и 16 г. Спирта. Установите молекулярную формулу этого эфира. 30г Хг 34г. 16г СnH2n О2 + NaОН→ СnH2n-1 О2Na + СnH2n+1ОН 14n+32 40г По закону сохранения масс веществ масса левой части уравнения равна массе правой части. Отсюда, если от суммы масс правой части отнимем массу эфира, мы получим массу NaОН вступившего в реакцию. m(NaОН) = (34+16) – 30 = 20 30г 20 СnH2n О2 + NaОН→ СnH2n-1 О2Na + СnH2n+1ОН 14n+32 40г 39.Установите молекулярную формулу предельной одноосновной карбоновой кислоты, кальциевая соль которой содержит 30,77% кальция  69,23% 30,77% 2 СnH2nО2 + Са = ( СnH2n-1О2)2Са + H2 14n-1+32 40 ω% = (28n +102) Или можно по другому: Или можно по другому: Сначала рассчитаем молекулярную массу. ( СnH2n-1О2)2Са = 130; 28n +102 =130; n =1; Формула кислоты СН2О2- муравьиная кислота 40. Установите формулу предельной одноосновной кислоты натриевая соль которой содержит 33,82% натрия. 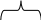 66,18% 33,82% 2 СnH2nО2 + 2Na = 2СnH2n-1О2Nа + H2 14n-1+32 23 ω% = 23=4,7348n + 18,2628; 4,7372=4,7348n; n =1; Формула кислоты СН2О2- муравьиная кислота Или: 33,82% = 41.При сгорании 1г одноатомного спирта выделился углекислый газ объёмом 1,12л.. Установите молекулярную формулу этого спирта 1г 1,12л СnH2n+2О + 14+2+16 n22.4л 42.При взаимодействии 23г. предельного одноатомного спирта с концентрированной серной кислотой образуется газ. При взаимодействии этого газа с 11,2л водорода(н.у.) образуется алкан. Установите молекулярную формулу алкана. 23г СnH2n+1ОН → кат. СnH2n + Н2О 11,2л СnH2n + H2 → кат. CnH2n+2; νспирта :νалкена = 1:1, νН2 : ν алкена =1 : 1; 22,4л Отсюда рассчитав количество Н2 мы будем знать количества всех веществ в реакции. ν(Н2 ) = V/Vm; ν(Н2 ) = 11,2л / 22,4л/моль = 0,5 моль. Отсюда следует, что спирта в реакцию вступило тоже 0,5моль. Рассчитаем молярную массу спирта. Mr(СnH2n+1ОН) = m/ν; Mr(СnH2n+1ОН) = 23г/0,5моль = 46г/моль; СnH2n+1ОН =46; 14n+18 =46; 14n =28; n = 2; Формула алкана: С2Н6 43. Соединение содержит 62,8% S и 37,2% F. Масса 118 мл данного соединения при 70 и 98,64 КПа равна 0,51 г. Вывести формулу соединения.
44. Определите молекулярную формулу ацетиленового углеводорода, если молярная масса продукта его реакции с избытком бромоводорода в 4 раза больше, чем молярная масса исходного углеводорода. 1)СnН2n-2 + 2НВr → СnН2nВr2 ; 2) рассчитана молярная масса углеводорода и продукта реакции: М(Сn Н2n-2) = 14n – 2; М(Сn Н2nВr2) = 14n + 160; 3) установлена молекулярная формула углеводорода: (14n + 160)/(14n – 2) = 4, n = 4; Формула: С4Н6. 45. При сжигании 3 л газообразного углеводорода получено 6 л углекислого газа и некоторое количество воды. Определите молекулярную формулу углеводорода, если известно, что для полного сжигания потребовалось 10,5 л кислорода. СхНу + О2 = СО2 + Н2О ν(СхНу) :ν(О2) : ν(СО2) = 2СхНу + 7О2 = 4СО2 + Н2О; ν(СО2)= ν(С) тогда ν(С)=4; 4 атома приходится на 2 моль СхНу, тогда в 1 моль 2 атома углерода. 2СхНу + 7О2 = 4СО2 + 6Н2О; ν(Н) в 6Н2О =12 атомов, следовательно в 2-х моль СхНу ν(Н) =12 атомов, а в 1 моль 6 атомов. Отсюда формула С2Н6-этан. ν(О2) 7 моль, т.е. 14 атомов, в(СО2) кислорода 8 атомов, тогда в Н2О ν (О)= 14-8=6 46. Определите молекулярную формулу алкана, если известно, что для его сжигания потребовалось 10 л кислорода и при этом образовалось 6 л углекислого газа. СnH2n+2 + ν(О2) = Или: Ответ:С3H6 Определение формулы вещества по известной общей формуле и массовой доле одного из элементов. 47. Установите молекулярную формулу предельного трёхатомного спирта, массовая доля водорода в котором равна 10%.
48. Монобромпроизводное алкана содержит 35% углерода по массе. Определите молекулярную формулу этого соединения.
49. Монохлоралкан содержит 70,3% хлора по массе. Установите молекулярную формулу этого соединения. 50.Один из монобромалканов содержит 65,04% брома. Установите молекулярную формулу этого соединения. 51. Установите молекулярную формулу предельного двухатомного спирта, массовая доля водорода в котором равна 10,53%.
52. Установите молекулярную формулу предельного двухатомного спирта, массовая доля водорода в котором равна 11,11%. 53. Установите молекулярную формулу предельного двухатомного спирта, массовая доля углерода в котором равна 47,37%.
54. Установите молекулярную формулу предельного трёхатомного спирта, массовая доля водорода в котором равна 9,43%. 55. Установите молекулярную формулу предельного трёхатомного спирта, массовая доля кислорода в котором равна 45,28%.
56. Массовая доля кислорода в одноосновной карбоновой кислоте равна 43,24%. Установите молекулярную формулу кислоты.
57. Массовая доля кислорода в одноосновной аминокислоте равна 42,67%. Установите молекулярную формулу кислоты. Определение формулы вещества по его реакционной способности. 58. При нагревании 120г предельного одноатомного спирта в присутствии концентрированной серной кислоты было получено 84г алкена. Установите формулу исходного спирта.
Формула C3H8 O, или C3H7 OН 59. При взаимодействии одного и того же количества алкена с различными галогеноводородами образуется соответственно 7,85г хлорпроизводного или 12,3г бромпроизводного. Определите молекулярную формулу алкена, запишите его название и структурную формулу. 60. Ацетиленовый углеводород может максимально присоединить 80г брома с образованием продукта реакции массой 97г. Установите молекулярную формулу этого углеводорода.
Формула вещества: C5H8 61. В результате реакции предельного одноатомного спирта с хлороводородом массой 18,25 получили органический продукт массой 46,25г и воду. Определите молекулярную формулу исходного спирта. 62. На нейтрализацию 18,5г одноосновной карбоновой кислоты потребовался раствор, содержащий 10г гидроксида натрия. Определите молекулярную формулу исходной кислоты. 63. На нейтрализацию 25,5г одноосновной карбоновой кислоты потребовался раствор, содержащий 10г гидроксида натрия. Определите молекулярную формулу исходной кислоты. 64. Предельный одноатомный спирт обработали металлическим натрием. В результате реакции получили вещество массой 20,5г и выделился газ объёмом 2,8 л (н.у.). Определите молекулярную формулу исходного спирта. 65. При взаимодействии 30г предельного одноатомного спирта с металлическим натрием выделилось 5,6л (н.у.) газа. Определите молекулярную формулу исходного спирта. 66. При взаимодействии 23г предельного одноатомного спирта с металлическим натрием выделилось 5,6л (н.у.) газа. Определите молекулярную формулу исходного спирта. 67. При взаимодействии 22г предельной одноатомной кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6л(н.у.) газа. Определите молекулярную формулу исходной кислоты. 68. Установите молекулярную формулу предельного трёхатомного спирта, массовая доля углерода в котором равна массовой доле кислорода СnH(2n-1)(OH)3 m кислорода=16×3=48,следовательно углерода=48/12=4 C4H7(OH)3 |

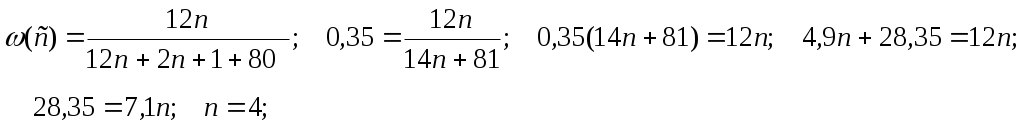 Формула C4H9Br
Формула C4H9Br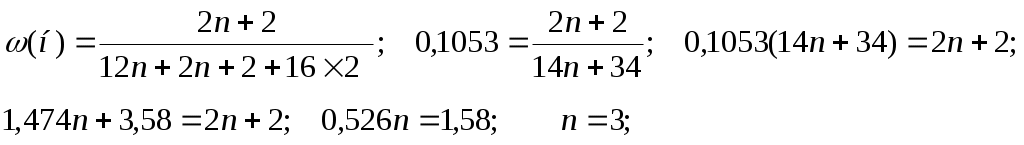 Формула C3H8 O2
Формула C3H8 O2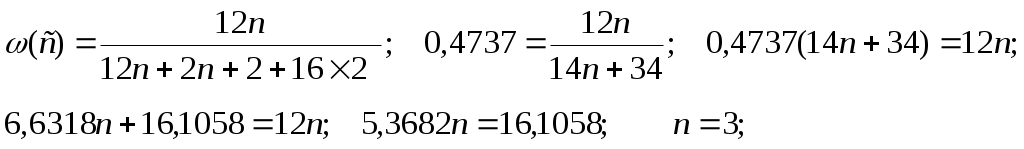 Формула C3H8 O2
Формула C3H8 O2