реферат жкк. Рис. Причины желудочнокишечных кровотечений (по Duncan, 2011) Патофизиологические аспекты жкк
 Скачать 2.14 Mb. Скачать 2.14 Mb.
|
|
Источники кровотечений в просвет пищеварительного канала различны. Так, пищеводные кровотечения обычно обусловлены варикозным поражением вен, травмами, эрозивным эзофагитом. Кровотечения из желудка и двенадцатиперстной кишки встречаются при язвенной болезни, синдроме Маллори – Вейсса, опухолях, геморрагическом эрозивном гастрите, мальформациях, опухолях и т.д. Наиболее распространенные причины кровотечений из верхнего отдела желудочно-кишечного тракта (ЖКТ) – эрозии Камерона, варикозное расширение вен дна желудка, пептические язвы, ангиэктазии, расширение сосудов антрума, болезнь Делафуа. Кровотечения из дистальных отделов пищеварительного тракта могут быть связаны со злокачественными новообразованиями ободочной и прямой кишки, опухолями тонкой кишки (лимфома, карциноид, аденокарцинома, наследственный полипоз), дивертикулом Меккеля, болезнью Крона, у детей – с кишечными инвагинациями. Причинами тяжелых острых кровотечений из нижних отделов ЖКТ также могут быть дивертикулез, ангиодисплазии, дивертикул Меккеля, ишемия. Причины кровотечений средней тяжести – заболевания анального прохода (трещины, геморрой), воспалительные заболевания кишечника, карцинома, большие полипы, лучевой энтерит, ангиодисплазия, солитарная язва прямой кишки и др. Иногда источник кровотечений локализуется в двенадцатиперстной кишке. Это наблюдается после биопсий печени (сопровождается гемобилией), травм или печеночно-клеточного рака, вследствие панкреонекроза или после трансплантации поджелудочной железы из ее протока, после операций на сосудах (например, при аортокишечном свище после операции по поводу аневризмы брюшной аорты) и др. [1–5]. Подобные кровотечения встречаются реже. В целом распространенность желудочно-кишечных кровотечений (ЖКК) весьма велика (рис. 1). 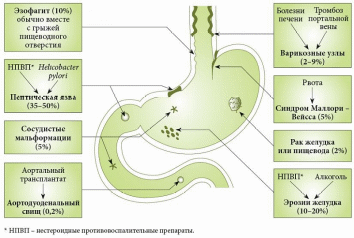 Рис. 1. Причины желудочно-кишечных кровотечений (по Duncan, 2011) Рис. 1. Причины желудочно-кишечных кровотечений (по Duncan, 2011)Патофизиологические аспекты ЖКК Кровопотеря в объеме 500 мл соответствует уровню компенсации (удерживается объем циркулирующей крови (ОЦК)) благодаря двум основным механизмам: 1) уменьшению вместимости сосудистого русла за счет вазоконстрикции сосудов кожи, брюшной полости, открытия артериовенозных шунтов, перехода тканевой жидкости в сосудистое русло; 2) активации ренин-ангиотензин-альдостероновой системы, стимулирующей абсорбцию натрия и воды в почечных канальцах. При продолжающемся кровотечении снижается ОЦК, что приводит к следующим изменениям: декомпенсации кровообращения (нарушению функций сердечно-сосудистой системы из-за несоответствия объема сосудистого русла и ОЦК, кислородному голоданию миокарда – снижению сердечного выброса, систолического и диастолического давления, тахикардии, изменениям в миокарде вплоть до развития инфаркта, изменениям вплоть до геморрагического шока (при индексе шока, равном 1, состояние расценивается как угрожающий шок, при индексе 1,5 – как развившийся шок)); снижению артериального давления (АД) и притока крови к почкам, из-за чего снижаются клубочковая фильтрация, функции канальцев, развиваются олигурия, анурия, увеличивается количество остаточного азота в крови; уменьшению печеночного кровотока и гипоксии гепатоцитов и, как следствие, к снижению дезинтоксикационной, синтетической и других функций печени (снижение уровня гемоглобина, гематокрита, содержания альбумина в плазме крови и т.д.). Исходя из патофизиологических сдвигов выделяют кровопотерю до 1 литра и свыше 1 литра (массивную кровопотерю). Клиника и диагностика В отличие от наружного кровотечения при внутреннем трудности возникают даже при установлении самого факта наличия кровотечения. В развитии клинических проявлений внутренних кровотечений выделяют два периода – скрытый и явный. Как правило, скрытый период характеризуется общей симптоматикой кровопотери (слабость, головокружение, шум и звон в голове, мелькание мушек перед глазами, сухость во рту, тошнота, холодный пот, обморочное или полуобморочное состояние, учащенный пульс, сниженное АД, внезапный позыв к дефекации). Явный период отличается однократной или многократной кровавой рвотой (кровью или «кофейной гущей»), дегтеобразным липким стулом, гипермоторикой кишечника. Важен не только объем, но и скорость кровопотери, а также индивидуальная устойчивость к ней организма. Объем кровопотери можно определить с помощью индекса Альговера (табл. 1), массы тела (табл. 2). Можно уточнить и степень тяжести кровопотери (табл. 3). 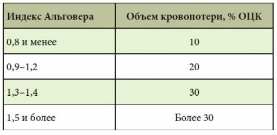 Таблица 1. Объем кровопотери при различных показателях индекса Альговера 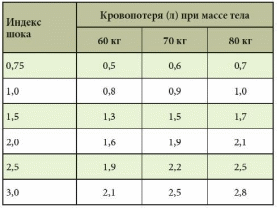 Таблица 2. Величина кровопотери у больных с различной массой тела*  Таблица 3. Клинические критерии кровопотери* В госпитальных условиях получают более точные данные: определяют содержание эритроцитов, уровень гемоглобина, гематокрит, относительную плотность крови и т.д. Номограмма П.Г. Брюсова предназначена для экстренного ориентировочного определения величины кровопотери (рис. 2). Рис. 2. Номограмма Брюсова для определения величины медленной внутренней кровопотери или кровопотери, компенсированной кровезаменителями 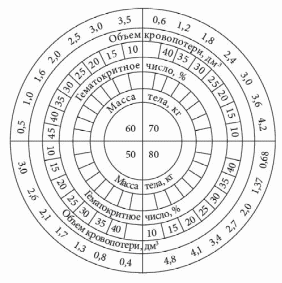 Для тех же целей в 1956 г. Г.А. Барашков предложил использовать показатели крови в зависимости от величины кровопотери (табл. 4).  Таблица 4. Показатели крови в зависимости от величины кровопотери* В стандартах оказания неотложной хирургической помощи 2000 г. приведены лабораторные критерии тяжести кровопотери (табл. 5). 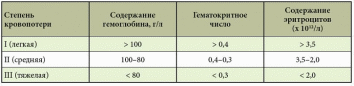 Таблица 5. Лабораторные критерии тяжести кровопотери С развитием технологий стало возможным определение ОЦК (в частности, радионуклидным методом, с помощью красителей), дефицита глобулярного объема (ГО), дефицита ОЦК, объема циркулирующей плазмы. В 1974 г. А.И. Горбашко предложил выделять степени кровопотери в зависимости от дефицита ГО: I степень – дефицит до 20%, II cтепень – 20–30%, III степень – более 30%. Степени кровопотери определяются так: I степень – легкая кровопотеря: общее состояние больного удовлетворительное, умеренная тахикардия (до 100 ударов в минуту), АД в норме, центральное венозное давление (ЦВД) – 5–15 см вод. ст., диурез не снижен, уровень гемоглобина не ниже 100 г/л, дефицит ОЦК до 20%; II степень – средняя кровопотеря: общее состояние больного средней тяжести, частота пульса до 110 ударов в минуту, систолическое АД не ниже 90 мм рт. ст., ЦВД менее 5 см вод. ст., умеренная олигурия, уровень гемоглобина не ниже 80 г/л, дефицит ОЦК от 20 до 29%; III степень – тяжелая кровопотеря: состояние больного тяжелое, частота пульса более 110 ударов в минуту, систолическое АД ниже 90 мм рт. ст., ЦВД – 0, олигурия, метаболический ацидоз, уровень гемоглобина ниже 80 г/л, дефицит ОЦК 30% и более. Еще раз подчеркнем, что степень тяжести кровопотери – клиническое понятие, включающее не только клинико-лабораторные показатели, объем кровопотери, но и ее интенсивность (скорость), а также индивидуальную реакцию больного на кровопотерю. В диагностике ЖКК огромное значение имеет сбор анамнеза (принимал ли больной препараты, влияющие на слизистую оболочку), осмотр (имеются ли на коже сосудистые образования, характерные для наследственной телеангиэктазии, герпетиформный дерматит при целиакии, гемигипертрофия конечностей и наружных половых органов при синдроме Клиппеля – Треноне и др.) и, конечно, эзофагогастродуоденоскопия (ЭГДС), серийная рентгенография с барием, зондовая энтерография, компьютерная томография, магнитно-резонансная томография, другие методы эндоскопии (интраоперационная энтероскопия, энтероскопия методом проталкивания, двухбаллонная энтероскопия (ДБЭ), капсульная эндоскопия). Тактика при ЖКК К моменту госпитализации у 85% больных ЖКК останавливаются самостоятельно (состоявшиеся кровотечения). На выбор тактики влияет этиология кровотечения (травма, язва, опухоль и др.). Еще совсем недавно горячие споры возникали по поводу тактики при активных язвенных кровотечениях. Эволюция этой тактики прошла путь от консервативной (диета Мейленпграхта) до активной хирургической (С.С. Юдин, H. Finsterer). Затем появилась активно-выжидательная тактика (Е.Л. Березов). С внедрением ранней ЭГДС стало возможным применение так называемой активно-обоснованной тактики. Лечение Первый этап оказания помощи (в том числе при подготовке к экстренной операции в случае необходимости) – это этап фармакотерапии (табл. 6) и эндоскопической остановки ЖКК. Таблица 6. Примерный перечень групп препаратов, применяемых для консервативной остановки ЖКК  В последние годы традиционно применяется целая серия препаратов для гемостаза (антигеморрагического и гемостатического действия): активаторы образования тромбопластина (этамзилат), антагонисты гепарина (протамина сульфат), тромбообразующие средства (тромбин, фибриноген и т.д.), гемостатики других групп (Адроксон, настойка арники, гемофобин, кора и лист калины, Каноксицел, Колапол и др.), специальные препараты (при гемофилии и близких к ней заболеваниях – Гемате П, Фактор ix п), вазоконстрикторы (терлипрессин и др.), ингибиторы фибринолиза (Амбен, апротинин, Ингитрил, Транексам и др.). Среди препаратов последней группы следует отметить Транексам. Это ингибитор фибринолизина, оказывающий специфическое антифибринолитическое действие. В частности, препарат ингибирует активацию плазминогена и его превращение в плазмин. Транексам характеризуется тем, что оказывает не только местное, но и системное кровоостанавливающее действие при кровотечениях, вызванных состояниями, сопровождающимися повышением количества фибринолизина (например, при патологиях тромбоцитов). Транексам не обладает собственной тромбогенной активностью, поэтому имеет низкий риск тромботических осложнений. Препарат способен подавлять образование кининов и других активных пептидов, участвующих в аллергических и воспалительных реакциях, оказывая противовоспалительное и противоаллергическое действие (имеются данные о его противоинфекционном и противоопухолевом эффекте), то есть является препаратом комплексного действия. Антифибринолитическая активность Транексама в плазме сохраняется 7–8 часов, в тканях – до 17 часов, что обеспечивает эффективный гемостаз при различных видах кровотечений. Выводится почками, в связи с чем при нарушении функции почек может наблюдаться кумуляция транексамовой кислоты в организме, что требует коррекции дозы препарата. Для выбора показаний к назначению той или иной группы гемостатиков важно правильно диагностировать ЖКК, особенно неясной этиологии. Как уже отмечалось, диагностика и лечение ЖКК неясной этиологии до недавнего времени вызывали серьезные затруднения, но с появлением капсульной эндоскопии и ДБЭ ситуация несколько улучшилась. Необходимо проводить полную коагулограмму пациентам с ЖКК. При этом в случае диагностики ЖКК следует незамедлительно начинать внутривенное введение Транексама для уменьшения объема кровопотери и стабилизации фибринового сгустка в источнике кровотечения. Это особенно актуально для гемостатической терапии у контингента пожилого и старческого возраста, поскольку тяжелая анемия значительно осложняет дальнейшее ведение таких пациентов. В случае эндоскопической остановки ЖКК для стандартизации описания состояния желудка и характера кровотечения при выборе тактики целесообразно использовать классификацию J. Forrest (1987): F1а – струйное кровотечение из раны; F1b – капельное кровотечение из раны; F2a – тромбированные сосуды на дне язвы; F2b – сгусток крови, прикрывающий язву; F2c – язва без признаков кровотечения; F3 – источник кровотечения не обнаружен. Продолжающееся кровотечение (F1a) – показание к экстренной операции. Выбор способа операции зависит от тяжести состояния больного, степени операционно-анестезиологического риска, локализации и характера кровоточащей язвы. Так, язвы двенадцатиперстной кишки лечат ушиванием с пилоропластикой или без нее. При язвах желудка возможны ушивание или локальное иссечение, в крайнем случае – резекция желудка. При неустойчивом гемостазе, капельном подтекании (F1b) применимы местные эндоскопические способы остановки кровотечения: электрокоагуляция, диатермия, аргоноплазменная коагуляция, инъекционная склеротерапия (инъекции этанола и проч.), пленкообразующие лекарственные средства (Эйконол), лигирование варикозного узла, лазерная терапия, эндохирургическое клипирование, орошение транексамовой кислотой. Местное орошение адреналином + фармакотерапия в ряде случаев также дают положительный эффект. Фармакотерапия при активно-обоснованной тактике направлена прежде всего на гемостаз + осторожное контролируемое восполнение ОЦК (табл. 7). 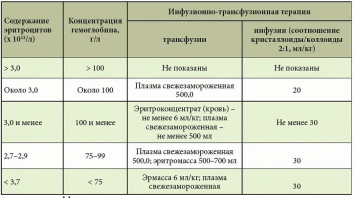 Таблица 7. Ориентировочная программа восполнения ОЦК при ЖКК* Отсутствие эффективности от эндоскопического гемостаза и высокий риск рецидива, а также сам рецидив – показания к срочной операции (12–24 часа от момента поступления больного в клинику). Выбор способа операции (это прерогатива хирургов) зависит от тяжести состояния больного, степени операционно-анестезиологического риска, локализации и характера кровоточащей язвы. Следует отметить, что активно-обоснованная тактика в отличие от активно-выжидательной снизила летальность до 4–6% против 17–20% (уровень доказательности С). Существуют и методы эндоваскулярного хирургического гемостаза. Вид рентгеноэндоваскулярной окклюзии зависит от характера кровоснабжения органа, состояния больного, особенностей катетеризации конкретного сосуда. Как правило, для катетерного гемостаза используются: селективная внутриартериальная инфузия вазоконстрикторов; селективная эндоваскулярная эмболизация артерий и вен; временная баллонная окклюзия. Вазоконстрикторную терапию можно применять в качестве дополнительного метода после артериальной или венозной эмболизации. Цель такой терапии при артериальной эмболизации – редукция коллатерального кровотока дистальнее уровня эмболизации, а при венозной – дополнительное снижение портальной гипертонии. При варикозе пищевода эмболизация гастродуоденальных коллатералей портальной и селезеночной вен, основного ствола венечной вены желудка или его коротких вен из чреспортального доступа является альтернативой хирургическому вмешательству. Эффективность лечебной эмболизации спиралями Гиантурко, гельфоном, тефлоном, отрадеполом или аутосгустками – 60–70%. Перед проведением эндоваскулярных хирургических вмешательств необходимо решить ряд вопросов: какой материал использовать; где помещать окклюзирующий материал – в магистральном или периферическом сосуде; возможно ли развитие инфаркта стенки органа; возникнет ли проблема с коллатеральным кровообращением; какова длительность окклюзии. Обязательное условие: должна быть налажена ангиография. При язве двенадцатиперстной кишки не рекомендуется проводить проксимальную баллонную блокаду гастродуоденальной артерии (ГДА) из-за коллатералей из панкреатодуоденальных ветвей к верхней брыжеечной артерии. Периферическая окклюзия коллагеном, спиртом, цианакрилатом может вызвать ишемию и инфаркт органа. Целесообразна эмболизация ГДА кусочками тефлона, гельфона, аутосгустками дистальнее и проксимальнее язвы. При варикозе вен пищевода чаще применяется эмболизация отрадеполом, гельфоном путем чреспеченочной пункции v. portae или катетеризации яремной вены или венечной вены желудка. Противопоказание – тромбоз основного ствола воротной вены. Поэтому обычно применяют эндолигирование с наложением колец или зонд Блэкмора (техника этих операций изложена в ряде руководств хирургического профиля, поэтому на ней останавливаться не будем). При кровотечениях из толстой кишки возможна эмболизация подвздошной артерии. Таким образом, хирургическая тактика должна быть обоснована в каждом конкретном случае. Если кровотечение остановлено, следует определить риск возникновения повторного и подобрать дальнейшую тактику. А.А. Гринберг в 1989 г. привел абсолютные и относительные критерии рецидива ЖКК (табл. 8). 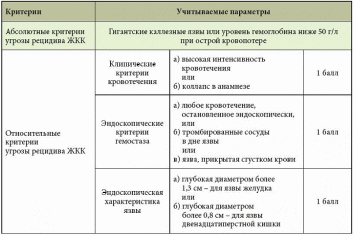 Таблица 8. Абсолютные и относительные критерии угрозы рецидива ЖКК Как трактовать степень риска Если в результате сложения получается 2–3 балла, то прогнозируется рецидив. Этот критерий подходит только для хронических язв, то есть тех, которые чаще «оседают» у терапевтов и гастроэнтерологов. При 2–3 баллах терапевт должен обеспечить достационарную подготовку к операции в плановом порядке. При 1 балле показана консервативная терапия. Консервативная терапия, как правило, включает: 1) мероприятия, направленные на коррекцию нарушений гомеостаза в соответствии с алиментационно-волемическим диагнозом (табл. 9); 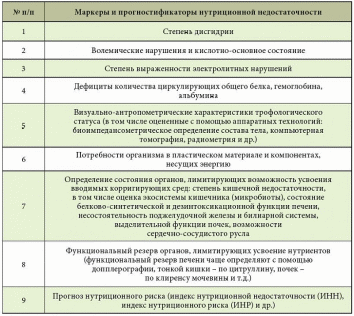 Таблица 9. Структура алиментационно-волемического диагноза 2) применение лекарственных средств: снижающих агрессивность желудочного сока и кислотообразования, если кровотечение было связано с язвенной болезнью: омепразол в/в капельно 40 мг 2 р/сут в течение 3 дней, затем внутрь 40 мг на ночь, фамотидин в/в 40 мг 2 р/сут, затем внутрь 20 мг 2 р/сут и др.; десмопрессин; дополнительных; других лекарственных средств, используемых для лечения язвенной болезни, если последняя стала причиной ЖКК; 3) вспомогательную терапию, направленную на улучшение функциональной способности печени, если кровотечение было связано с заболеваниями печени, например с циррозом; 4) десенсибилизирующую терапию при геморрагическом васкулите и т.д.; 5) коррекцию содержания железа (контроль постгеморрагической анемии) в любом случае при ЖКК или после ЖКК в соответствии с алиментационно-волемическим диагнозом. При этом следует помнить, что аскорбиновая кислота повышает всасываемость препаратов железа. Особого внимания заслуживают ЖКК неясной этиологии, когда источник и причина кровотечения неизвестны. В литературе встречаются противоречивые данные о целесообразности назначения гормональной терапии [6, 7]. В отдельных публикациях [6] содержатся сведения о применении соматостатина у больных с телеангиэктазиями и голубым пузырчатым невусом, об эффективности талидомида [8]. У таких больных рекомендуется также проводить лечение, направленное на восполнение уровня высокомолекулярных мультимеров фактора фон Виллебранда [9]. Зарубежные исследования показали, что применение транексамовой кислоты у пациентов с ЖКК любой этиологии снижает смертность, уменьшает потребность в гемотрансфузии и может быть стандартом терапии [10]. Некоторые особенности ведения больных с ЖКК в зависимости от возраста Кровотечения из ЖКК у пожилых пациентов отличаются особой тяжестью, поскольку для такой категории больных характерны: гигантские язвы (диаметром более 2 см); язвы с каллезными краями; склерозированные и плохо спадающиеся стенки сосудов, питающих слизистую оболочку; недостаточное питание слизистой оболочки (сопутствующая хроническая ишемическая болезнь органов пищеварения); снижение выработки гликопротеинов с протективной целью (снижение секреции в связи с атрофией); глубокие язвы (атрофия слизистой оболочки); угнетение свертывающей системы и белково-синтетической функции печени вследствие ее возрастных изменений; сопутствующая артериальная гипертония – фактор риска; наличие других сопутствующих нарушений (в частности, в ренин-ангиотензин-альдостероновой системе). Из-за возрастных особенностей почечной паренхимы необходимо обращать внимание на ее функциональный резерв из-за риска кумуляции препаратов при почечной недостаточности. Своевременная диагностика ЖКК и принятые меры позволяют предупредить развитие декомпенсированных состояний у пациентов, провести малоинвазивную терапию и назначить профилактическое лечение, направленное на профилактику рецидивов. Литература
Barkun A.N., Bardou M., Marshall J. K. Consensus Recommendations for Managing Patients with Nonvariceal Upper Gastrointestinal Bleeding //Ann. Intern. Med.-2003.- Vol. 139, № 10.- P. 843-857. Blatchford O. A risk score to predict need for treatment for upper gastrointestinal haemorrhage / O. Blatchford, W.R. Murray, M. Blatchford // Lancet. – 2000. – Vol. 356. – P. 1318–21. British Society of Gastroenterology Endoscopy Section. Non-variceal upper gastrointestinal haemorrhage: guidelines // Gut.- 2002.- Vol. 51, suppl. IV.- iv1-6. National Institute for Health and Clinical Excellence (NICE). Acute upper gastrointestinal bleeding: management. London (UK): National Institute for Health and Clinical Excellence (NICE).- 2012.- Jun.- 23 p. (Clinical guideline; no. 141). Franchis R. Revising consensus in portal hypertension: Report of the Baveno V consensus workshop on methodology of diagnosis and therapy in portal hypertension// Journal of Hepatology.- 2010.- Vol. 53.- P. 762–768. British Society of Gastroenterology Endoscopy Section. Non-variceal upper gastrointestinal haemorrhage: guidelines // Gut.- 2002.- Vol. 51, suppl. IV.- iv1-6. Rockall T.A. Risk assessment after acute upper gastrointestinal haemorrhage / T.A. Rockall [et al.] // Gut. – 1996. – Vol. 38. – P. 316–21. |
