УЧЕБНИК Клиническая фармакология и фармакотерапия. Руководство для врачей. УЧЕБНИК Клиническая фармакология и фармакотерапия. Руководство д. Руководство для врачей содержание предисловие
 Скачать 1.08 Mb. Скачать 1.08 Mb.
|
БИОДОСТУПНОСТЬ ЛЕКАРСТВЕННЫХ СРЕДСТВПри внутрисосудистом введении лекарственное вещество полностью попадает в кровеносное русло. При пероральном, внутримышечном, подкожном введении оно должно пройти через ряд биологических мембран клеток (слизистой оболочки желудка, печени, мышц и т.д.) и только часть его попадает в системный кровоток. Действие препарата во многом зависит от того, насколько велика эта часть. Этот показатель характеризует биодоступность лекарственного средства. При внутривенном введении биодоступность равна 100%. При других путях введения (даже при внутримышечном и подкожном) биодоступность почти никогда не достигает 100%. На биодоступность лекарственного вещества влияют путь введения препарата, индивидуальные особенности организма больного, состояние желудочно-кишечного тракта, сердечно-сосудистой системы, печени, почек, а также биофармацевтические факторы (лекарственная форма, ее состав, особенности технологии производства препарата). Последние особенно важны в применении лекарственных средств внутрь (энтерально) в виде таблеток, капсул. Как правило, вспомогательные вещества, входящие в состав лекарственного препарата, индифферентны и не оказывают какое-либо фармакологическое действие, но иногда они влияют на биодоступность препарата. Для прессования таблеток и наполнения капсул используют вещества, которые могут отрицательно повлиять на скорость растворения действующего соединения. Растворению лекарственных веществ может препятствовать низкая диспергирующая способность частиц наполнителя, а их дезагрегации способствуют поверхностно-активные или другие вещества, влияющие на электростатические свойства частиц. Технология грануляции порошков на фармацевтических заводах также влияет на характер высвобождения действующего вещества из лекарственной формы. Немаловажное значение для биодоступности препаратов имеют характер и состав покрытия таблеток и капсул. Для изучения биодоступности лекарственных средств используют различные методы. Чаще всего проводят сравнительное изучение изменений концентраций лекарственного вещества в исследуемой и стандартной лекарственных формах в плазме крови и/или в моче. Если в качестве стандартной лекарственной формы взять раствор для внутривенного введения (которые обеспечивает 100% биодоступность), то можно определить абсолютную биодоступность. Относительную биодоступность определяют для различных серий препаратов, для лекарственных средств при изменении технологии производства, для препаратов, выпущенных различными производителями, для разных лекарственных форм. Обычно относительную биодоступность измеряют при одном и том же пути введения лекарственных средств. Однако этот показатель можно определять и при различных путях введения препаратов. Для определения относительной биодоступности могут использоваться данные об уровне содержания лекарственного вещества в крови или же его экскреции с мочой после одноразового или многократного введения. Достоверность полученных результатов значительно увеличивается при использовании перекрестного метода исследования, так как при этом устраняются различия, связанные с влиянием физиологического и патологического состояния организма на биодоступность лекарственного вещества. Показатель относительной биодоступности имеет большое практическое значение. В клинической практике уже давно отмечено, что препараты, содержащие одни и те же лекарственные вещества, но выпускаемые различными фармацевтическими фирмами, существенно различаются как по терапевтической эффективности, так и по частоте возникновения и выраженности побочных эффектов. В полной мере понять и оценить роль особенностей технологии производства, качественного и количественного состава вспомогательных веществ лекарственной формы и многих других факторов в действии лекарственных средств стало возможным только в последние годы в результате бурного развития биофармации и фармакокинетики. Оказалось, что в большинстве случаев терапевтическая неэквивалентность препаратов, содержащих одни и те же лекарственные вещества, зависит от различий в их биодоступности. В связи с этим возникло новое понятие — биоэквивалентность. Лекарственные препараты называют биоэквивалентными в тех случаях, когда они обеспечивают одинаковую концентрацию действующего вещества в крови и тканях организма. При изучении биоэквивалентных лекарственных препаратов наиболее важными являются следующие параметры: 1) максимум или пик концентрации лекарственного вещества в крови; 2) время достижения максимальной концентрации и 3) площадь под кривой изменения концентрации вещества в плазме или сыворотке крови во времени. 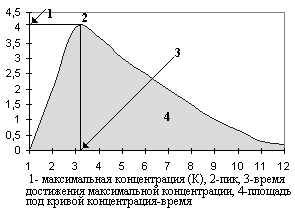 Значение показателя пика концентрации вещества в крови можно объяснить с помощью рис. 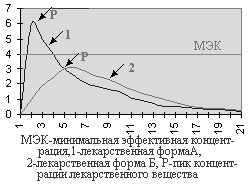 Две кривые изображают кинетику концентрации в крови одного и того же лекарственного вещества, введенного в разных лекарственных формах (1 и 2). Горизонтальной линией отмечена минимальная эффективная концентрация, при которой данное вещество оказывает терапевтическое действие (например, 4 мкг/мл). При этом очевидно, что при изменении лекарственной формы (2) лекарственное вещество, хотя и полностью всасывается, но не достигает терапевтической концентрации и, следовательно, не оказывает терапевтического действия. 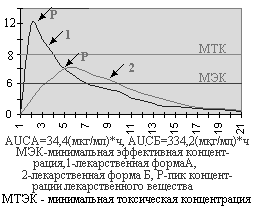 На рис. 8 представлена кинетика лекарственного вещества, имеющего минимальную эффективную концентрацию 4 мкг/мл и минимальную токсическую концентрацию 8 мкг/мл при применении в двух лекарственных формах (1 и 2). При использовании лекарственной формы 1 концентрация лекарственного вещества превышает минимальную токсическую и, следовательно, оказывает токсическое действие. При применении лекарственной формы 2 лекарственное вещество содержится в крови в терапевтической концентрации, но не достигает токсической концентрации и не оказывает повреждающего действия на организм больного. На рис. 8 представлена кинетика лекарственного вещества, имеющего минимальную эффективную концентрацию 4 мкг/мл и минимальную токсическую концентрацию 8 мкг/мл при применении в двух лекарственных формах (1 и 2). При использовании лекарственной формы 1 концентрация лекарственного вещества превышает минимальную токсическую и, следовательно, оказывает токсическое действие. При применении лекарственной формы 2 лекарственное вещество содержится в крови в терапевтической концентрации, но не достигает токсической концентрации и не оказывает повреждающего действия на организм больного.Второй важный параметр — время достижения максимальной концентрации лекарственного вещества. Этот показатель отражает скорость его всасывания и скорость наступления терапевтического эффекта. На рис. 8 видно, что максимальная концентрация вещества при использовании лекарственной формы 1 достигается через 1 ч, а лекарственной формы 2 — через 4 ч. Чтобы понять значение этого параметра, представим себе, что лекарственное вещество является снотворным средством. Оно достигнет минимальной терапевтической концентрации и окажет снотворное действие при использовании лекарственной формы 1 через 30 мин, а лекарственной формы 2 — только через 2 ч. С другой стороны, действие снотворного вещества при использовании первой лекарственной формы продолжается 5,5 ч, а второй — 8 ч. Следовательно, в связи с особенностями фармакокинетики одного и того же снотворного средства, приготовленного в разных лекарственных формах, различаются показания к их применению. Лекарственная форма 1 более пригодна при нарушениях засыпания, а лекарственная форма 2 — при снижении продолжительности сна. Третьим и, по-видимому, наиболее важным параметром биодоступности является площадь под кривой “концентрация — время”, которая отражает количество лекарственного вещества, поступившего в кровь после однократного введения препарата.  На рис. 8 две кривые имеют разную форму, разные пики и неодинаковое время достижения максимальной концентрации; но площади под этими кривыми одинаковы, и, следовательно, обе лекарственные формы обеспечивают поступление в кровь одинакового количества лекарствен На рис. 8 две кривые имеют разную форму, разные пики и неодинаковое время достижения максимальной концентрации; но площади под этими кривыми одинаковы, и, следовательно, обе лекарственные формы обеспечивают поступление в кровь одинакового количества лекарственСердечные гликозидыСодержание дигитоксина и дигоксина в крови определяют с целью диагностики и предупреждения токсических эффектов. Клиренс дигоксина и в меньшей степени дигитоксина снижается при заболеваниях почек, сердечной недостаточности, у людей пожилого возраста, при приеме спиронолактонов. Всасывание сердечных гликозидов в желудке резко замедляется при использовании антацидных средств. Хинидин может вызвать повышение концентрации дигоксина в плазме крови. Анальгезирующие и противовоспалительные средства Терапевтический мониторинг необходимо проводить при лечении ацетилсалициловой кислотой и ацетаминофеном. При приеме ацетилсалициловой кислоты максимум концентрации наблюдается через 30 мин, а равновесная концентрация устанавливается через 1-5 дней после начала лечения. Терапевтическая концентрация в крови равна 150-300 мг/л у взрослых и детей, при повышении содержания препарата в крови более 300 мг/л могут появиться токсические реакции. Концентрация ацетилсалициловой кислоты в крови снижается при уремии, гипоальбуминемии, применении глюкокортикоидов. Концентрация ацетаминофена (парацетамола) достигает максимума через 30-60 мин после приема внутрь, а равновесная концентрация — через 5-20 ч. При почечной недостаточности концентрация препарата в крови может повышаться за счет конъюгированного метаболита. ТеофиллинПрепарат, уровень которого в крови наиболее часто приходится контролировать. Время достижения максимальной концентрации в крови зависит от способа введения и лекарственной формы препарата (теофиллин для внутривенного введения, обычные таблетки или таблетки с замедленным высвобождением). При постоянном приеме теофиллина внутрь равновесная концентрация у взрослых достигается через 2 ч, у детей — через 1-2 суток, у новорожденных — через 5 суток (у недоношенных — через 3 суток). Терапевтическая концентрация в крови — 8-20 мг/л, у новорожденных — 6-12 мг/л. Концентрация теофиллина в крови повышается при циррозе печени, легочном сердце, тяжелых пневмониях, отеке легких. Одновременное применение макролидов, циметидина, пропранолола также приводит к снижению клиренса препарата. Курение вызывает ускорение метаболизма и увеличение клиренса теофиллина, которые сопровождаются уменьшением его концентрации в крови. При концентрации теофиллина более 20 мг/л появляются токсические эффекты: тошнота, рвота, понос, бессонница, головная боль, раздражительность, судороги, тахикардия, аритмии, в тяжелых случаях развивается гипоксия мозга, коллапс, легочно-сердечная недостаточность. Особенно важен контроль за концентрацией препарата в крови у новорожденных, больных, находящихся в бессознательном состоянии. Противосудорожные препаратыПротивосудорожные средства относятся к группе препаратов, взаимодействующих со многими другими лекарственными веществами. Концентрация этосуксемида при приеме внутрь достигает максимума через 2-4 ч, равновесная концентрация создается через 1-2 недели. Диапазон терапевтической концентрации противосудорожных и других средств приведен втабл. 6.3. При передозировке фенитоина могут появиться нистагм и головокружения (при концентрации его в крови более 15-30 мг/л), иногда развивается кома. Концентрация фенитоина в крови изменяется при остром лейкозе, инфекционном мононуклеозе, заболеваниях почек, печени, беременности. Метаболизм фенитоина замедляется при одновременном применении барбитуратов, хлорамфеникола, дисульфирама, изониазида. Противосудорожное действие его снижается при приеме барбитуратов в низких дозах, карбамазепина, алкоголя. Фенитоин ускоряет биотрансформацию примидона. Вальпроевая кислота уменьшает клиренс фенобарбитала, вытесняет фенитоин из комплекса с белком, что приводит к изменению концентрации этих препаратов в крови. Фенитоин, карбамазепин, фенобарбитал и примидон, ##активируя ферменты печени, увеличивают клиренс вальпроевой кислоты. Определять концентрацию противосудорожных средств крови необходимо у новорожденных, а также у больных при сочетанном применении нескольких противосудорожных средств. АнтибиотикиВысокая частота серьезных побочных эффектов (поражение почек и слухового нерва, а также нервно-мышечная блокада) ставит аминогликозидные антибиотики в первый ряд препаратов, требующих мониторинга, особенно у маленьких детей. Для стрептомицина терапевтическая концентрация в крови колеблется от 5 до 40 мг/л, для канамицина — от 16 до 25 мг/л, для гентамицина — от 5 до 12 мг/л. Другие нефротоксические средства могут вызвать нарушение выведения аминогликозидов и повышение их концентрации в крови. Изменение концентрации антибиотиков этой группы наблюдается также при почечной недостаточности, дегидратации, ожогах, ожирении. Концентрацию ванкомицина и хлорамфеникола в крови необходимо определять лишь в определенных случаях, например, при печеночно-клеточной недостаточности. Динамическое наблюдение за концентрацией ванкомицина в крови дает возможность предупредить тяжелые токсические реакции: поражение почек и органов слуха, тромбофлебиты, дерматозы. Равновесная концентрация препарата в крови устанавливается через 30-40 ч после его применения. Максимальная концентрация составляет 20-40 мг/л, а минимальная — 5-10 мг/л. Максимальная равновесная концентрация хлорамфеникола колеблется от 10 до 25 мг/мл, а минимальная составляет не менее 5 мг/л. Превышение терапевтической концентрации нередко приводит к угнетению костномозгового кроветворения с панцитопенией, желудочно-кишечным расстройствам, поражению печени, нейропатии и ретинопатии. ЦитостатикиПовышение безопасности и эффективности терапии цитостатиками является одной из важнейших задач гематологии. Уменьшение риска токсических реакций при использовании метотрексата можно обеспечить с помощью динамического наблюдения за концентрацией его в крови. Контроль за концентрацией препарата особенно важен при лечении высокими дозами препарата. Антиаритмические средстваОпределение концентрации антиаритмических средств в крови в динамике помогает врачу выяснить причины безуспешной терапии, так как для большинства препаратов этой группы существует прямая связь между концентрацией и эффектом, а также предупредить аритмогенное действие и другие побочные реакции. К числу препаратов, терапевтический мониторинг которых необходим, относят хинидин, дизопирамид, лидокаин, новокаинамид, пропранолол. При инфаркте миокарда, сердечной и почечной недостаточности может повышаться концентрация лидокаина, дизопирамида; индукторы метаболизирующих ферментов (дифенин, фенобарбитал) вызывают ее снижение. Повышение концентрации пропранолола в крови наблюдается у больных циррозом печени и людей пожилого возраста, а ее снижение — при гипертиреозе и курении. Хлорпромазин вызывает повышение в крови концентрации пропранолола. У больных с сердечной и почечной недостаточностью, циррозом печени может повыситься концентрация хинидина и его метаболитов в крови. Последние могут искажать истинное содержание хинидина в крови. Индукторы метаболизирующих ферментов повышают клиренс препарата. Психотропные средстваТерапевтического мониторинга требуют психотропные средства, так как при их передозировке возникают серьезные побочные реакции (поражение сердечно-сосудистой системы, холинолитические эффекты, маниакальное возбуждение, тремор). Барбитураты, хлоралгидрат, аллопуринол повышают клиренс антидепрессантов, а хлорамфеникол, галоперидол, фенотиазины, аллопуринол снижают его. 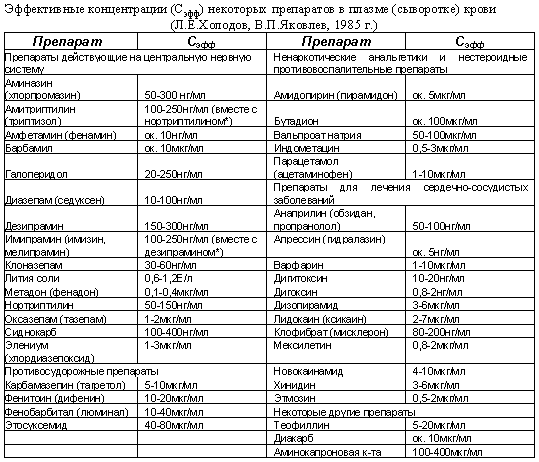 |
