екции. Лекции. С евероказахстанский государственный университет
 Скачать 466.81 Kb. Скачать 466.81 Kb.
|
|
ЛЕКЦИЯ 11 Приготовление растворов. Растворение используется для создания гомогенной среды, что благоприятствует протеканию реакции, для разделения веществ, для их очистки, для изменения скорости реакции и т.д. На растворение вещества оказывает влияние целый ряд факторов и в первую очередь природа растворителя и температура. В органическом синтезе наиболее часто применяют следующие растворители: углеводороды – пентан, гексан, петролейный эфир, бензол, толуол, ксилолы и др.; спирты – метиловый, этиловый, пропиловый, изопропиловый; кислоты – муравьиную и уксусную; простые и сложные эфиры – диэтиловый, диоксан, тетрагидрофуран (ТГФ), этилацетат; галогенопроизводные – хлороформ, четыреххлористый углерод, дихлорэтан, тетрахлорэтан; альдегиды и кетоны – ацетон, бензальдегид; азот- и серосодержащие растворители – ацетонитрил, диметилформамид (ДМФА), диметилсульфоксид (ДМСО), пиридин и д.р. В некоторых случаях растворители перед использованием приходится очищать и осушать, руководствуясь методиками, которые есть в учебной и справочной литературе. Растворение веществ в органических растворителях несколько отличается от растворения в воде. Во-первых, если растворяют в летучих растворителях (диэтиловый эфир, ацетон, петролейный эфир и т. д.), нужно принимать меры к тому, чтобы они не улетучивались; во-вторых, если растворяют в сухих (безводных) растворителях, нужно предупредить попадание в растворитель влаги из воздуха. Исходя из этих соображений, растворение ведут при соблюдении определенных мер предосторожности. Если вещество легко растворяется, то операцию можно вести в сосуде с притертой пробкой. Вначале в сосуд насыпают растворимое вещество, а затем добавляют растворитель. Пробку закрывают и сосуд несколько раз встряхивают. Если же растворение идет медленно и притом для ускорения его необходимо постоянное перемешивание, то раствор готовят в специальном приборе с механической мешалкой. Нагревание часто ускоряет растворение, но его можно применять не всегда. Для растворения при нагревании собирают прибор, состоящий из колбы и обратного холодильника. Очень важен порядок введения вещества и растворителя. Если вещество представляет собой тонкий порошок, то вначале в колбу наливают растворитель, а затем небольшими порциями вносят вещество, каждый раз перемешивая раствор. Если же вначале насыпать порошок, а потом налить растворитель, то первый сразу же может набухнуть, образуя слипшийся ком, растворение которого потребует много времени и труда. Только в тех случаях, когда растворяемое вещество не обладает способностью набухать перед растворением, способ растворения большого значения не имеет. Как правило, после окончания растворения полученный раствор следует обязательно профильтровать, чтобы отделить все посторонние нерастворившиеся вещества. В тех случаях, когда растворение должно идти при низких температурах, устраивают искусственное охлаждение льдом или водой. Литература: Пустовалова Л.М., Никанорова И.Е. Техника лабораторных работ. - Ростов-на-Дону: Феникс, 2004. - 288с. Иванова Н.В., Рубе В.А. Химический эксперимент: методика и техника. - Петропавловск: СКГУ им.М.Козыбаева, 2012. - 200 с. Васильев В.П. Аналитическая химия. М.: «Дрофа», 2002. в 2-х книгах. 368 с. (книга 1); 384 с. (книга 2). Волков А.И., Жарский И.М. Большой химический справочник - Мн.: Современная школа, 2005. - 608с. ЛЕКЦИЯ 12 Химический анализ. Анализ химический имеет задачей исследовать состав тел. Он разделяется на качественный и количественный. При помощи первого убеждаются в присутствии тех элементов или соединений, которые входят в состав исследуемого вещества; с помощью второго определяется количество этих составных частей в весовой единице анализируемого тела. Прежде чем приступить к количественному анализу, необходимо знать природу составных частей исследуемого тела, что достигается посредством качественного анализа. Таким образом, этот последний должен всегда предшествовать количественному анализу. Качественный анализ основан на том, что при известного рода обработке в каждом химическом соединении или элементе можно вызвать своеобразные явления, реакции, свойственные только одному какому-либо телу и указывающие, таким образом, на присутствие этого тела. Известные реакции протекают одинаково для целых групп тел, тогда как для других вовсе не наступают. Таким образом, возможно выработать систематический ход анализа и разбить отдельные тела на группы, а затем уже доискиваться в известной группе отдельных членов. Только придерживаясь систематического порядка при употреблении вызывающих известные реакции реактивов, возможно легко и верно достигнуть цели и притом тем легче, если не пренебрегать предварительными пробами, дающими указание на присутствие или отсутствие целых групп элементов. При количественном анализе найденные при качественном исследовании составные части переводятся всегда в прочные, мало изменяющиеся соединения определенного состава, вес которых и определяют (весовой анализ), или измеряют объем этих соединений, если они газообразны (анализ газов), или же, наконец, определяют (объемным путем) количество реагента, требующегося для образования этих соединений (титрование, объемный анализ). Особых методов требует элементарный анализ органических соединений, или сожжение; большинство этих соединений состоит из трех элементов: углерода, водорода и кислорода. Литература: Пустовалова Л.М., Никанорова И.Е. Техника лабораторных работ. - Ростов-на-Дону: Феникс, 2004. - 288с. Иванова Н.В., Рубе В.А. Химический эксперимент: методика и техника. - Петропавловск: СКГУ им.М.Козыбаева, 2012. - 200 с. Васильев В.П. Аналитическая химия. М.: «Дрофа», 2002. в 2-х книгах. 368 с. (книга 1); 384 с. (книга 2). Волков А.И., Жарский И.М. Большой химический справочник - Мн.: Современная школа, 2005. - 608с. ЛЕКЦИЯ 13 Методы измерения физико-химических параметров (плотность, вязкость, температура плавления и кипения). Жидкостью называют малосжимаемое тело, изменяющее свою форму под действием весьма малых сил. Основные характеристики жидкости - плотность, сжимаемость, тепловое расширение, вязкость и поверхностное натяжение. Плотность - отношение массы m жидкости к её объему W: r = m/W. Сжимаемость - свойство жидкости уменьшать объем под действием давления. Она оценивается коэффициентом сжимаемости bР, показывающим относительное уменьшение объема жидкости W при повышении давления р на единицу: bР = (DW/W) / Dр. Тепловое расширение - свойство жидкости изменять объем при нагревании - характеризуется коэффициентом теплового расширения bТ, равным относительному приращению объема W с изменением температуры Т на один градус при постоянном давлении: bТ = (DW/W) / DT. Как правило, при нагревании объем жидкости увеличивается. Вязкость - свойство жидкости сопротивляться относительному скольжению ее слоев. Ее оценивают динамическим коэффициентом вязкости m, который измеряется в паскаль-секундах (Па×с) и равен касательному напряжению между соседними слоями, если их относительная скорость перемещения численно совпадает с толщиной слоя. Кинематический коэффициент вязкости n определяют из формулы n = m / r и измеряют квадратными метрами на секунду (м2/с) или стоксами (1 Ст = 1 см2/с). Эти коэффициенты определяются видом жидкости, не зависят от скорости течения, существенно уменьшаются с возрастанием температуры. Поверхностное натяжение – свойство жидкости образовывать поверхностный слой взаимно притягивающихсямолекул - характеризуется коэффициентом поверхностного натяжения s, равным силе на единице длины контура свободной поверхности. Значения r, bР, bТ, n и sпри 20 оС . Вязкость - важная физико-химическая характеристика веществ. Значение вязкости приходится учитывать при перекачивании жидкостей и газов по трубам (нефтепроводы, газопроводы). Вязкость расплавленных шлаков весьма существенна в доменном и мартеновском процессах. Вязкость расплавленного стекла определяет процесс его выработки. По вязкости во многих случаях судят о готовности или качестве продуктов или полупродуктов производства, поскольку вязкость тесно связана со структурой вещества и отражает те физико-химические изменения материала, которые происходят во время технологических процессов. Вязкость масел имеет большое значение для расчёта смазки машин и механизмов и т.д. Вязкость - свойство жидкостей оказывать сопротивление перемещению одного слоя относительно другого. Количественно вязкость характеризуется значением динамической вязкости или коэффициентом внутреннего трения. Характерной особенностью этого вида трения является то, что оно наблюдается не на границе твердого тела и жидкости, а во всем объеме жидкости. Вязкость Вязкость (внутреннее трение) -- одно из явлений переноса, свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой. В результате происходит рассеяние в виде тепла работы, затрачиваемой на это перемещение. Вязкость - один из показателей качества горючесмазочных материалов, красок, синтетических смол и т. п. Например, в производстве полимеров и различных продуктов на их основе вязкость служит важнейшим технологическим параметром, так как по ее величине можно оценить молекулярную массу и концентрацию вещества, а также его структуру в расплаве или растворе. Механизм внутреннего трения в жидкостях и газах заключается в том, что хаотически движущиеся молекулы переносят импульс из одного слоя в другой, что приводит к выравниванию скоростей -- это описывается введением силы трения. Вязкость твёрдых тел обладает рядом специфических особенностей и рассматривается обычно отдельно. Различают динамическую вязкость (единица измерения в Международной системе единиц (СИ) -- Па·с, в системе СГС -- Пуаз; 1 Па·с = 10 Пуаз) и кинематическую вязкость (единица измерения в СИ -- мІ/с, в СГС -- Стокс, внесистемная единица -- градус Энглера). Кинематическая вязкость может быть получена как отношение динамической вязкости к плотности вещества и своим происхождением обязана классическим методам измерения вязкости, таким как измерение времени вытекания заданного объёма через калиброванное отверстие под действием силы тяжести. Вискозиметр - это прибор, предназначенный для определения вязкости. Самыми распространёнными вискозиметрами являются ротационные, капиллярные, ультразвуковые, вискозиметры с падающим шариком и вибрационные. Динамическая вязкость Внутреннее трение жидкостей, как и газов, возникает при движении жидкости вследствие переноса импульса в направлении, перпендикулярном к направлению движения. Справедлив общий закон внутреннего трения -- закон Ньютона: Коэффициент вязкости (коэффициент динамической вязкости, динамическая вязкость) может быть получен на основе соображений о движениях молекул. Очевидно, что будет тем меньше, чем меньше время t «оседлости» молекул. Эти соображения приводят к выражению для коэффициента вязкости, называемому уравнением Френкеля - Андраде: Иная формула, представляющая коэффициент вязкости, была предложена Бачинским. Как показано, коэффициент вязкости определяется межмолекулярными силами, зависящими от среднего расстояния между молекулами; последнее определяется молярным объёмом вещества . Многочисленные эксперименты показали, что между молярным объёмом и коэффициентом вязкости существует соотношение: где с и b -- константы. Это эмпирическое соотношение называется формулой Бачинского. Динамическая вязкость жидкостей уменьшается с увеличением температуры, и растёт с увеличением давления. Кинематическая вязкость В технике, в частности, при расчёте гидроприводов и в триботехнике, часто приходится иметь дело с величиной и эта величина получила название кинематической вязкости. Здесь -- плотность жидкости; -- коэффициент динамической вязкости. Кинематическая вязкость в старых источниках часто указана в сантистоксах (сСт). В СИ эта величина переводится следующим образом: 1 сСт = 1 мм2/1 c = 10?6 м2/c. Условная вязкость Условная вязкость -- величина, косвенно характеризующая гидравлическое сопротивление течению, измеряемая временем истечения заданного объёма раствора через вертикальную трубку (определённого диаметра). Измеряют в градусах Энглера (по имени немецкого химика К.О. Энглера), обозначают -- °ВУ. Определяется отношением времени истечения 200см3 испытываемой жидкости при данной температуре из специального вискозиметра ко времени истечения 200см3 дистиллированной воды из того же прибора при 20°С. Условную вязкость до 16°ВУ переводят в кинематическую ( м2/с) по таблице ГОСТ, а условную вязкость, превышающую 16°ВУ, по формуле: где -- кинематическая вязкость (в м2/с), а -- условная вязкость (в °ВУ) при температуре t. Значения динамического и кинематического коэффициентов вязкости некоторых жидкостей приведены далее в таблице. Таблица 1 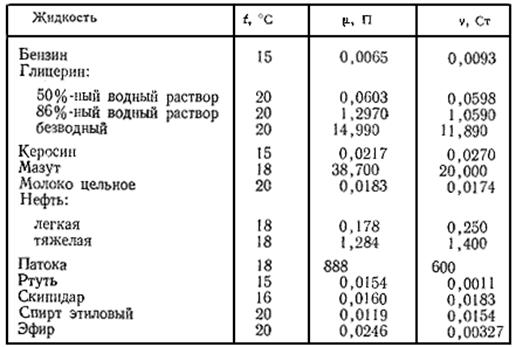 Лекция 14 Инструментальные методы анализа. Общие представления. Инструментальные методы анализа основаны на измерении с помощью приборов (инструментов) физических параметров анализируемой системы, которые возникают или изменяются в ходе выполнения аналитической реакции. Бурное развитие физико-химических методов анализа было вызвано тем, что классические методы химического анализа (гравиметрия, титриметрия) уже не могли удовлетворять многочисленные запросы химической, фармацевтической, металлургической, полупроводниковой, атомной и других отраслей промышленности, требовавших повышения чувствительности методов до 10-8 – 10-9 %, их селективности и экспрессности, что позволило бы управлять технологическими процессами по данным химического анализа, а также выполнять их в автоматическом режиме и дистанционно. Ряд современных физико-химических методов анализа позволяют одновременно в одной и той же пробе выполнять как качественный, так и количественный анализ компонентов. Точность анализа современных физико-химических методов сопоставима с точностью классических методов, а в некоторых, например в кулонометрии, она существенно выше. К недостаткам некоторых физико-химических методов следует отнести дороговизну используемых приборов, необходимость применения эталонов. Поэтому классические методы анализа по-прежнему не потеряли своего значения и применяются там, где нет ограничений в скорости выполнения анализа и требуется высокая его точность при высоком содержании анализируемого компонента. Классификация физико–химических методов анализа В основу классификации физико-химических методов анализа положена природа измеряемого физического параметра анализируемой системы, величина которого является функцией количества вещества. В соответствии с этим все физико-химические методы делятся на три большие группы: - электрохимические; - оптические и спектральные; - хроматографические. Электрохимические методы анализа основаны на измерении электрических параметров: силы тока, напряжения, равновесных электродных потенциалов, электрической проводимости, количества электричества, величины которых пропорциональны содержанию вещества в анализируемом объекте. Оптические и спектральные методы анализа основаны на измерении параметров, характеризующих эффекты взаимодействия электромагнитного излучения с веществами: интенсивности излучения возбужденных атомов, поглощения монохроматического излучения, показателя преломления света, угла вращения плоскости поляризованного луча света и др. Все эти параметры являются функцией концентрации вещества в анализируемом объекте. Хроматографические методы - это методы разделения однородных многокомпонентных смесей на отдельные компоненты сорбционными методами в динамических условиях. В этих условиях компоненты распределяются между двумя несмешивающимися фазами: подвижной и неподвижной. Распределение компонентов основано на различии их коэффициентов распределения между подвижной и неподвижной фазами, что приводит к различным скоростям переноса этих компонентов из неподвижной в подвижную фазу. После разделения количественное содержание каждого из компонентов может быть определено различными методами анализа: классическими или инструментальными. Литература: Васильев В.П. Аналитическая химия. М.: «Дрофа», 2002. в 2-х книгах. 368 с. (книга 1); 384 с. (книга 2). Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. - М.: Химия, 1990. Кн. 1,2. 845 с. Логинов Н.Я., Воскресенский А.Г., Солодкин И.С. Аналитическая химия. - М.: Просвещение, 1979, 475 с. Янсон Э.Ю., Путнинь Я.К. Теоретические основы аналитической химии.- М.: Высшая школа, 1980, 260 с. |
