екции. Лекции. С евероказахстанский государственный университет
 Скачать 466.81 Kb. Скачать 466.81 Kb.
|
|
При наличии реактивов ядовитых, огнеопасных, взрывоопасных свойств наклеивается отдельная этикетка с надписью:
В лабораторном помещении должны храниться лишь небольшие запасы химических веществ. Их держат в банках, склянках с пришлифованными стеклянными пробками или пластмассовыми крышками из полиэтилена, а наиболее летучие (например, хлороводородная кислота, раствор аммиака, бром) — на специальных полках в вытяжном шкафу. Общий запас одновременно хранящихся в каждом рабочем помещении лаборатории огнеопасных жидкостей не должен превышать суточные потребности, но не более 2—3 л на одного сотрудника. Склянки, в которых содержится более 50 мл ЛВЖ, должны храниться в железных ящиках для горючего с плотно закрывающейся крышкой, со стенками и дном, выложенными асбестом. Светочувствительные реактивы хранят в темных склянках или в банках, обернутых черной бумагой. Сильные яды должны хранить в опечатанных шкафах и сейфах. Хранить реактивы допускается лишь в специально оборудованных и хорошо вентилируемых помещениях, в строгом порядке. Не разрешатся совместное хранение реактивов, способных взаимодействовать друг с другом, например окислители и восстановители, кислоты и щелочи. Обособлено следует хранить следующие группы реактивов: взрывчатые вещества; горючие или сжиженные газы; самовозгорающиеся или самовоспламеняющиеся вещества; яды. Нормы и правила хранения реактивов разрабатываются и утверждаются отдельно в каждой организации в зависимости от особенностей работы, наличия оборудования, складских помещений и т.д. Правила пользования реактивами Главное требование к реактивам — это их чистота. Реактив нужно беречь от загрязнения. Нельзя ссыпать и сливать реактив из посуды, в которой проводится реакция, обратно в посуду для хранения. Нельзя путать пробки от посуды с разными реактивами, а также хранить реактивы без пробок. Нельзя брать реактивы руками. Набирать реактивы пипеткой можно только с помощью резиновой груши. Литература: Пустовалова Л.М., Никанорова И.Е. Техника лабораторных работ. - Ростов-на-Дону: Феникс, 2004. - 288с. Иванова Н.В., Рубе В.А. Химический эксперимент: методика и техника. - Петропавловск: СКГУ им.М.Козыбаева, 2012. - 200 с. Васильев В.П. Аналитическая химия. М.: «Дрофа», 2002. в 2-х книгах. 368 с. (книга 1); 384 с. (книга 2). Волков А.И., Жарский И.М. Большой химический справочник - Мн.: Современная школа, 2005. - 608с. ЛЕКЦИЯ 6,7 Методы очистки и концентрирования. В настоящее время существует значительное количество методов разделения, концентрирования и очистки веществ и создаются все новые в связи с актуальностью задач получения и анализа суперчистых материалов с заданными свойствами, например, для наноэлектроники, полупроводниковой и вычислительной техники, биологических препаратов нового поколения. Наиболее распространенными из них являются: Ø методы испарения (перегонка, упаривание и отгонка); Ø озоления; Ø экстрагирования; Ø осаждения и соосаждения; Ø управляемой кристаллизации; Ø сорбционные и ионообменные методы; Ø электрохимические методы. Применение каждого из методов очистки определяется как выбранной методикой анализа, так и физико-химическими свойствами системы (агрегатное состояние компонентов, химическая и термическая устойчивость веществ, содержание определяемого компонента в исходной пробе и т. д.). Как правило в основе процесса очистки лежит либо химическая реакция (реакции осаждения, ионного обмена, окисления), либо физический процесс (диффузия, адсорбция и десорбция, испарение и конденсация) (рисунок 2.1). 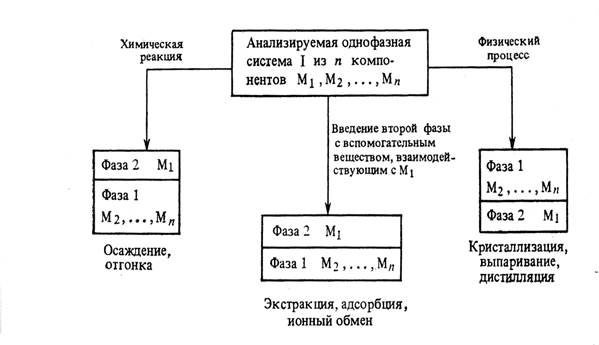 Рисунок 2.1 – общие принципы и способы разделения компонентов на фазы (концентрирования и разделения веществ). Учитывая многообразие способов концентрирования веществ, поясним значение некоторых терминов. Разделение –это операция, в результате которой компоненты, входящие в исходную смесь, отделяются друг от друга. Концентрирование – это процесс, в результате которого содержание определяемого или очищаемого компонента в веществе повышается, по сравнению с его исходным содержанием. Концентрирование может быть абсолютным и относительным. Абсолютное концентрирование – это перевод микрокомпонента (примеси) из исходного образца большого объема или массы, в новый образец с меньшим объемом (массой). Такое концентрирование происходит при процессах экстрагирования, осаждения, перегонки и т. д. Относительное концентрирование (обогащение) заключается в увеличении содержания интересующего компонента в исходном образце по отношению к другим компонентам или растворителю. Например, при упаривании раствора или озолении пробы. Испарение – процесс перехода вещества из жидкой или твердой фазы в газообразную, который осуществляется тем или иным путем. Методы испарения можно реализовать в виде перегонки и отгонки (упаривания, выпаривания и возгонки). Перегонка – это разделение жидких смесей, основанное на переводе летучего компонента в газовую фазу путем испарения его и последующей конденсацией. Конденсат – продукт, образующийся при охлаждении газовой или паровой фазы. Отгонка – удаление летучих компонентов из твердых веществ (порошков, кристаллов) или растворов при нагревании. Упаривание – метод отгонки, в процессе которого происходит удаление части растворителя и летучих примесей в следствии длительного нагрева пробы. При упаривании часть основы (обычно растворителя) остается в образце. Выпаривание (до суха) сопровождается полным удалением растворителя и летучих компонентов из исходного образца. Возгонка или сублимация – это процесс, при котором твердое вещество переводят в газовую фазу минуя стадию плавления. Продукт конденсации, образующийся в процессе возгонки называют сублиматом. Озоление – метод, при котором исходный образец путем нагрева переводят в минеральный остаток, называется золой. Его используют обычно при анализе различных веществ на содержание микроэлементов или общего количества органических веществ (анализ почв). Различают сухое озоление, когда пробу вещества калят в тигле при нагреве не выше 500ºС, и влажное (мокрое). При влажном озолении исходную навеску вещества помещают в тигель и обрабатывают либо кислотами, либо ще6лочами, а образующиеся летучие продукты удаляются в процессе ее прокаливания. Озоление можно рассматривать как частный случай минерализациипробы. Метод перегонки (дистилляция) Перегонка (дистилляция)относится к группе методов, базирующихся на термическом испарении веществ, и применяется для очистки воды и разделения органических жидкостей с относительно близкими температурами кипения. Она основана на различии в летучести веществ. Сущность процесса перегонки заключается в том, что в испарителе смесь веществ (обычно раствор) нагревают выше температуры кипения наиболее летучего компонента. Образовавшаяся таким образом газовая (паровая) фаза имеет более высокую концентрацию летучего компонента, по сравнению с исходным раствором. Эту фазу затем охлаждают (конденсируют) в холодильнике, получая на его выходе конденсат (жидкость либо твердое вещество), обогащенный наиболее летучим соединением. При необходимости процесс повторяют до тех пор, пока не будет достигнута необходимая степень разделения или концентрирования компонентов. Процесс перегонки можно охарактеризовать количественно, рассчитав коэффициент распределения D. Пусть имеется 2-х компонентная идеальная система А + В (отсутствует межмолекулярное взаимодействие, а компоненты химически инертны по отношению друг к другу). При нагревании такой системы до температуры испарения, например компонента А, получим газовую фазу, которая находится в равновесии с оставшимся раствором. При этом газовая фаза обогатится более летучим компонентом А, а в оставшемся растворе возрастет соответственно концентрация компонента В. Молярные доли компонентов А и В в обеих фазах связаны соотношением: где уА и уВ – молярные доли в газовой фазе; a = 1/D – коэффициент разделения (относительная летучесть); хА и хВ – молярные доли компонентов в жидкой фазе. Учитывая, что x + y = 1 – сумма молярных долей компонентов в исходном растворе, и xA + xВ = x; yA + yВ = y, то коэффициент распределения D можно вычислить из соотношения: D = 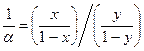 . (2.2) . (2.2)Формула (3.2) может быть преобразована с помощью уравнения Клаузиуса-Клапейрона в выражение для приближенного вычисления летучести компонентов: lga = 8,9 где Ткип(А) и Ткип(В) – температуры кипения разделяемых компонентов А и В соответственно. Из формулы 2.3 следует, что чем выше разница в температурах кипения разделяемых компонентов, тем выше степень их разделения в одностадийном процессе. В пищевой, фармацевтической и химической промышленности дистилляция - это один из способов водоподготовки, который применяется наряду с ионным обменом. Для аналитических целей пригодна вода либо однократной очистки (дистиллят), либо двукратной – бидистиллят. Одностадийная дистилляция обычно используется для разделении веществ со значительной разницей в температурах кипения. При этом анализируемым компонентом может обогащаться как жидкая фаза, остающаяся после дистилляции, так и газовая фаза, а значит и образующийся конденсат Этот метод непригоден для азеотропных смесей (системы, в которых состав газовой и жидкой фазы одинаковы и находятся в состоянии равновесия). В этом случае полного разделения компонентов достичь невозможно. Метод ступенчатой дистилляции (ректификации) осуществляют в специальных колоннах и используют при разделении на фракции многокомпонентных гомогенных смесей жидкостей с достаточно близкими температурами кипения. Он широко распространен в перерабатывающей промышленности, в частности, при получении продуктов перегонки нефти, таких как: петролейные эфиры, бензины, керосины и масла. При очистке продуктов с низкой термической устойчивостью, присущей для некоторых органических и биологически активных веществ, осуществляют молекулярную дистилляцию - низкотемпературная дистилляция в высоком вакууме, которую проводят при остаточном давлении 1,3 – 1,8 кПа и ниже. В этом случае процесс разделения и концентрирования может протекать либо без нагрева, либо при температурах, значительно ниже комнатной. Молекулярная дистилляция используется при производстве фармацевтических препаратов и биоактивных пищевых добавок. Методы отгонки. Отгонку делят на простую или выпаривание и возгонку (сублимацию). При выпариваниивещества удаляются в форме готовых летучих соединений. Осуществить выпаривание можно различными способами: нагреванием снизу (водяные и песчаные бани); сверху (инфракрасные лампы), используя сушку под вакуумом (лиофильная сушка) - для исключения потерь связанной влаги или термически неустойчивых компонентов. Выпаривание позволяет к примеру, значительно повысить концентрацию солей в растворе (получение рапы). Частный случай выпаривания – упаривание до суха. Этот прием применяют, когда необходимо или значительно повысить концентрацию нелетучего компонента, или растворитель и летучие примеси мешает проведению анализа. При упаривании вещество сначала длительно осторожно нагревают (выпаривают) до образования практически сухого остатка. Иногда применяют дополнительно прокаливание сухого остатка при более высокой температуре, чтобы удалить следовые количества растворителя. Качество выпаривания можно контролировать по изменению массы сухого остатка. Отгонка будет более эффективна, если на вещество воздействовать еще и химически с помощью реагентов – сухая и мокрая минерализация. Минерализацию образцов широко используют в элементном органическом анализе. Пробу, органическую или биологическую, помещают в трубчатую печь или автоклав, через которую продувают воздух или кислород. В процессе окисления (сжигания) ее образуются летучие соединения такие, как CO, CO2, N2 , SO2, SO3, которые легко могут быть определены с помощью специальных приборов – газоанализаторов или, после селективного поглощения (адсорбции) газов, по стандартной методике. При сухой минерализации погрешность анализа выше, чем при мокрой. Это обусловлено потерями легколетучих компонентов и отчасти нелетучих, захватываемых каплями образовавшегося аэрозоля. Снижения потерь вещества при сухой минерализации можно добиться при использовании автоклавов (устройства для нагрева при повышенном давлении). Мокрая минерализация заключается в воздействии на пробу минеральных кислот или щелочей в комплексе с окислителями (H2O2, KClO3, KMnO4), растворение устойчивых соединений проводят в автоклавах при нагреве и повышенном давлении, а определение – в специальных камерах, соединенных с анализатором. Эффективно также применение ряда твердых, жидких и газообразных минерализаторов, способных селективно переводить некоторые труднорастворимые вещества в газовую фазу (галогены и галогеноводороды, CCl4, AlCl3, BBr3). Сублимация это вариант отгонки, который заключается в разделении веществ путем перевода одного или нескольких компонентов при нагревании в газовую фазу минуя жидкую. Для этой цели применяют устройства - сублиматоры, состоящие из испарителя и зоны сублимации с более низкой температурой (вплоть до отрицательных). В зоне сублимации при конденсации газов вновь образуется твердое вещество (сублимат). Этот метод можно использовать в том случае, когда разделяемые компоненты, например, плохо растворимы или трудно плавятся. Ограниченное применение сублимации обусловлено малым количеством пригодных для этой цели матриц. Примером сублимационной очистки в аналитических целях служит отделение кристаллического иода от нелетучих примесей. На качество очистки при сублимации влияют размер частиц и однородность распределения компонентов в них. Поэтому более качественной будет отгонка в тщательно измельченных пробах, а также в тех, где отгоняется основное вещество (макрокомпонент), а не примеси (микрокомпоненты). Для низко температурного полного обезвоживания неустойчивых веществ применяют низкотемпературную отгонку под вакуумом – сублимационная сушка, которую можно рассматривать как вариант лиофильной сушки, выполняемой в более жестком режиме. Метод экстрагирования. Метод экстракционного разделения (экстракция) широко применяется не только в химическом анализе, но и на производстве, так как позволяет сконцентрировать анализируемое вещество в небольшом объеме раствора. Процесс экстракции основан на избирательном извлечении одного или нескольких компонентов из смеси жидких или твердых фаз с помощью органического растворителя (экстрагента) не смешивающегося с водой. В основе процесса экстракции - различие растворимости компонентов смеси в водной и органической фазах. В органических веществах (спиртах, эфирах, бензинах и т.д.) хорошо растворяются многие неорганические соли (нитраты, хлориды, роданиды) и комплексные соединения. Более эффективно извлечение происходит при применении смеси экстрагентов. Явление возрастания степени извлечения при воздействии смеси экстрагентов называют синергизмом. Степень извлечения можно также повысить, добавляя в экстрагент экстракционный реагент, например, дитизон или оксихинолин, формирующие комплексы со многими катионами металлов. В результате проведения экстракции получается экстракт, который может быть как в виде раствора, так и сухого вещества (сухие экстракты). Сухие экстракты обычно образуются из жидких путем их высушивания каким-либо способом. К основным понятиям этого метода относят: Ø реэкстракция – процесс извлечения выделяемого компонента из экстракта в водную или иную фазу; Ø реэкстрагент – раствор реагента (чаще водный), используемый для извлечении вещества из экстракта; Ø соэкстрагент – органический или иной растворитель, применяемый в смеси с основным экстрагентом с целью повышения селективности процесса или степени экстракции; Ø синергизм – существенное повышение степени извлечения (экстракции) при использовании смеси экстрагентов, по сравнению с действием каждого из них по-отдельности; Ø экстрагент – органический или иной растворитель, извлекающий компонент из водного раствора; Ø экстракционный реагент – составная часть экстрагента, реагент, образующий с извлекаемым веществом хорошо растворимое в экстрагенте соединение, чаще всего - органический комплекс; Ø экстракт – органическая фаза, содержащая выделяемый компонент; Ø экстрактор – аппарат для проведения экстракции. Конструкции экстракторов достаточно разнообразны (рис. 2.2) и подбираются в зависимости от условий проведения процесса и применяемых реагентов. 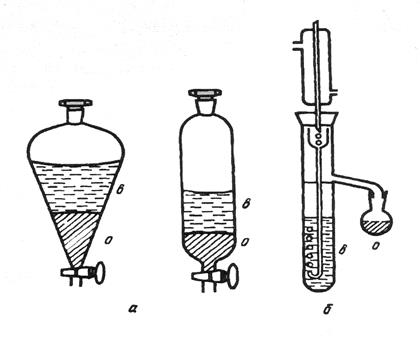 Рисунок 2.2 – Cхемы экстракторов различного назначения (в – водная фаза; о – органический растворитель): а – делительные воронки (случай, когда плотность экстрагента выше, чем водной фазы); б – прибор непрерывной экстракции (при плотность экстрагента ниже, чем воды). Различают: периодическую экстракцию (выполняется отдельными порциями экстрагента), непрерывную (при постоянном перемещении фаз друг относительно друга, при этом водная фаза обычно неподвижна) и противоточную, где органическая фаза постоянно перемещается через серию экстракционных трубок, содержащих свежие порции водного раствора. В качестве простейшего экстрактора можно использовать делительную воронку с двумя кранами (рис. 2.2 – а), которая применяется для выполнения периодической экстракции. После заполнения воронки водно-органической смесью раствора, ее энергично встряхивают и дают отстояться, через нижний кран осторожно удаляют водный раствор (если плотность органического реагента меньше, чем водного), стараясь, чтобы экстракт остался в воронке. Разделение фракций протекает с высокой скоростью в течении 1 – 3 минут. Если плотность органической фазы выше, чем водной, то в нижней части воронки будет скапливаться экстракт, который затем также осторожно удаляется. |
