егэ. Сборник тематических заданий ОГЭ по химии 2022. Сборник тематических заданий основного государственного экзамена по химии
 Скачать 6.66 Mb. Скачать 6.66 Mb.
|
|
24 Проведите химические реакции между бромидом меди(II) и выбранными веществами в соответствии с составленными уравнениями реакции, соблюдая правила техники безопасности, приведённые в инструкции к заданию. Проверьте, правильно ли указаны в ответе на задание 23 признаки протекания реакций. При необходимости дополните ответ или скорректируйте его. Задание 18.  Дана соляная кислота, а также набор следующих реактивов: цинк, оксид кремния, растворы нитрата бария, карбоната калия, сульфата железа(II).  23 Используя только реактивы из приведённого перечня, запишите молекулярные уравнения двух реакций, которые характеризуют химические свойства соляной кислоты, и укажите признаки их протекания (запах газа, цвет осадка или раствора).  24 Проведите химические реакции между соляной кислотой и выбранными веществами в соответствии с составленными уравнениями реакции, соблюдая правила техники безопасности, приведённые в инструкции к заданию. Проверьте, правильно ли указаны в ответе на задание 23 признаки протекания реакций. При необходимости дополните ответ или скорректируйте его. Задание 19.  Дан раствор гидроксида калия, а также набор следующих реактивов: растворы пероксида водорода, хлорида железа(III), фосфата калия, нитрата меди(II), серной кислоты.  23 Используя только реактивы из приведённого перечня, запишите молекулярные уравнения двух реакций, которые характеризуют химические свойства гидроксида калия, и укажите признаки их протекания (запах газа, цвет осадка или раствора).  24 Проведите химические реакции между гидроксидом калия и выбранными веществами в соответствии с составленными уравнениями реакции, соблюдая правила техники безопасности, приведённые в инструкции к заданию. Проверьте, правильно ли указаны в ответе на задание 23 признаки протекания реакций. При необходимости дополните ответ или скорректируйте его. Задание 20.  Дан раствор сульфата алюминия, а также набор следующих реактивов: фосфат кальция, соляная кислота, растворы аммиака, нитрата лития и нитрата бария.  23 Используя только реактивы из приведённого перечня, запишите молекулярные уравнения двух реакций, которые характеризуют химические свойства сульфата алюминия, и укажите признаки их протекания (запах газа, цвет осадка или раствора).  24 Проведите химические реакции между сульфатом алюминия и выбранными веществами в соответствии с составленными уравнениями реакции, соблюдая правила техники безопасности, приведённые в инструкции к заданию. Проверьте, правильно ли указаны в ответе на задание 23 признаки протекания реакций. При необходимости дополните ответ или скорректируйте его. Краткая теория к заданиям ОГЭ по химии Задание 1. Атомы и молекулы. Химический элемент. Простые и сложные вещества Названия химического элемента и простого вещества в большинстве случаев совпадают, поэтому следует различать эти два понятия. Химический элемент — это определённый вид атомов. Атомы химического элемента могут входить в состав простых и сложных веществ. Можно охарактеризовать распространённость и формы нахождения химического элемента в природе, а также свойства его атомов (массу, размеры, строение). Простое вещество образовано атомами одного химического элемента. Это одна из форм существования химического элемента в природе. Простое вещество характеризуется определённым составом, строением, физическими и химическими свойствами. Его применяют для получения других веществ.
Задания 2, 6. Строение атома. Строение электронных оболочек атомов Порядковый номер элемента численно равен заряду ядра его атома, числу протонов в ядре N и общему числу электронов в атоме. Число электронов на последнем (внешнем) слое определяется по номеру группы химического элемента. Число электронных слоев в атоме равно номеру периода. Массовое число атома A (равно относительной атомной массе, округленной до целого числа) - это суммарное количество протонов и нейтронов.
Количество нейтронов N определяют по разности массового числа А и числа протонов Z. Изотопы – атомы одного химического элемента, имеющие в ядре одинаковое число протонов, но разное число нейтронов, т.е. одинаковый заряд ядра, но разную атомную массу. Задание 3. Периодический закон и Периодическая система элементов Задание 4. Валентность и степень окисления химических элементов Степень окисления – условный заряд атома в соединении, вычисленный исходя из предположения, что все связи в этом соединении ионные (т.е. все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента). Правила определения степени окисления элемента в соединении: С.О. свободных атомов и простых веществ равна нулю. Сумма степеней окисления всех атомов в сложном веществе равна нулю. Металлы имеют только положительную С.О. С.О. атомов щелочных металлов (I(А) группа) +1. С.О. атомов щелочноземельных металлов (II(А) группа)+2. С.О. атомов бора, алюминия +3. С.О. атомов водорода +1 (в гидридах щелочных и щелочноземельных металлов –1). С.О. атомов кислорода –2 (исключения: в пероксидах –1, в OF2 +2). С.О. атомов фтора всегда - 1. Степень окисления одноатомного иона совпадает с зарядом иона. Высшая (максимальная, положительная) С.О. элемента равна номеру группы. Это правило не распространяется на элементы побочной подгруппы первой группы, степени окисления которых обычно превышают +1, а также на элементы побочной подгруппы VIII группы. Также не проявляют своих высших степеней окисления, равных номеру группы, элементы кислород и фтор. Низшая (минимальная, отрицательная) С.О. для элементов неметаллов определяется по формуле: номер группы -8. * С.О. – степень окисления Валентность атома – это способность атома образовывать определенное число химических связей с другими атомами. Валентность не имеет знака. Валентные электроны располагаются на внешнем слое у элементов А - групп, на внешнем слое и d – подуровне предпоследнего слоя у элементов В - групп. ( Валентности некоторых элементов (обозначаются римскими цифрами).
Примеры определения валентности и С.О. атомов в соединениях:
Задание 5. Строение молекул. Химическая связь 1) Ковалентная неполярная – атомы в молекуле одинаковы:N2, O2, O3, CI2,Br2, I2,F2 (ЭО одинакова) 2)Ковалентная полярная - атомы в молекуле состоят из разных атомов неметаллов – ЭО отличается незначительно, появляется смещение электронной пары к более ЭО элементу - кислотные оксиды, например: N2O5, P2O5, SO2, Н2О , все кислоты Н2S, HCl 3)ионная связь- между ионами: металла и неметалла- ЭО резко отличается, металл отдает электрон неметаллу (основные оксиды СаО, щелочи, н-р NaOH, соли н-р, NaCI , нитриды , фосфиды, карбиды, силициды металлов, при гидролизе которых образуются соответственно аммиак (NH3), фосфин (PH3) , метан CH4 (Al4C3) или ацетилен C2H2 (CaC2) и силан (SiH4). Ионная связь в солях аммония! (NH4Cl, NH4NO3 и т.д.) 4) металлическая связь ионы металла Кристаллические решетки: 1)атомные – в узлах атомы, это вещества с ковалентной связью, с высокой температурой плавления, твердые- алмаз, графит (С), SiO2 2)молекулярные- в узлах молекулы, это газы, жидкости, низкая тем. пл. и кипения, хрупкие (иод), твердые - сера 3) ионные, с высокой темпер. плавления, твердые –это соли 4) металлические в узлах ионы металлов Задание 7. Простые и сложные вещества. Классы неорганические соединений 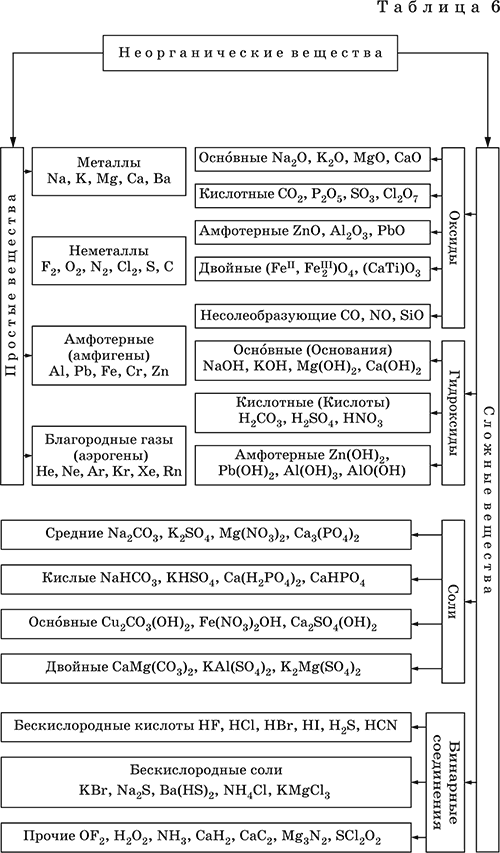 Задания 8, 9, 10. Химические свойства простых веществ: металлов и неметаллов Химические свойства классов неорганических соединений Свойства металлов
С кислотами взаимодействуют только металлы, которые находятся в ряду активности левее водорода. Т.е. неактивные металлы Cu, Hg, Ag, Au, Pt с кислотами не реагируют. Исключение составляют HNO3 (конц, разбавл.), H2SO4 (конц.) HNO3 (конц.), H2SO4 (конц.) пассивируют Fe, Al, Сr (при н.у.) Cu,Hg, Ag восстанавливают кислоты до следующих продуктов:
Химические свойства неметаллов Неметаллы реагируют с металлами и между собой. 1) H2+Ca →CaH2 2) N2+ 3Ca → Ca3N2 3) N2+ O2 ↔ 2NO 4) S + O2 → SO2 5) N2+ 3H2 → 2NH3 6) 2P + 3Cl2 → 2PCl3 или 2P + 5Cl2 → 2PCl5 Свойства галогенов можно объединить: 1) реагируют со щелочами: Cl2 + 2NaOH → NaCl + NaClO + H2O (в холодном растворе) 3Cl2 + 6NaOH → NaCl + 5NaClO3 + H2O (в горячем растворе) 2) более активный галоген (вышестоящий в группе, кроме фтора, так как он реагирует с водой) вытесняет менее активные галогены из растворов галогенидов. Cl2 + 2KBr →Br2 + 2KCl, но Br2 + KCl ≠ 3) 2F2 + O2 → 2O+2F2 (фторид кислорода) 4) Запомнить: 2Fe + 3Cl2 → 2Fe+3Cl3 и Fe + 2HCl → Fe+2Cl2 + H2 Окислительные свойства галогенов усиливаются по группе снизу вверх. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
