Заразные болезни (книга). Сибирская язва (Anthrax) остропротекающая инфекционная болезнь, характеризующаяся признаками септицемии и тяжелой интоксикации, а также образованием карбункулов
 Скачать 3.81 Mb. Скачать 3.81 Mb.
|
можна ретроспективная диагностика в реакции нейтрализации с сывороткой крс*п переболевшей птицы. Вирус болезни, как правило, не вызывает гибели куриь^ эмбрионов, и поэтому учет реакции проводят по специфическим поражениям хорр аллантоисной оболочки2. Цистицеркозы животных, при которых дефинитивным хозяином является человек. 2. Цистицеркоз (бовисный) крупного рогатого скота. Цистицеркоз (бовисный) вызывается личиночной стадией бычьего цепня семейства Taeniidae, класса Cestoda. Заболевание характеризуется острым или хроническим течением в результате поражения личинками (цистицеркусами) поперечнополосатой мускулатуры дефинитивных хозяев. Локализация личинок — скелетная мускулатура, мышцы языка, сердца, наружные и внутренние жевательные мышцы, реже — печень и мозг. Возбудитель. Cysticercus bovis — пузырь серовато-белого цвета, овальной формы, длиной 5—9 мм и шириной 3—6 мм. На внутренней поверхности пузыря имеется одна головка с четырьмя присосками (невооруженный сколекс). Внутри пузыря содержится прозрачная жидкость. Наружная соединительная оболочка личинки образована из тканей хозяина в результате ответной иммунной реакции его организма на жизнедеятельность личинки. На собственной оболочке тела личинки обнаруживают ворсинки подобно тегументу взрослых цестод. Taeniarhynchus saginatus (бычий цепень) достигает в длину 10 м и более при ширине последних зрелых члеников 12—14 мм. В зрелых члениках от основного ствола, расположенного вдоль оси, в обе стороны отходят 18—32 боковых ответвления. В таких члениках длиной около 2 см насчитывается около 175 тыс. яиц. Матка закрытого типа. Сбоку от членика открывается половое отверстие. Яйца округлой формы, с толстой двуконтурной оболочкой и выраженной поперечной исчерченностью. Внутри расположена онкосфера (эмбриональная личинка с тремя парами крючьев). В гермафродитных члениках яичник имеет две лопасти почти одинаковых размеров. У людей заболевание называется тениаринхоз. Биология развития. Бычий цепень — биогельминт. Человек — дефинитивный хозяин. Локализуется цепень в тонком кишечнике. По мере созревания гельминта зрелые членики отрываются и с фекалиями выделяются наружу, где могут, как многие цестоды из семейства Taeniidae, переползать на значительные расстояния, сокращаясь червеобразно. При этом на своем пути они оставляют большое количество яиц, которые выходят из разорванных трубочек матки. Промежуточные хозяева (крупный рогатый скот, буйволы, зебу, яки, северные олени) заражаются, поедая яйца и членики гельминта на пастбищах во время кормления и поения. 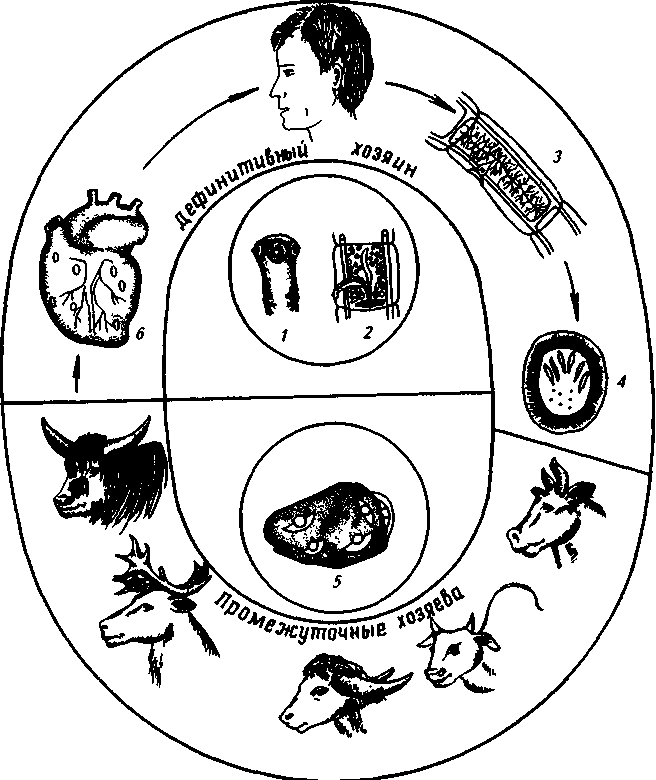 Рис. 18. Биология развития Т. saginatus: 1- сколекс цепня; 2 - гермафродитный членик; 3 - зрелый членик; 4 -яйцо, 5 - мышцы, пораженные цистицТртусами; б - цистицеркусы в сердечной мускулатуре и в кишечнике животных из яиц выходят онкосферы, которые через слизистую оболочку внедряются в мелкие кровеносные сосуды а затем заносятся в самые различные органы и ткани. Однако онкосферы у крупного рогатого скота преимущественно оседают в тех органах, где интенсивно циркулирует кровь. Через 3—4,5 мес цистицеркусы достигают максимальной величины и становятся инвазионными. Имеются сведения о том, что у однократно зараженных животных цистицеркусы живут около трех лет, но, по некоторым данным, дегенерация личинок начинается через 4 нед после заражения животного. Возбудителем тениаринхоза человек заражается при употреблении мяса, пораженного цистицеркусами. Это обычно происходит тогда, когда мясо недостаточно проварено, прожарено, провялено. В кишечнике человека под влиянием желчи и кишечных соков цистицеркусы выворачивают сколекс (в пузыре он во ввернутом внутрь состоянии), и при помощи мощных присосок он прикрепляется к слизистой тонкой кишки. В дальнейшем личинка быстро растет и развивается, достигая половой зрелости за 2,5—3 мес. Зрелые цестоды ежесуточно выделяют в среднем 6—8 члеников, а за год — 2,5 тыс., или около 51 млн 100 тыс. яиц. Продолжительность жизни тениаринхуса в кишечнике человека более 10 лет. Эпизоотологические данные. Инвазия встречается во всех странах. В отдельных странах ближнего зарубежья — в Азербайджане, странах Средней Азии, Казахстане. В России чаще встречается в Дагестане, Алтайском крае, Якутии, а также в многочисленных областях Нечерноземья. В пригородных хозяйствах одним из важных источников распространения яиц возбудителя служат сточные воды, используемые для полива пастбищ и кормовых культур. Немаловажное значение имеют факты, когда проводятся некачественная экспертиза туш и мяса, подворный убой скота и несвоевременное выявление больных тениаринхозом людей — источников распространения инвазии. Возрастные особенности имеют важное значение в заражении животных. Например, в Азербайджане возрастная динамика зараженности крупного рогатого скота составила: 1,5—2 года — 28,5 %, 2—4 года — 14,4, 5—6 лет — 8,0 и 9—12 лет — 2,08 %. Таким образом, видно, что молодые животные более интенсивно и чаще подвержены инвазированию, нежели взрослые животные. По данным В. Ф. Галат, в значительной степени бовисными цистицерками заражены дикие животные национального парка Серенгети (Танзания): газели Томпсона и Гранта, буйволы и антилопы-гну. Исследователями и практическими ветеринарными работниками признано существование среди животных штаммовых различий для некоторых географических зон. Штаммы характеризуются по приживаемости и продолжительности жизни в организме хозяина и месту локализации. Так, в Судане и Эфиопии цистицеркусы крупного рогатого скота в основном локализуются в печени больного крупного рогатого скота, а в РФ — это редкое явление. Данное заболевание представляет значительную проблему для оленеводческих хозяйств Севера. Возбудителем цистицеркоза крупного рогатого скота заражаются и олени. При этом личинки достигают инвазионной стадии лишь под оболочками головного мозга. Жители Севера заражаются при употреблении в пищу сырого мозга оленя. На эпизоотологию заболевания влияют сезонность и связанные с ней факторы. Крупный рогатый скот заражается яйцами возбудителя главным образом на пастбищах и прифермских участках весной и осенью. Отсутствие благоустроенных туалетов на фермах и нарушение ветеринарно-санитарных правил также способствуют распространению яиц гельминта. Яйца цестоды при 18 °С сохраняют жизнеспособность до 1 мес. На пастбищах они выживают под снегом до весны, на открытом воздухе при —14 и —38 °С — до 2,5 мес. В члениках яйца погибают быстрее вследствие гнилостного распада. В 5%-ном растворе карболовой кислоты яйца погибают через две недели, а в 10%-ном растворе формалина остаются жизнеспособными до трех недель. В последние годы установлено, что больные тениаринхозом люди, пренебрегая санитарными нормами на фермах, загрязняют яйцами цестоды помещения и корма, в результате чего происходит заражение значительного поголовья животных. Патогенез и иммунитет. Болезнетворное влияние цистицеркусов в основном проявляется в период их миграции. Множество онко-сфер, проникая в слизистую кишечника и мелкие капилляры, нарушают их целостность и одновременно инокулируют микрофлору.- ' Продукты метаболизма личинок оказывают аллергическое и токсическое влияние на весь организм. Подрастая в мышцах, цистицеркусы сдавливают окружающую ткань, и развивается миозит. В местах локализации личинок начинается воспаление (скапливаются фибробласты, гистиоциты, лимфоциты и эозинофилы), что способствует образованию соединительнотканной капсулы, богатой капиллярами. В волокнах мышц исчезает поперечная исчерчен-ность. В дальнейшем личинки адсорбируют соли кальция и другие элементы, постепенно гибнут и в пузыре жидкость замещается минеральными солями. Переболевание животных цистицеркозом ведет к развитию иммунитета, на что указывает наличие антител, выявляемых серологическими реакциями. Иммунитет крупного рогатого скота при цистицеркозе относительный. Опыты по искусственной иммунизации животных против цистицеркоза показали, что этот способ может стать эффективным при профилактике данного заболевания. Симптомы болезни. Симптомы болезни проявляются в соответствии с патогенезом. Нарушается пищеварение, ухудшается работа сердца, в нижних частях тела появляются отеки и асциты. При инвазии сильной степени животные угнетены, отмечаются слабость, дрожь, парезы конечностей и высокая температура (39,8—41,8 °С). Телята чаще лежат, развивается атония преджелуд-ков. Иногда наблюдаются зуд кожи, болезненность брюшной и грудной мускулатуры. Инвазия слабой степени в обычных условиях содержания животных протекает незаметно. По истечении 1,5— 2 нед с начала заражения симптомы болезни сглаживаются и животные выглядят клинически здоровыми. Патологоанатомические изменения. При остром течении инвазии в пораженных мышцах, брюшине, селезенке, других органах и тканях обнаруживают значительное количество точечных кровоизлияний и мелких цистицеркусов. Брыжеечные лимфоузлы увеличены, сочны на разрезе. При хроническом цистицеркозе скелетные мышцы серого цвета, видны студенистые личинки светло-серого цвета. Диагностика. При жизни на основании симптомов болезни поставить точный диагноз затруднительно. Поэтому более эффективны иммунологические методы диагностики. В настоящее время разработаны внутрикожная аллергическая проба, реакция латексагглю-тинации (РЛА) и реакция непрямой гемагглютинации (РНГА). Для выявления неблагополучных хозяйств наиболее результативно исследовать сыворотку крови по РНГА, количество положительных случаев составляет 92,8 %. Однако на сегодняшний день на практике наиболее эффективным и приемлемым является послеубойный осмотр туш. Как правило, интенсивнее поражается передняя часть туловища животных, особенно наружные и внутренние жевательные мышцы, мышцы языка и сердца. Для осмотра делают продольные и поперечные разрезы, а при необходимости дополнительно — разрезы шейных и поясничных мышц. Послеубойный осмотр туш и мяса при помощи люминесцентной лампы ОЛД-41 существенно повышает эффективность исследования. Осмотр проводят в темном помещении. Через 5—7 мин после включения лампа готова к работе. Площадь освещения лампы равна 100 см2 с расстояния 50—60 см. Через 1,5—2 ч работы ее надо отключить. Обычно личинки светятся темно-вишневым или красным светом. Эффективность этой лампы велика, особенно при осмотре фарша. При замораживании мяса личинки погибают, но не перестают светиться. Поэтому определить жизнеспособность личинки при помощи лампы нельзя. При варке мяса люминесценция личинки исчезает через 80—90 мин. Цистицеркусов (финн) необходимо дифференцировать от молодых тонкошейных пузырей, у которых головка вооружена и локализуется главным образом на серозных покровах. Лечение. При цистицеркозе лечение крупного рогатого скота разработано недостаточно, хотя в последние годы получены довольно эффективные результаты при применении празиквантела (дронцита). Профилактика и меры борьбы. Для профилактики цистицеркоза животных и, следовательно, тениаринхоза человека необходимо разорвать цикл развития возбудителя. В связи с этим проводят комплекс ветеринарно-санитарных мероприятий: - запрещение подворного убоя животных и реализации мясных продуктов без ветосмотра на мясокомбинатах, убойных пунктах и т. д.; - пропаганда ветеринарных знаний о гельминтоантропозоонозах среди животноводов и населения неблагополучных хозяйств; - ветеринарно-санитарный контроль за состоянием ферм, убойных пунктов и площадок; биркование убойных животных; - техническая утилизация туш и субпродуктов при обнаружении на разрезах мышц более трех цистицеркусов. Кроме того, осуществляют медико-санитарные мероприятия: - укрепление делового контакта медицинских и ветеринарных служб; - периодическая диспансеризация животноводов и населения неблагополучных хозяйств. При обнаружении гельминтоза у людей их необходимо дегельминтизировать в условиях медицинских учреждений и провести профилактику рассеивания яиц и члеников гельминта; - создание на животноводческих фермах санитарно-гигиенических условий с целью профилактики инвазии. 3. Диагностика, дифференциальная диагностика и организация лечебно-профилактических мероприятий респираторных заболеваний птицы. Грипп Диагноз. На основании эпизоотологических особенностей проявления гриппа, характерных клинических признаков и патологоанатомических изменений можно поставить лишь предположительный диагноз. Для окончательного диагноза необходимо провести лабораторные исследования патологического материала (легкие, печень, головной мозг и др.), взятого от павших птиц в острую стадию болезни. Трупный материал должен быть свежим или законсервированным холодом ( — 60 °С), или 50 %-ным р-ром глицерина. Для серологических исследований от кур берут парные сыворотки крови в различные периоды развития болезни. Вируссодержащий материал подготавливают обычным способом на буферном растворе, добавляют к 1 мл жидкости по 5 тыс. ЕД стрептомицина и пенициллина и проводят заражение 9 —12-дневных куриных эмбрионов в аллантоисную полость. Через 48 ч после заражения берут аллантоисную жидкость и исследуют ее на наличие вируса в реакции гемагглютинации. Так же используют многослойные культуры клеток куриного эмбриона для изучения ЦПД, возникающего через 36 ч после заражения. Для биологической пробы используют 2 —4-месячных цыплят, которым внутримышечно вводят 0,5—1 мл суспензии. Через 3 — 5 дней при наличии вирулентного вируса у цыплят возникают респираторные симптомы болезни, иногда со смертельным исходом Если вирус слабовирулентный, единственным доказательством его наличия служит выявление нарастания титра антител, появляющихся на 4—10-й день после заражения. Из серологических методов можно использовать РЗГА, РП, РСК. В практических условиях обычно используют наиболее простую и доступную при массовых исследованиях — РЗГА. У переболевшей гриппом птицы эту реакцию можно применить для ретроспективной диагностики. Дифференциальный диагноз. Генерализованную септическую форму гриппа необходимо дифференцировать от ньюкаслской болезни, респираторную форму — от инфекционного бронхита, микоплазмоза, ларинготрахеита и других респираторных болезней Лечение не разработано. Лечить больную птицу нецелесообразно. Ввиду опасности распространения вируса больную птицу уничтожают. Профилактика и меры борьбы. Необходимо обособленно размещать различные возрастные группы птиц на территории, соблюдая при этом необходимые зооветеринарные разрывы. Комплектование птичников и зон проводят только одновозрастной птицей. В межцикловой профилактический перерыв помещения тщательно очищают и трехкратно дезинфицируют. Систематически контролируют благополучие хозяйств по гриппу, из которых завозят инкубационные яйца, проводят дезинфекцию транспорта, оборотной тары и строго выполняют ветери-нарно-санитарные правила для птицеводческих хозяйств. При подозрении на возникновение гриппа птиц срочно уточняют диагноз лабораторным исследованием. При возникновении болезни хозяйство карантинируют. Если установлен грипп в одном птичнике, то больную и подозрительную по заболеванию птицу убивают бескровным методом и уничтожают, остальную условно здоровую убивают на мясо. Проводят тщательную дезинфекцию помещения. При появлении болезни в нескольких птичниках проводят тщательную ежедневную выбраковку и убой больной и ослабленной птицы. При наличии патологоанатомических изменений (перитониты, кровоизлияния в груднобрюшной полости, синюшность мышечной ткани) тушки вместе с органами направляют на техническую утилизацию. При отсутствии изменений проводят полное потрошение тушек, внутренние органы утилизируют, а тушки проваривают и используют для пищевых целей. Яйца, полученные от больной птицы, проваривают в течение 10 мин. Яйца, заложенные в инкубатор из неблагополучных птичников, утилизируют или уничтожают. Для дезинфекции птичников применяют 3%-ный р-р едкого натра (16 — 20°С), экспозиция 7 ч; 3%-ный горячий (70 — 80°С) раствор едкого натра, экспозиция Зч; 1 %-ный р-р формальдегида, экспозиция 1 ч; осветленный р-р хлорной извести с содержанием 3% активного хлора, экспозиция 3 ч; 1 %-ный р-р надуксусной кислоты при экспозиции 6 ч. Дезинфекцию можно проводить также аэрозолями 38—40%-ного р-ра формальдегида (15 мл/м3) или 20%-ного р-ра надуксусной кислоты (20 мл/м3), экспозиция 6 ч. Для дезинфекции тары в хозяйствах и на складах строят камеры объемом от 100 до 500 м3 и оборудуют их вентилятором для удаления газа. Аэрозоли из раствора формальдегида получают с помощью форсунки ПВАН и сжатого воздуха при рабочем давлении 3—4 атм или с помощью генератора АГУД-2. Яйца для инкубации завозят из хозяйств, благополучных по гриппу. Каждую партию выведенного молодняка выращивают в полностью освобожденном о г птицы изолированном помещении, расположенном в оздоравливаемой зоне. По достижении 45-дневного возраста цыплят вакцинируют инактивированной вакциной. Пух, перо, полученное от убоя условно здоровой птицы, просушивают в сушильных установках при температуре 85 — 90 °С в течение 15 мин. При отсутствии сушильной установки пух и перо дезинфицируют в любых приспособленных емкостях 3 %-ным горячим (45 — 50 °С) раствором формальдегида в течение 30 мин и затем сушат. Респираторный микоплазмоз. Диагноз на респираторный микоплазмоз ставят комплексно на основании эпизо-отологических, клинических и патологоанатомических данных с учетом результатов лабораторного исследования. Для выделения микоплазм делают посевы на агар и бульон Эдварда, заражают куриные эмбрионы, ставят биопробу на цыплятах. Для диагностики микоплазмоза птиц можно использовать сывороточно-капельную реакцию агглютинации. Серологическому обследованию подлежит 5—10% стада кур или индеек в возрасте от 2 мес и старше. Дифференциальный диагноз. Необходимо исключить колисептицемию, гемофилез, хронический пастереллез, аспергиллез, инфекционный ларинготрахеит и бронхит. Лечение. Специфических средств лечения нет. Наиболее эффективны антибиотики широкого спектра действия (стрептомицин, хлортетрациклин, эритромицин). В последние годы испытаны спектам, тилозин, фармазин, фрадизин. Наибольшее распространение получили методы группового использования препаратов в присутствии птиц. Их лучше применяют аэрозольно, однократно в течение 4 — 5 дней. Эффективной мерой считается введение раствора аскорбата эритромицина внутрь инкубационных яиц в условиях перепада давления. Препарат подавляет развитие микоплазм. Иммунитет не изучен, специфических биопрепаратов нет. Профилактика и меры борьбы. Профилактика респираторного микоплазмоза рсновывается на комплексе общих мероприятий по предупреждению заноса возбудителя в хозяйство и повышению естественной резистентности птицы. Соблюдают строго изолированное содержание разновозрастных групп птиц. При поточной системе выращивания необходимо предусмотреть перерыв после каждой выращиваемой партии, достаточный для трехкратной дезинфекции и подготовки помещения к приему новой партии. Помещения, инвентарь и оборудование дезинфицируют 2 %-ным подогретым раствором едкого натра. Клеточные батареи и инвентарь моют горячей водой, стены и потолки белят 20 %-ным р-ром свежегашеной извести. Заключительную дезинфекцию проводят парами формальдегида из расчета 20 мл формалина на 1 м3 помещения. Важное значение имеет кратность воздухообмена в птичниках. Завезенные в хозяйство племенные яйца инкубируют в отдельном инкубаторе, выведенный молодняк выращивают изолированно до 6-месячного возраста. При установлении микоплазмоза необходимо наложить ограничительные мероприятия (запрещают вывоз птиц и яиц для племенных целей и перемещение птиц из неблагополучного птичника). Степень распространения микоплазмоза определяют серологическими исследованиями 5 — 10% птиц неблагополучной группы. Особенно важно исследовать кур родительского стада с тем, чтобы исключить трансо-вариальный путь распространения возбудителя микоплазмоза. Больную птицу убивают и сжигают; условно здоровую птицу можно оставлять для получения пищевых яиц и мяса. В дальнейшем необходимо убить всех птиц неблагополучной группы. Помет и подстилочный материал из неблагополучных птичников обеззараживают биотермически. Чтобы признать хозяйство оздоровленным от микоплазмоза, необходимо после проведения комплексных оздоровительных мероприятий получить и вырастить здоровый молодняк. Инфекционный бронхит кур. Диагноз. На основании эпизоотологических данных, клинических признаков и патологоанатомических изменений можно поставить лишь предварительный диагноз на инфекционный бронхит кур. Решающее значение имеет проведение лабораторных исследований — выделение и идентификация вируса и обнаружение специфических антител в парных пробах сыворотки крови птиц. Для выделения и идентификации вируса заражают 8 —10-дневные куриные эмбрионы в аллантоисную полость тканевой суспензией из легких, трахеи и бронхов от убитых больных птиц. Гибель зараженных эмбрионов обычно проявляется на 1 — 3-м пассаже через 36 — 48 ч. Одновременно с выделением вируса проводят экспериментальное воспроизведение болезни на 4 — 6 цыплятах 10 —20-дневного возраста, полученных из хозяйств, благополучных по инфекционному бронхиту; им вводят интратрахеально тканевую суспензию в дозе 0,5 мл. При положительной биопробе через 18 — 36 ч у цыплят развиваются клинические признаки болезни. Выделенный вирус идентифицируют с помощью специфических иммунных сывороток в РН, РИГА, РДП и РИФ. Вируснейтрализующие антитела в основном накапливаются с 11- по 36-й день и сохраняются в сыворотках крови цыплят 483 дня. С помощью РИГА антитела выявляются в течение 187 дней после заболевания. РДП особенно ценна для быстрой диагностики острых случаев болезни, так как антитела можно обнаружить лишь между 7- и 21-м днями после начала заболевания. Однако с помощью РДП антитела к инфекционному бронхиту выявляются лишь в 10—50% случаев. Дифференциальный диагноз. Необходимо исключить инфекционный ларинготрахе-ит, ньюкаслскую болезнь, оспу, грипп, инфекционную бурсальную болезнь, респираторный микоплазмоз, гемофилез. Лечение при инфекционном бронхите не разработано. Иммунитет. Переболевшая птица устойчива к инфицированию гомологичными штаммами вируса. В сыворотке крови антитела сохраняются длительное время, но прямой зависимости напряженности иммунитета от уровня вируснейтрализующих антител нет. Для профилактики болезни за рубежом применяют живые аттенуированные и инакти-вированные вакцины. Профилактика и меры борьбы. Необходимо комплектовать хозяйства клинически здоровой птицей. Для инкубации нужно брать яйца, полученные от птиц, в сыворотке крови которых не выявлены специфические антитела. Инкубационные яйца дезинфицируют до закладки в инкубатор в течение 30 мин парами формальдегида (25 — 30 мл формалина, 17 — 20 г перманганата калия, 12—15 мл воды на 1 м3 камеры). Птицеводческие помещения перед посадкой птицы подвергают дезинфекции растворами формальдегида (1 %-ный), едкого натра (2%-ный), хлорной извести, содержащей 2% активного хлора. Можно проводить дезинфекцию и в присутствии птицы. Для этого используют аэрозоли молочной кислоты, 20%-ного водного раствора резорцина или триэтиленгликоля из расчета 0,025 г препарата на 1 м3 воздуха помещения 2 — 3 раза в день с интервалом 2 ч; распыляют не более 15 — 20 мл р-ра в минуту. При установлении диагноза на инфекционный бронхит хозяйство (отделение, ферма) объявляют неблагополучным и вводят ограничения. Запрещают вывоз яиц, эмбрионов и живой птицы, перемещение птицы, кормов, инвентаря внутри хозяйства; ввоз птицы из других хозяйств и комплектование стада переболевшей птицей. При возникновении болезни в отдельном птичнике больных, слабых и некондиционных птиц убивают на санитарной бойне и подвергают технической утилизации или уничтожают. Остальных птиц отправляют для убоя на птицеперерабатывающее предприятие. При возникновении заболевания в нескольких помещениях в хозяйстве проводят ежедневно тщательную выбраковку и убой больных и слабых птиц на санитарной бойне с последующей переработкой на мясо- ' костную муку. Реализацию яиц через торговую сеть проводят после их дезинфекции парами формальдегида, а тушки убитой птицы направляют на промпереработку или в сеть общественного питания. Помет и глубокую подстилку обеззараживают биотермически. Проводят тщательную механическую очистку и дезинфекцию инкубаторов, птичников, оборудования, инвентаря 2%-ным горячим раствором едкого натра (экспозиция 2 ч) и территории 3%-ным р-ром едкой щелочи с добавлением 1 %-ного р-ра формалина. Помещение дезинфицируют через каждые 2 — 3 дня, а территорию — раз в неделю. Орнитоз. Диагноз ставят на основании клинико-эпизоотологических данных, результатов патологоанатомического вскрытия и обязательно лабораторных исследований, включая микроскопию мазков (обнаружение элементарных телец) и биопробу на белых мышах и куриных эмбрионах В лабораторию посылают труп птицы, завернутый в несколько слоев марли, смоченной 5 %-ным р-ром лизола или фенола С целью подавления бактериальной микрофлоры суспензию патологического материала (1 10) обрабатывают стрептомицином (50 мкг) и пенициллином (по 1000 ЕД/мл). Для диагностики латентных форм орнитоза исследуют сыворотку крови птиц, в РСК. В благополучных хозяйствах у птиц нет комплементсвязывающих антител. Массовые исследования проводят путем внутрикожного введения орнитозного аллергена уткам в межчелюстное пространство, курам — в сережку Через 36—48 ч у уток на месте введения аллергена появляется крарное пятно с плотным бледным инфильтратом в центре, у кур — воспалительная реакция сережки, продолжающаяся 3 — 7 дней. Дифференциальный диагноз орнитоза необходимо проводить в отношении респираторного мйкоплазмоза, вирусного синусита, гриппа и сальмонеллеза уток, нью-каслской болезни и многих других инфекционных болезней. Лечение не проводят. Иммунитет. После переболевания орнитозом возникает нестерильный слабовыраженный и непродолжительный иммунитет. Вакцины не разработаны. Профилактика и меры борьбы. На птицефермах необходимо сие тематически проводить отпугивание дикой птицы, залетающей на тер риторию хозяйства. Вентиляционные каналы и окна производственны: помещений должны быть закрыты металлической сеткой. Выгулы дл: водоплавающей птицы огораживают. Постоянно контролируют зооги гиенические условия содержания птицы и полноценность рациона При необходимости в критические периоды технологии выращивать птицы применяют лечебно-профилактические премиксы, содержащие под титрованные антибиотики и сульфаниламидные препараты. Вновь за везенную птицу карантинируют на 3 месяца. При подозрении на заболевание орнитозом в хозяйстве век больную и подозрительную по заболеванию птицу немедленно изолирую: и принимают меры к уточнению диагноза. Птичники, выгульны! дворики и помещения, в которых находилась больная птица, тщатель но очищают и проводят влажную дезинфекцию осветленным растворох хлорной извести, содержащей 5 % активного хлора, 10 %-ным р-ро.\ лизола, формалин-ксилонафтовой смесью (3:1) из расчета 1 л ш 1м2 поверхности. Можно использовать аэрозоль 40 %-ного р-ра фор мальдегида из расчета 10-15 мл р-ра на 1 м3 помещения. При установлении диагноза на орнитоз в хозяйстве вводя! ограничения. Всю птицу неблагополучных птичников необходимо убип и потрошить на месте. Мясо больных птиц после термической обработки используют в пищу; пух и перо тщательно собирают и сжигают. Благополучные птичники дезинфицируют без вывода птицы аэрозолем молочной кислоты. Ограничения с хозяйства снимают чере: 6 мес после последнего случая выделения больной орнитозом птиць и проведения заключительной очистки и дезинфекции в птичниках. Инфекционный ларинготрахеит. Диагноз. Наличие характерных клинико-эпизоотологических данных и патологсшь. томических изменений позволяет лишь заподозрить возникновение инфекционного Jb. ринготрахеита, окончательный диагноз устанавливают на основании результатов лаборь торных исследований, включающих: а) выделение вируса из содержимого траяя больных кур на куриных эмбрионах или в культуре тканей; б) биологичесг пробу на восприимчивых цыплятах; в) обнаружение внутриядерных включений в гмс |
