Ситуационная задача 36
 Скачать 1.82 Mb. Скачать 1.82 Mb.
|
|
Раствор приготовлен удовлетворительно. Анализ документации проверено верно. Данная пропись содержится в приказе №214. Расчеты сделаны верно. 2. Провизор-аналитик поручил провести анализ раствора студенту, проходившему практику в данной аптеке. Для обнаружения калия-йона студент использовал реактивы: Ион натрия. Графитовую палочку смоченную исследуемым раствором вносят в пламя горелки – пламя окрашивается в желтый цвет Ион калия лучше определять по реакции с гексанитрокобальтатом натрия, так как реакция с винной кислотой менее чувствительная по сравнению с ней. И он кальция. Открывают действием аммония оксалата, образуется белый осадок. Ca2+ + (NH4)2C2O4 CaC2O4 + NH4+ Хлорид-ион раствор подкисляют азотной кислотой и добавляют серебра нитрат образуется белый осадок. Глюкоза определяется с реактивом Фелинга С реактивом Фелинга при нагревании образуется кирпично-красный осадок оксида меди (I) 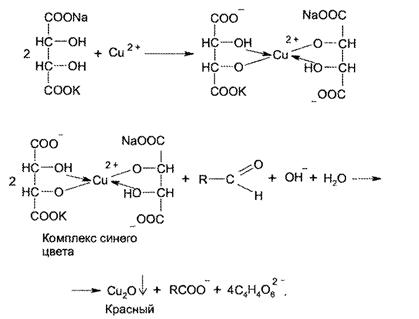 Реактивы выбраны правильно, только не соблюдены условия проведения реакций: студент забыл потереть внутренние стенки пробирки когда проводил реакцию на калий стеклянной палочкой, поэтому осадок не выпал и не добавил азотную кислоту при проведении реакции на хлорид. Количественное определение натрия гидрокарбоната Т= 0,02*84,01:1000=0,001680 X= V*T*K* 5000 : a = 1,5*0,001680*1*5000:5=2,52 Результат завышен. Натрия гидрокарбонат при хранении во влажных условиях переходит в карбонат натрия. Возможно либо субстанция была не качественная с примесью карбоната натрия, или в процессе приготовления, после стерилизации раствор не перемешали для растворения выделившегося углекислого газа в пространство между раствором и крышкой. 3. Обоснуйте требования к стерильным лекарственным формам в соответствии с требованиями GMP. Высокие требования к качеству перечисленных лекарственных форм повлекли за собой высокие требования к организации их производства. Комплекс таких требований был создан в ряде стран и получил название "Good manufacturing practices" (GMP)-" Правила правильного производства". До 2005г в РФ действовал ОСТ (стандарт отрасли) 42-510-98, который назывался "Правила организации производства и контроля качества лекарственных средств" Фактически это прообраз (GMP). Этот документ имеет следующие разделы: терминология, управление качеством, персонал, здания и помещения, оборудование, процесс производства, документация, валидация (документированное подтверждение соответствия оборудования, условий производства, технологического процесса, качества полупродукта и готового продукта действующим регламентам и НД), работа по контракту, рекламации и отзыв с рынка, самоинспекция. GMP содержит общие требования к организации производства лекарственных средств, в том числе стерильных. Стерильные лекарственные средства должны производиться в асептических условиях. Асептика - это определенные условия работы, максимально предохраняющие лекарственные средства от попадания в них микроорганизмов и механических частиц на всех этапах технологического процесса. Создание асептических условий в промышленном производстве и в аптеке имеет общие принципы. При этом исходят из того, что основными источниками загрязнения лекарственных препаратов являются:
Изготовление стерильных лекарственных форм должно производиться в "чистых" помещениях. Это производственные помещения с чистотой воздуха, нормируемой по содержанию механических частиц и микроорганизмов. При производстве стерильных лекарственных средств используются помещения разных классов чистоты. Всего 4 класса чистоты. На каждой стадия технологического процесса класс чистоты строго регламентируется. Например, в помещениях класса чистоты А осуществляют: - розлив растворов в ампулы, флаконы;
В помещениях класса чистоты В:
В помещениях класса чистоты С:
В помещениях класса чистоты D:
Нестерильные лекарственные средства производятся в помещениях классов чистоты С и D. При этом нормируется только содержание микроорганизмов в воздухе, количество механических частиц не нормируется. В помещениях класса чистоты D, где производятся стерильные лекарственные средства, допускается не более 200 микроорганизмов в 1 м3 воздуха, а в помещениях класса чистоты D, где производятся нестерильные лекарственные средства- не более 500. Подготовка производственных помещений к работе заключается в выполнении комплекса мероприятий:
Для достижения требуемой чистоты воздуха в производственных помещениях используют воздушные фильтры и УФ-облучатели. Для очистки воздуха в производственных помещениях используют системы приточной и вытяжной вентиляции. Наиболее эффективная очистка достигается при использовании устройств с ламинарным (слоистым) потоком воздуха. Стадии технологического процесса производства растворов для инъекций в ампулах Процесс изготовления сложен и условно делится на два потока: основной и параллельный основному. Стадии и операции основного потока производства: • первая стадия: изготовление ампул операции: калибровка стеклодрота; мойка и сушка стеклодрота; изготовление ампул; • вторая стадия: подготовка ампул к наполнению операции: резка капилляров ампул; отжиг; мойка; сушка и стерилизация; оценка качества ампул; • третья стадия: стадия ампулирование операции: наполнение ампул раствором; запайка ампул; стерилизация; контроль качества после стерилизации; маркировка, упаковка готовой продукции; регенерация забракованных ампул. Для обеспечения высокого качества готовой продукции создаются специальные условия выполнения стадий и операций технологического процесса. Особое внимание при этом уделяется технологической гигиене. Требования к технологической гигиене и пути их реализации изложены в ОСТ 42-510-98 «Правила организации производства и контроля качества лекарственных средств» (GMP). Аппаратурная схема Получение воды для инъекций: Колонка фильтрующая катионитная, Башенный удалитель углекислоты, Монтежю обессоленной воды, Мерник для обессоленной воды, Колонка фильтрующая анионитная Получение раствора: Весы (отвешивать субстанции), Вибрционное сито, Реактор с мешалкой для приготовления инъекционного раствора, Друк-фильтр, Сборник для чистого инъекционного раствора. Стерилизация: Линия для фасовки жидкостей, Стерилизатор Проверка качества: Ванна для проверки на герметичность, Стол для просмотра флаконов на механические включения, Упаковка и маркировка: Стол маркировки и упаковки После стерилизации следует бракераж растворов по следующим показателям: герметичность, механические включения, стерильность, прозрачность, цветность, количественное содержание действующих веществ. Контроль на герметичность. Горячие ампулы после стерилизации погружают в холодный раствор метиленового синего. При наличии трещин краситель засасывается внутрь, и ампулы отбраковываются. Контроль гораздо чувствительнее, если эту операцию проделать непосредственно в стерилизаторе, в камеру которого после стерилизации заливают раствор метиленового синего и создают избыточное давление пара. Контроль на механические включения. Под механическими включениями подразумевают посторонние нерастворимые частицы, кроме пузырьков газа. Согласно РД 42-501-98 «Инструкция по контролю на механические включения инъекционных лекарственных средств» контроль может проводиться тремя методами:
Визуальный контроль проводится контролером невооруженным глазом на черном и белом фоне. Допускается механизированная подача ампул, флаконов и др. емкостей в зону контроля. На предприятиях осуществляется трехкратный контроль; первичный - внутрицеховой сплошной (100% ампул), вторичный - внутрицеховой выборочный и выборочный-контролером отдела контроля качества. Визуальный метод контроля субъективен и не дает количественной оценки механических включений. Счетно-фотометрический метод осуществляется на приборах, которые работают по принципу светоблокировки и позволяют автоматически определять размер частиц и число частиц соответствующего размера. Например, анализаторы механических примесей фотометрические счетные ФС-151, ФС-151.1 или АОЗ-101. Микроскопический метод заключается в фильтровании анализируемого раствора через мембрану, которую помещают на предметный столик микроскопа и определяют размер частиц и их количество. Этот метод, кроме того, позволяет выявить природу механических включений, что очень важно, т.к. способствует устранению источников загрязнения. Являясь наиболее объективным, этот метод может быть использован как арбитражный. Следующий вид контроля - это контроль на стерильность. Проводится микробиологическим методом. Сначала устанавливают на специальных тест-микроорганизмах наличие или отсутствие антимикробного действия лекарственного и вспомогательных веществ. Цветноть и количественное определение – проводится в соответствии с ФС. 4. Как должно быть оформлено требование на данную пропись? Требование должно иметь штамп, круглую печать ЛПУ, подпись его руководителя или его заместителя по лечебной части. В требовании указывается наименование ЛС, дозировка и форма изготовления (раствор), общее количество (флаконы). Наименование пишут на латинском языке. В требвоании указывается способ применения (для инъекций). Отпускают на 1 день (срок годности 1 сутки). Особые требования к контролю качества: механические включения, стерильность, прозрачность, цветность. Отпуск ЛПУ является оптовым отпуском. Учет изготовленных в аптеке лекарственных средств по стационарной рецептуре осуществляется по накладным, требованиям в натуральных показателях и в стоимостном выражении. В аптеке в тербовании накладной проставляется количество выданного, цена и подсчитывается итоговая сумма. Если лекарственные средства реализуются оптом, то аптечному учреждению необходимо вести журнал учета оптового отпуска и расчетов с покупателями по форме. При отпуске лекарственных средств разовым покупателям и юридическим лицам выписывается счет в четырех экземплярах, два из которых передаются покупателю для оплаты, второй прилагается к месячному отчету, по третьему оформляется отпуск лекарственных средств. Если аптечное учреждение реализует лекарственные средства оптом по безналичному расчету и за наличный расчет, то составляется реестр выписанных покупателям требований-накладных (счетов). Бухгалтерия аптечного учреждения ежемесячно, для сверки расчетов, составляет оборотную ведомость по лицевым счетам покупателей и прочим расчетам.
Rhizomata et radices Rubiae – корневища и корни марены Марена красильная Rubiatinctorum марены грузинской Rubiaiberica сем. Мареновые – Rubiaceae Химический состав. Корневища и корни марены содержат 5-6% производных антрахинонов группы ализарина (ализарин, рубэритриновую кислоту); флавоноиды; иридоиды; органические кислоты. Подлинность Реакция Борнтрегера, проводят гидролиз, агликон извлекают органическим растворителем (диэтиловым эфиром). При встряхивании эфирного слоя с аммиаком они переходят в аммиачный слой и окрашивают его в фиолетовый (1,2-дигидроксиантрахиноны) цвета. Реакция с 1%-ным метанольным раствором магния ацетата: 1,2-дигидроксипроизводные дают фиолетовое окрашивание. Для качественного обнаружения производных антрацена часто используют бумажную и тонкослойную хроматографию. О присутствующих веществах судят по характеру их флуоресценции в УФ-свете до и после обработки хроматограмм соответствующими реагентами (парами аммиака, растворами едких щелочей и др.). Разделение суммы веществ производят, как правило, на колонке с полиамидным сорбентом. Для обнаружения антраценпроизводных в растительном сырье используют их свойство возгоняться при нагревании до 210С. Сублимат конденсируется на стенках сухой пробирки в виде желтого налета. От капли щелочи он окрашивается в красный цвет. В тканях растений антраценпроизводные можно обнаружить путем люминесцентно-микроскопического анализа по флуоресценции. Для количественного анализа антраценпроизводных чаще всего используют фотоэлектроколориметрию, хроматоспектрофотометрию. 6. Основной путь селекции продуцентов аминокислот - это получение ауксотрофных и регуляторных мутантов. Прямой микробиологический синтез аминокислот. Этот метод целиком основан на использовании биообъектов (то есть полностью биотехнологический метод). В качестве биообъектов в нем применяются штаммы-продуценты аминокислот. В настоящее время этим методом аминокислоты чаще всего получают на основе Esherihia Coli (кишечная палочка - симбионт человека), Bacillus subtilis (сенная палочка - почвенный микроорганизм) и Corynebacterium glutamicum (почвенный микроорганизм). Все эти микроорганизмы на сегодняшний день прекрасно изучены. Известна полная нуклеотидная последовательность всего их генома. Для кишечной палочки разработаны многообразные способы генетического обмена, позволяющие легко комбинировать разные гены и изменять процесс метаболизма. В меньшей степени это относится к Bacillus subtilis, и еще в меньшей степени к Corynebacterium glutamiсum. Использование этих микроорганизмов для получения аминокислот основано на их способности самостоятельно синтезировать все двадцать аминокислот. Также они являются гетеротрофными бактериями, которые в качестве источника углерода используют органические соединения (углевод или какую-нибудь органическую кислоту), а все остальные компоненты они получают из неорганических соединений. Применение микроорганизмов гетеротрофов позволяет существенно сократить по времени процесс ферментации. Так, кишечная палочка в богатой питательной среде делится каждые 20-30 минут, коринебактерии - каждый час. В бедных средах - время регенерации в 2 раза больше (для кишечной палочки - 1 час, для коринебактерий и сенной палочки 1,5-2 часа). Вместе с тем, существуют бактерии, так называемые, ауксотрофные мутанты - микроорганизмы, которые, с одной стороны, утратили способность самостоятельно синтезировать необходимые для построения всех компонентов своей клетки различные аминокислоты, а с другой - приобрели способность к сверхсинтезу целевой аминокислоты. Такие мутанты получают либо путем воздействия различных мутагенов физической и химической природы на исходную культуру микроорганизма с последующей селекцией штамма по заранее заданным признакам, либо - методами генной инженерии. СИТУАЦИОННАЯ ЗАДАЧА 391. В производственную аптеку поступил рецепт на изготовление лекарственного препарата от врача, работающего в процедурном кабинете поликлиники: Возьми: Раствора кислоты аскорбиновой 10%...........................10 мл Простерилизуй! Дай такие дозы числом...........................................................................10. Обозначь. .......................................................По 10 мл внутримышечно. 1. Rp: Solutionis Acidi ascorbinici 10% - 10 ml Sterilisetur! Da tales doses numero 10 Signa: По 10 мл внутримышечно При изготовлении руководствуются составом приведенном в приказе №214. Расчеты и паспорт письменного контроля
|
