_Спирты. Спирты
 Скачать 1.03 Mb. Скачать 1.03 Mb.
|
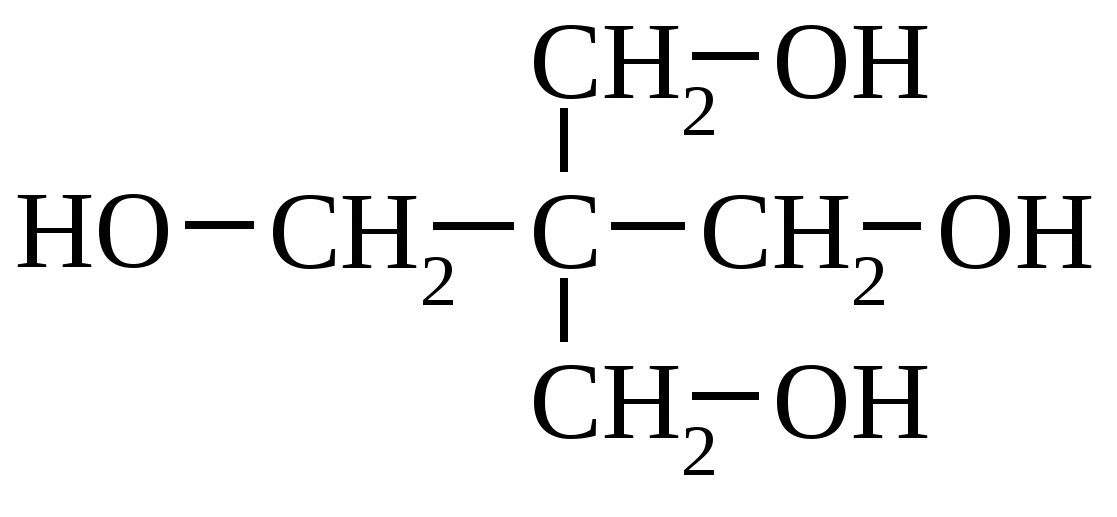
Спиртами называются соединения, которые содержат одну или несколько гидроксильных групп у атомов углерода, находящихся в sp3-гибридизации. Гидроксильная группа (ОН) является функциональной группой и определяет свойства, характерные для данного класса соединений. Количество гидроксильных групп определяет атомность спиртов. Строение радикала влияет на скорость, с которой спирт вступает в некоторые реакции, а иногда и на характер реакции. 13.1. Классификация, номенклатура и Строение спиртов 13.1.1. Классификация спиртов
13.1.2. Номенклатура спиртов

В настоящее время эта номенклатура не рекомендуется для употребления.
В этой номенклатуре положение заместителя в алкильной группе спирта можно обозначить не только цифрой, но и буквой греческого алфавита. Греческая буква ω указывает на наличие заместителя на самом удаленном по отношению к функциональной группе атоме углерода.
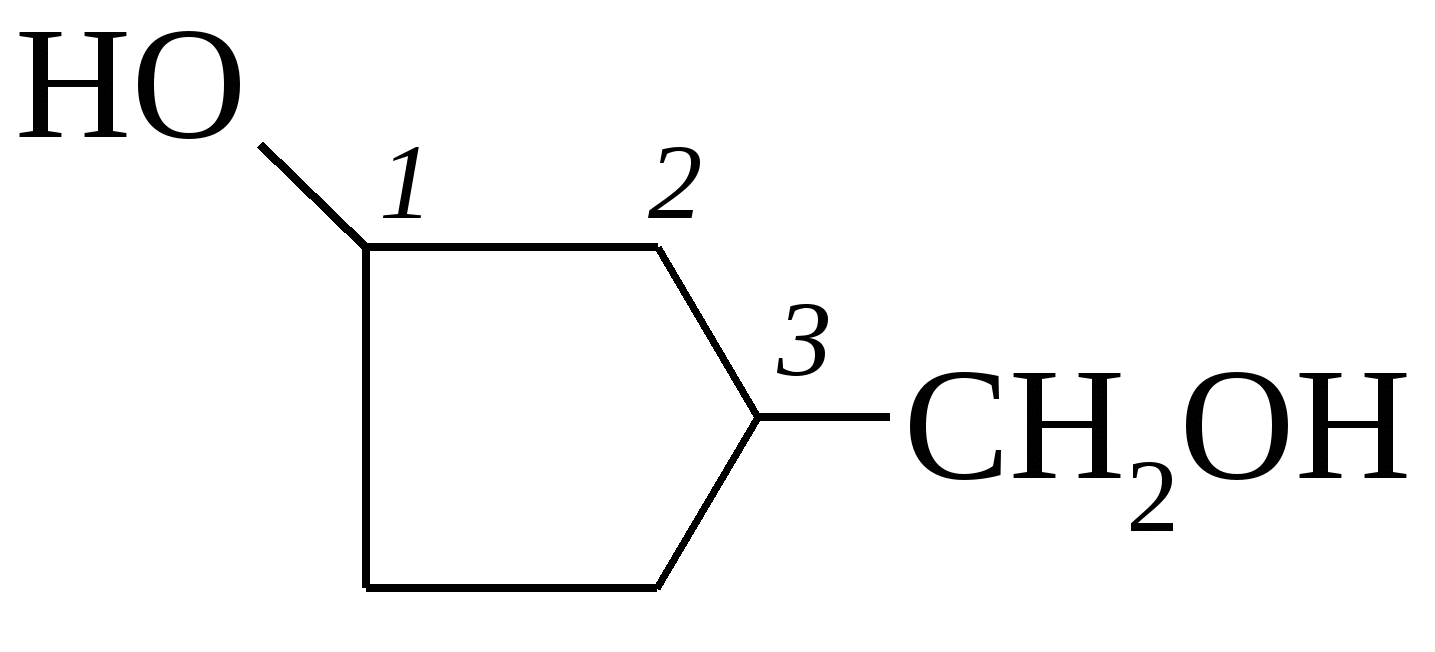
13.1.3. Строение спиртов В насыщенных спиртах связи Н-О и О-С расположены по отношению друг к другу под углом 106. Связь Н-О поляризована из-за большей, чем у атома водорода, электроотрицательности атома кислорода. Алкильные радикалы, обладающие +I-эффектом, подают электронную плотность на атом кислорода, частично компенсируя его электроноакцепторные свойства. Поэтому в спиртах связь Н-О поляризована меньше, чем в воде, в которой атом водорода не обладает индукционным эффектом. Следовательно, спирты обладают более слабыми кислыми свойствами по сравнению с водой (соответственно рКа 17 и 15,7), но значительно более сильными, чем ранее изученный ацетилен (рКа 25). 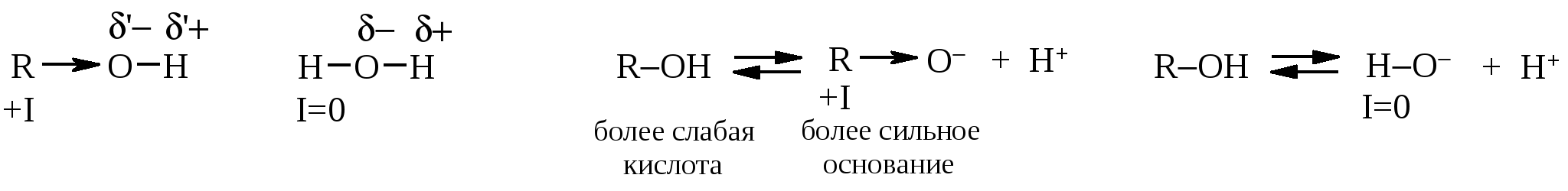 Иначе кислотные свойства спиртов и воды можно оценить, сравнив основность сопряженных оснований. В алкоголятах +I-эффект радикала увеличивает отрицательный заряд на атоме кислорода, тогда как атом водорода в гидроксид-анионе никак не влияет на него. Алкоголят-анионы являются более сильными основаниями по сравнению с гидроксид-анионом, а значит спирты, как сопряженные кислоты, соответственно слабее по кислотным свойствам, чем вода. 13.1.4. Изомерия Очевидно, что для метана и этана, в которых все атомы водорода равноценны, путем замещения одного водорода на гидроксил можно получить по единственному спирту: это метиловый СН3ОН и этиловый СН3СН2ОН спирты. У пропана имеются уже две возможности – замещение на гидроксил одного из водородов метильных групп и одного из водородов метиленовой группы. И, действительно, существуют два пропиловых спирта: первичный, в котором гидроксил связан с первичным атомом углерода (пропиловый спирт или пропанол-1), и вторичный – с гидроксилом у вторичного атома углерода (изопропиловый спирт или пропанол-2).
Таким образом, изомерия спиртов, как и вообще изомерия замещенных углеводородов, носит двоякий характер – изомерия углеводородного скелета, уже знакомая нам по алканам, и изомерия положения гидроксильной функции в данном скелете. Действительно для четвертого члена гомологического ряда алканов – бутана – спирты происходят от двух разных углеводородных цепей: от н-бутана и изобутана.
Для спиртов возможны и все основные виды стереоизомерии.
13.2. Физические свойства спиртов Из сравнения температур кипения спиртов сходной структуры видно, что при переходе от одного члена гомологического ряда к другому повышение температуры кипения составляет примерно 20 С. Разветвление цепи, так же как и в углеводородах, повышает температуру плавления (особенно сильно для третичных спиртов, в которых «разветвленный» атом углерода примыкает к функциональной группе) и понижает температуру кипения. По сравнению с углеводородами спирты кипят при значительно более высокой температуре. Для объяснения аномалий в температурах кипения было использовано понятие водородной связи. Можно считать, что в спиртах атом водорода гидроксильной группы служит мостиком между двумя электроотрицательными атомами кислорода, причем с одним из них он связан ковалентной связью, а с другим – электростатическими силами притяжения. Энергия водородной связи в спиртах около 20 кДж/моль (для большинства ковалентных связей она равна 210-420 кДж/моль).  Молекулы, которые удерживаются вместе водородными связями, называются ассоциированными; их аномально высокие температуры кипения обусловлены дополнительной энергией, необходимой для разрушения водородных связей. Подробнее о водородной связи см. Главу 3 «Основы теории электронного строения органических молекул». Существенное отличие спиртов от углеводородов состоит в том, что низшие спирты смешиваются с водой в любом соотношении. Вследствие наличия ОН-группы, молекулы спирта удерживаются вместе такими же межмолекулярными силами взаимодействия, какие существуют в воде. В результате возможно смешивание двух типов молекул, причем энергия, требуемая для отрыва молекул воды или спирта друг от друга, берется за счет образования аналогичных связей между молекулами воды и спирта. Однако это справедливо только для низших спиртов, в которых ОН-группа составляет значительную часть молекулы. Длинная алифатическая цепь с небольшой ОН-группой в значительной степени сходна с алканами, и физические свойства таких соединений отражают это. Уменьшение растворимости в воде с увеличением числа атомов углерода происходит постепенно: первые три первичных спирта неограниченно смешиваются с водой; растворимость н-бутилового спирта составляет 8 г на 100 г воды, н-пентилового – 2 г, н-гексилового – 1 г, а высших спиртов еще меньше. Согласно величине дипольных моментов (μ=1,6-1,8D) спирты – полярные вещества, которые имеют слабые электронодонорные или нуклеофильные свойства, обусловленные наличием неподеленной пары электронов атома кислорода. 13.2.1. Спектроскопия спиртов
13.3. Получение одноатомных спиртов в промышленности Требования к промышленным синтезам иные, чем к лабораторным методам. В частности, крупнотоннажные производства экономичнее осуществлять непрерывным способом с многократной рециркуляцией больших масс реагирующих веществ. Поэтому для таких производств предпочтительнее газофазные процессы. Для промышленного получения спиртов наиболее широко используют два основных метода: гидратация алкенов, полученных при крекинге нефти, и ферментативный гидролиз углеводов. Кроме этих двух методов существуют и некоторые другие, имеющие более ограниченное применение.
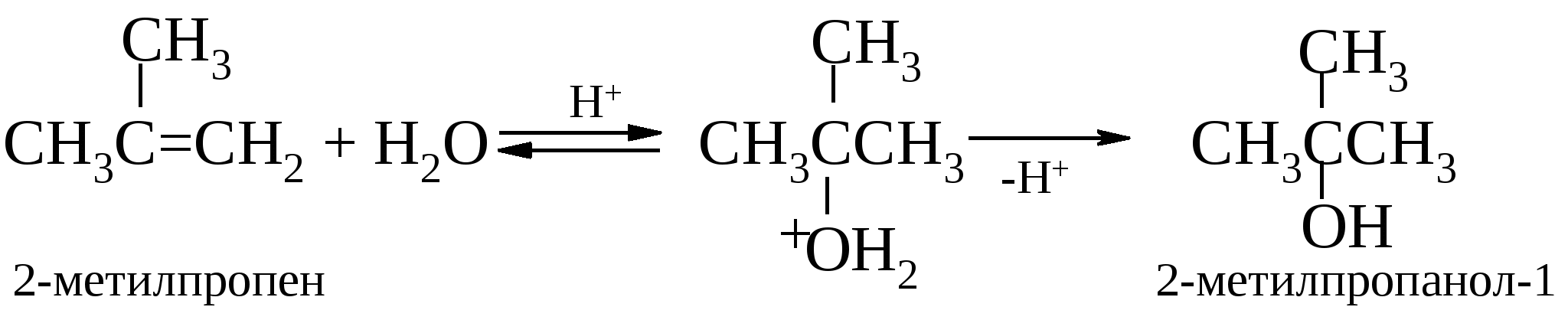 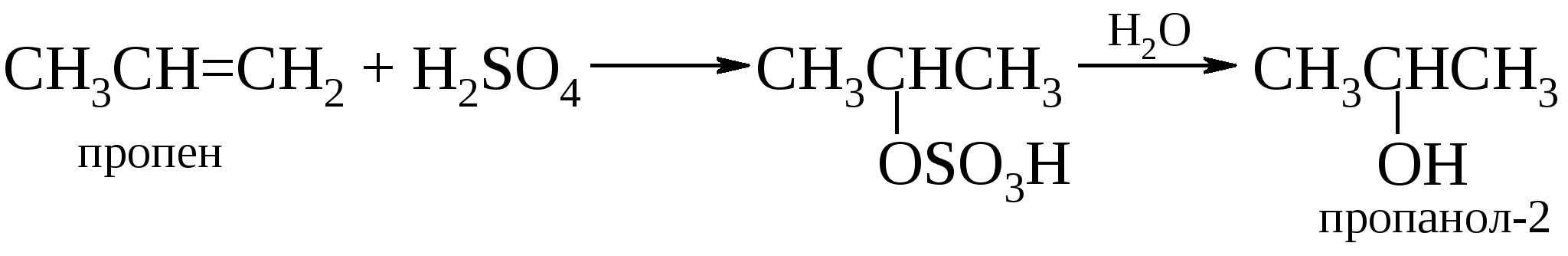 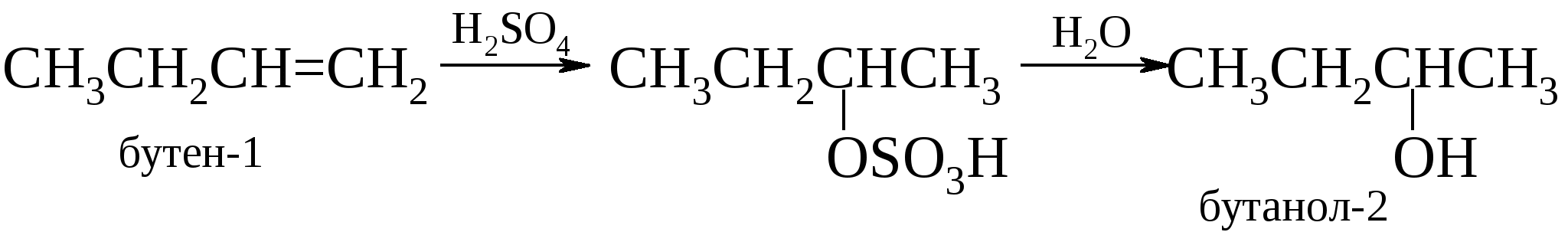 Таким путем могут быть синтезированы лишь те спирты, которые образуются по правилу Марковникова: например, изопропиловый, но не пропиловый; втор-бутиловый, но не н-бутиловый, трет-бутиловый, но не изобутиловый. Этими методами можно получить лишь один первичный спирт – этиловый. Кроме того, данный метод лишен стереоспецифичности, а в процессе гидратации возможны перегруппировки. Эти проблемы можно обойти двухстадийным синтезом спиртов через оксиран, приводящим в итоге к анти-гидратации (см. далее). В промышленности кислотнокатализируемая гидратация алкенов лежит в основе производства этанола из этилена и пропанола-2 из пропена: 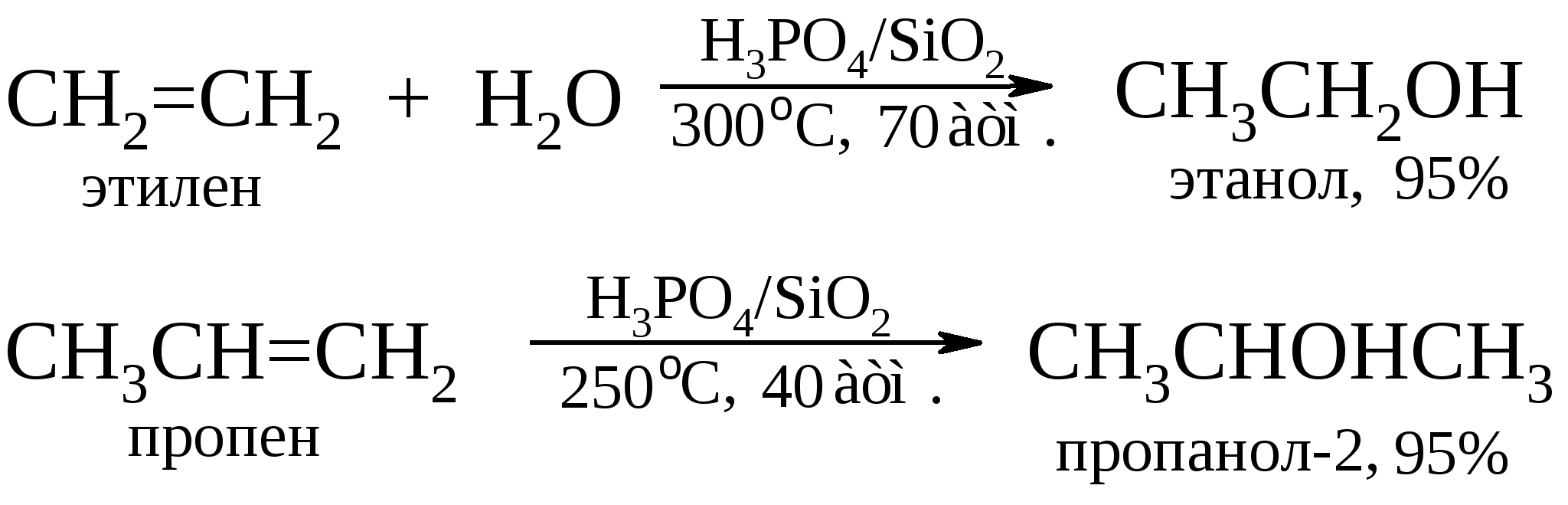 Для получения других спиртов этот метод имеет весьма ограниченную область приложения, поскольку гидратация алкенов часто сопровождается изомеризацией углеродного скелета за счет перегруппировок карбкатионов. Это обстоятельство сильно сужает синтетические возможности на первый взгляд простого способа получения вторичных и третичных спиртов. В лаборатории он вытеснен другим методом, основанном на реакции гидроксимеркурирования-демеркурирования алкенов. Подробно о нем несколько позже.
C6H12O6 → 2C2H5OH + 2CO2 Основная его масса идет на приготовление алкогольных напитков. Отсюда и название “винный или пищевой спирт”. При использовании крахмала в качестве исходного материала кроме этилового спирта образуются сивушные масла, представляющие собой смесь пентиловых спиртов, а также пропилового и изобутилового спиртов, обладающих токсичным действием. Для промышленных целей применяют этанол, полученный гидролизом и брожением древесины, отходов целлюлозно-бумажной промышленности (гидролизный спирт).
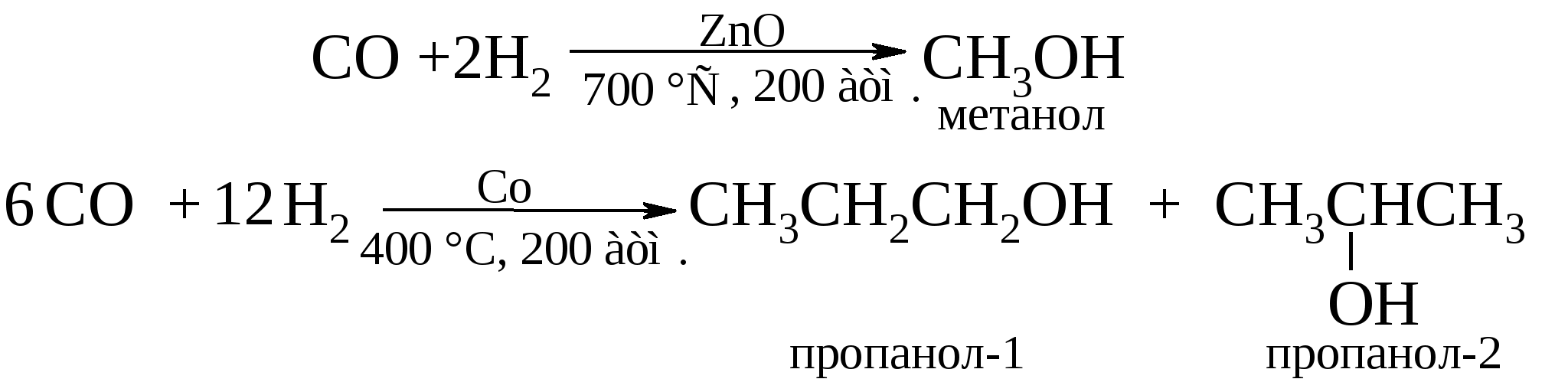
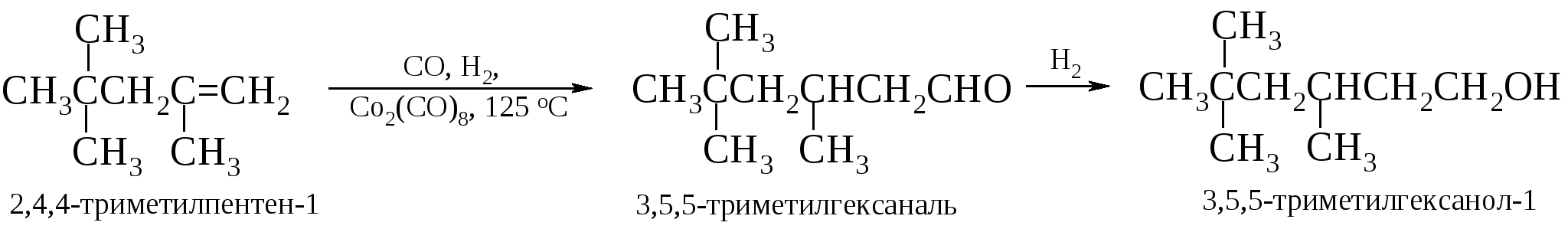 Оксосинтез, открытый в США (Т. Ройлен, 1938 г.) и первоначально получивший свое развитие в Германии, приобретает в настоящее время все большое значение в химической промышленности. Например, для получения н-бутилового спирта из пропилена и н-пропилового спирта из этилена. 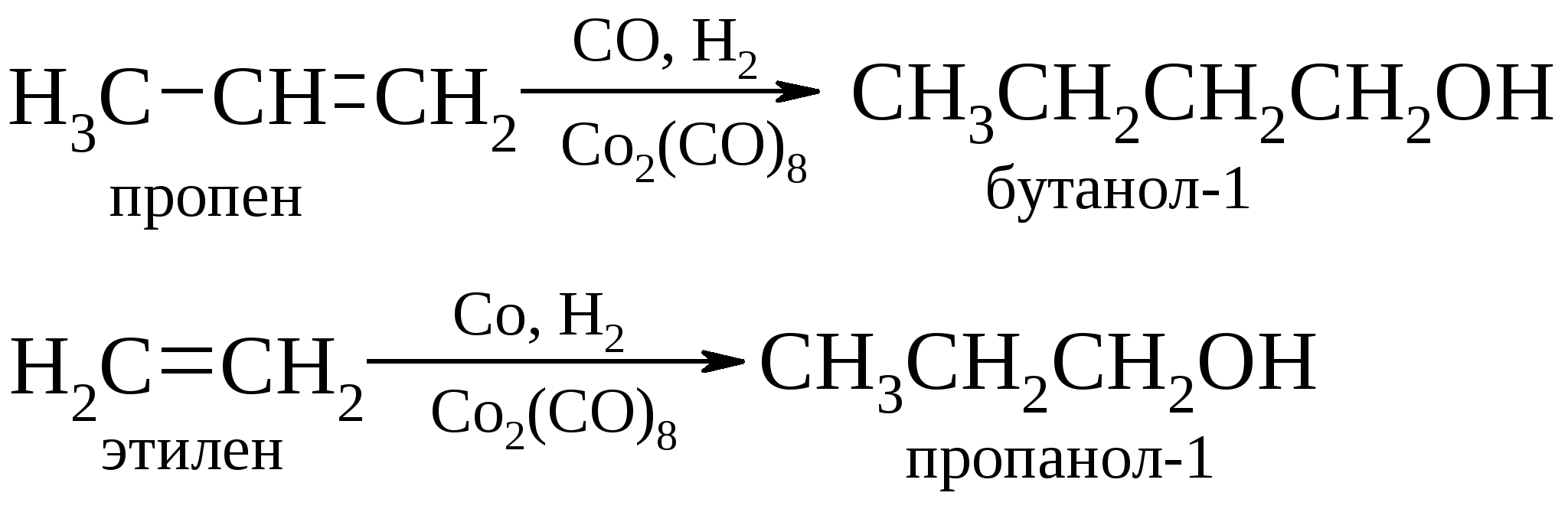
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||