_Спирты. Спирты
 Скачать 1.03 Mb. Скачать 1.03 Mb.
|
а) реакции окисления с сохранением углеродной цепи;б) реакции окисления цис-гликолей с расщеплением углеродной цепи.
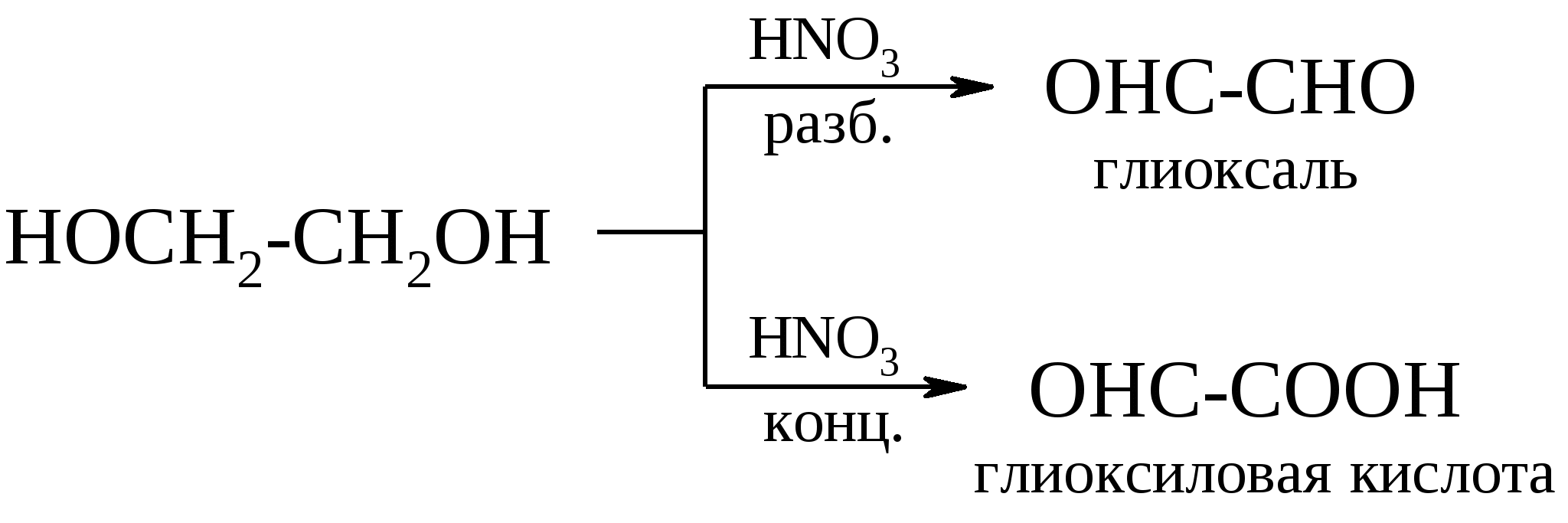
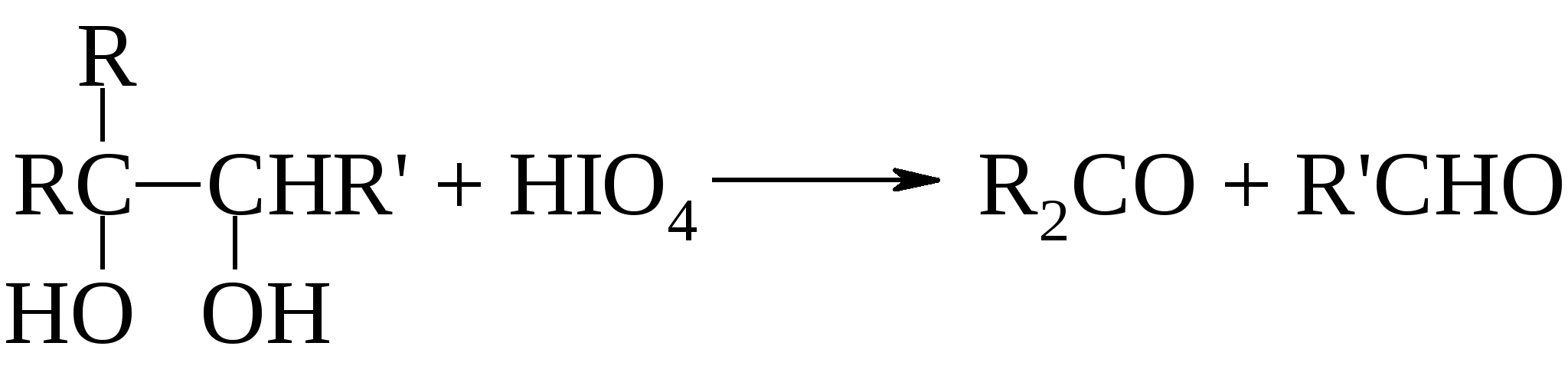 Эта реакция особенно важна при определении структуры сахаров. Качественно окисление иодной кислотой можно обнаружить по образованию белого осадка при добавлении нитрата серебра к образовавшейся в ходе реакции иодноватой кислоте (HIO3). Поскольку реакция обычно протекает количественно, то можно получить очень ценную информацию на основании данных о природе и количестве образовавшихся продуктов реакции и количестве израсходованной иодной кислоты. Метод окисления 1,2-гликолей иодной кислотой, разработанный Л. Малапраде в 1928 г., удачно дополняется окислением гликолей тетраацетатом свинца, предложенным в 1931 г. Р. Криге: если первая реакция протекает только в водных средах, то вторую можно проводить в бензоле или уксусной кислоте. Обе реакции протекают через циклические эфиры, образованные гликолем с окислителем. Этим объясняется тот факт, что цис-гликоли разрушаются быстрее, чем транс-изомеры. Предполагается следующий механизм окисления гликолей. Кинетические измерения показывают, что образование цикла является наиболее медленной стадией реакции. 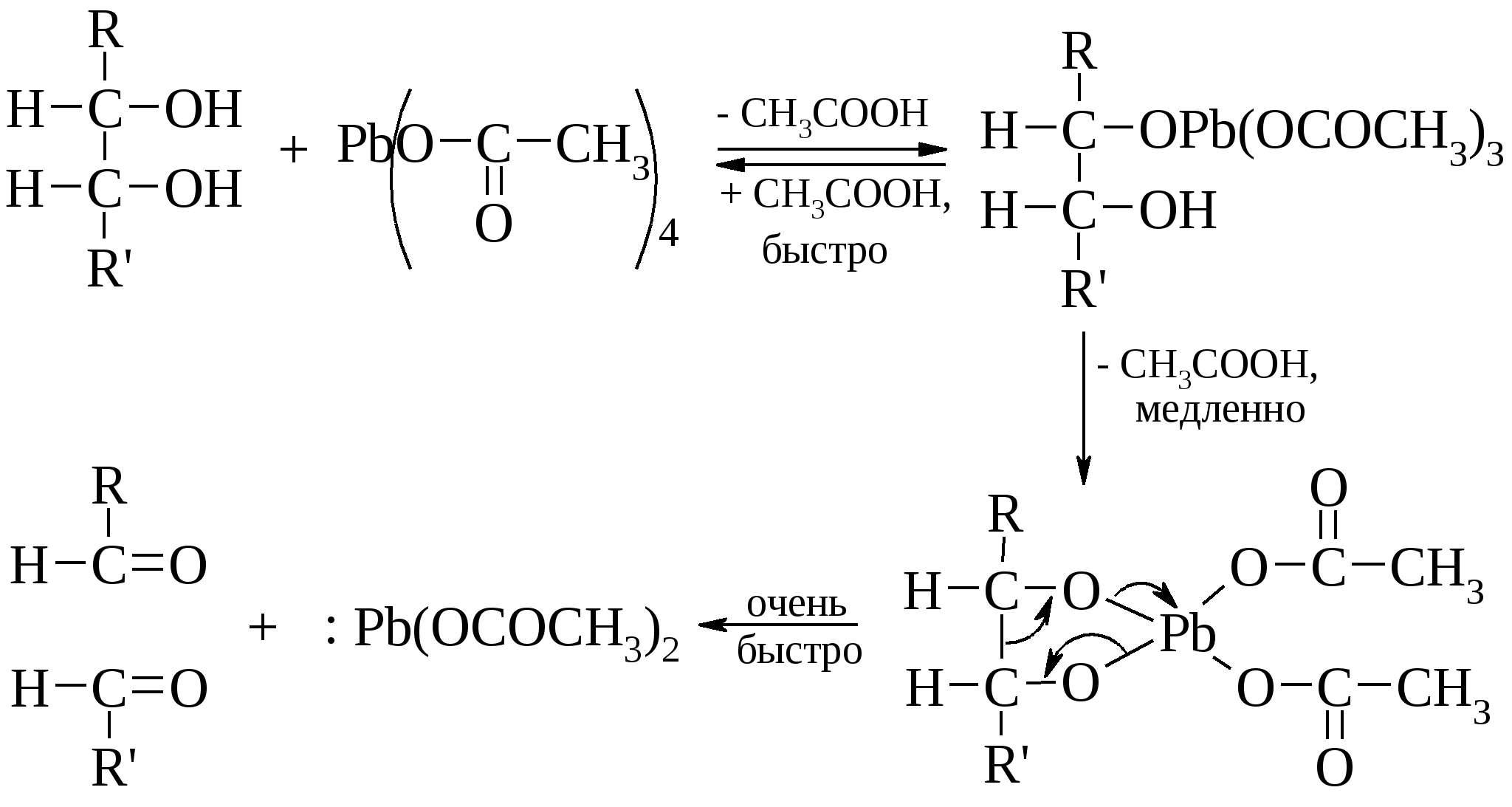
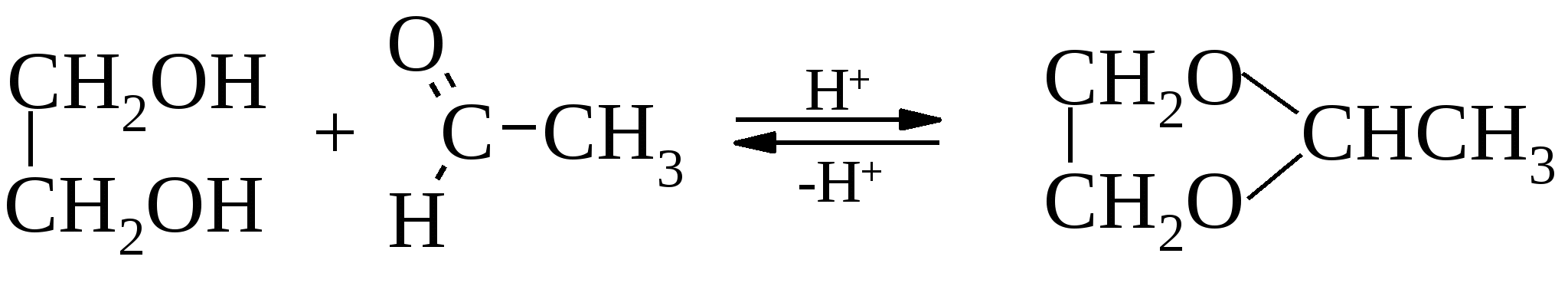 При обработке их кислотами регенерируются исходные вещества. В щелочных условиях ацетали весьма устойчивы. 1,3-Гликоли способны реагировать подобным образом, давая шестичленные циклические ацетали. Для осуществления реакций ацеталирования необходимым условием является нахождение гидроксильных групп в цисоидной конфигурации. 13.8.4. Применение гликолей Из представителей гликолей наибольшего внимания заслуживает сам этиленгликоль, а также ряд соединений, синтезированных на его основе.
Азотнокислый эфир этиленгликоля – динитроэтиленгликоль – сильное взрывчатое вещество, заменяющее нитроглицерин. Полиэфиры этиленгликоля широко применяются в различных отраслях промышленности: как пленкообразующие вещества для лаков и красок, в производстве пластмасс и особенно синтетических волокон, например, лавсана.
С аммиаком и аминами хлоргидрин образует аминоспирт этаноламин(коламин), входящий в состав гликолипидов. HOCH2CH2Cl + 2NH3 → HOCH2CH2NH2 + NH4Cl коламин При действии сильных щелочей этиленхлоргидрин превращается в этиленоксид.
13.9. многоатомные спирты Из многоатомных спиртов простейшим и наиболее важным представителем является глицерин (пропантриол-1,2,3). Он был открыт в 1779 г. знаменитым шведским химиком К. Шееле. 13.9.1. Получение глицерина
При щелочном гидролизе жиров получают натриевые соли высших жирных кислот – мыла. Отсюда процесс гидролиза сложных эфиров при действии щелочей называется омылением. В настоящее время этот процесс лежит в основе получения глицерина для косметических и фармацевтических целей.
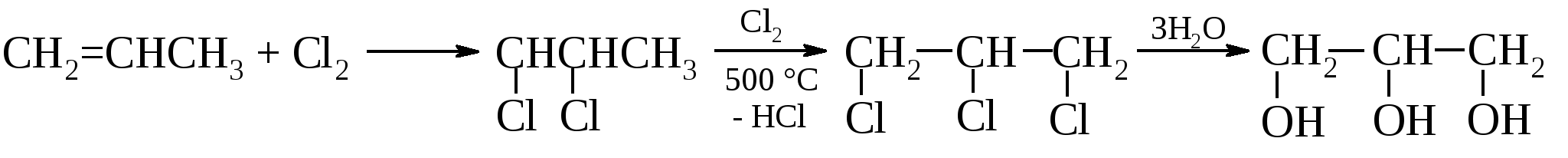 . .
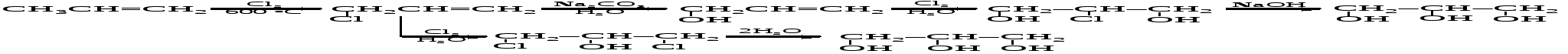 Недостатком этого метода является большой объем сточных вод, содержащих минеральные соли и органические вещества, которые требуют трудоемкой утилизации, и непроизводительный расход хлора.
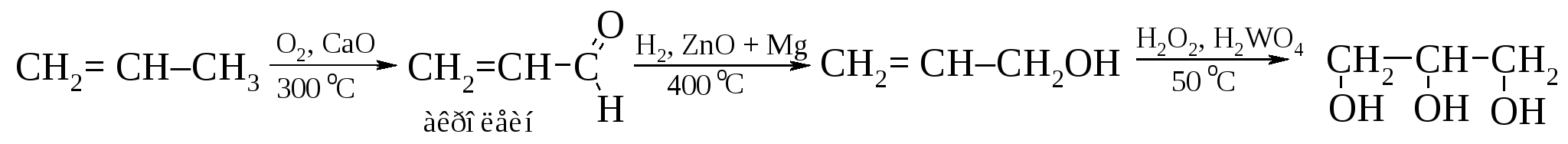
Некоторое количество глицерина образуется при отдельных видах брожения сахаров. Очень перспективный технический синтез глицерина разработали в Польше Я. Береш и Л. Якубович. Восстановлением простейшего непредельного альдегида акролеина, полученного в условиях кротоновой конденсации по Оппенауэру, синтезируют аллиловый спирт, который превращают в глицерин: Разработанные и внедренные в производство способы получения глицерина позволили сократить расход пищевых жиров на технические цели. 13.9.2. Химические свойства глицерина
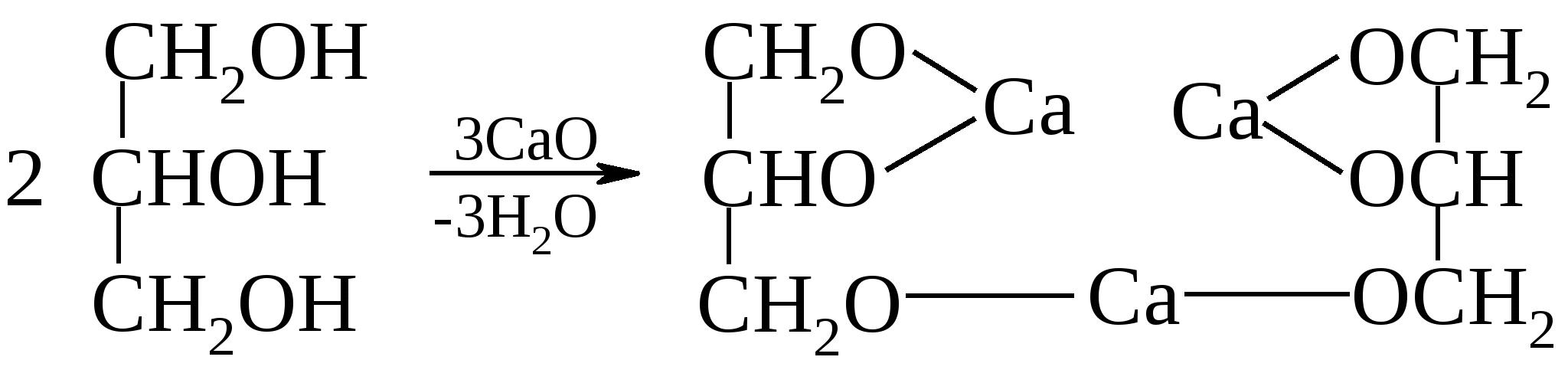
При взаимодействии глицерина с неорганическими кислородсодержащими кислотами образуются полные и неполные сложные эфиры, например: Полный азотнокислый эфир глицерина – глицеринтринитрат (обычно неправильно называемый нитроглицерином) – взрывчатое вещество, применяемое для изготовления динамита; 1%-ный раствор под названием нитроглицерин – лекарственное средство.
При обработке глицерина в более жестких условиях образуются два дихлорглицерина: CH2Cl-CHCl-CH2OH и CH2Cl-CHOH-CH2Cl. При обработке щелочью они дают эпихлоргидрин глицерина: Аналогичные результаты получают при взаимодействии глицерина с бромистоводородной кислотой.
а при взаимодействии с иодом и фосфором первоначально образующийся 1,2,3-трииодпропан распадается до аллилиодида:
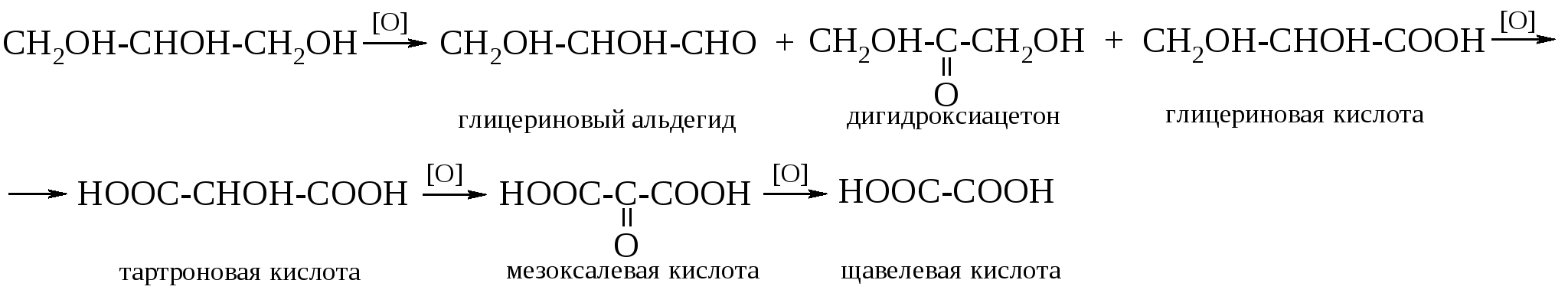 13.9.3. Применение глицерина Глицерин в больших количествах потребляется в пищевой и ликероводочной промышленности, в производстве косметики и лекарственных препаратов. Синтетический глицерин применяют в текстильной промышленности и полиграфии. В качестве исходного вещества его используют в производстве взрывчатых веществ, антифриза, глифталевых смол и лаков. 13.9.4. Многоатомные спирты
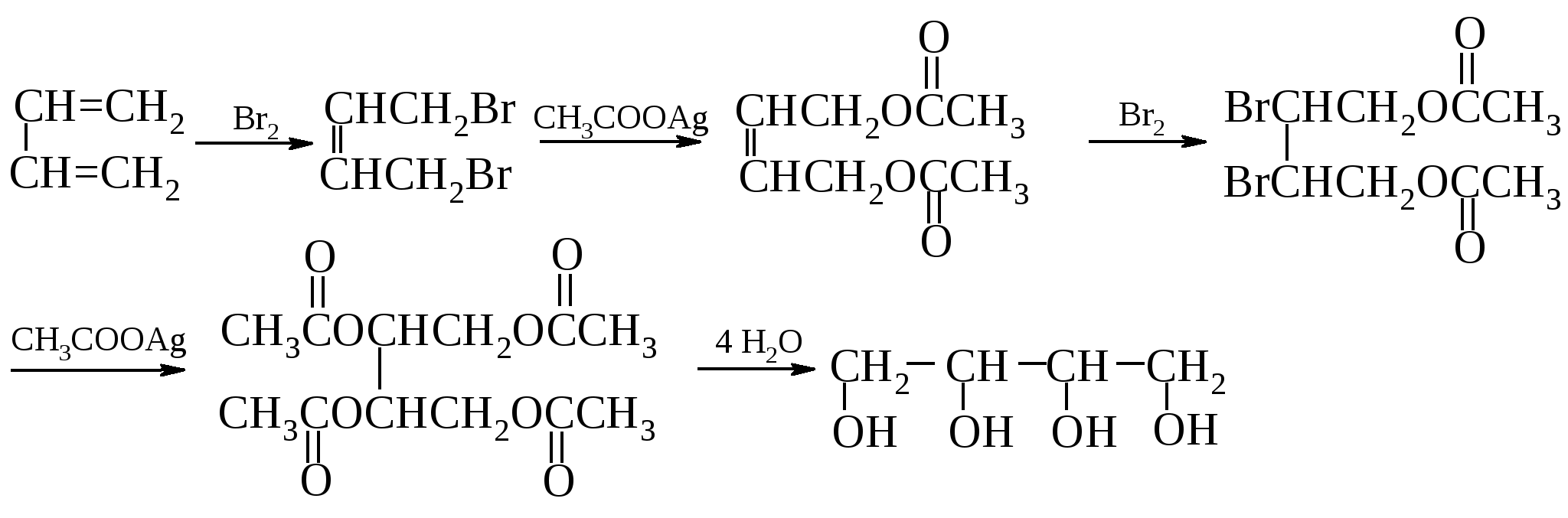
13.9.5. Жиры и масла Все жиры и жирные масла представляют собой глицериды, т.е. сложные эфиры трехатомного спирта глицерина и высших жирных кислот, как правило, с четным числом атомов углерода от 12 и до 22. Наиболее распространены в жирах кислоты с 16 и 18 атомами углерода, встречаются карбоновые кислоты с числом углеродных атомов от 4 до 10. 
В состав жиров и масел входят как предельные кислоты, например, пальмитиновая – С15Н31СООН и стеариновая – С17Н35СООН, так и непредельные карбоновые кислоты: олеиновая – С8Н17СН=СН(СН2)7СОOН, линолевая – С5Н11(СН=СНСН2)2(СН2)7СОOН, линоленовая – С2Н5(СН=СНСН2)3(СН2)6СОOН. В зависимости от того, какие кислоты входят в состав жиров, жиры подразделяются на твердые (говяжий, бараний и свиной) и жидкие, называемые маслами (подсолнечное, льняное, хлопковое, оливковое и кокосовое). Как правило, твердые жиры – это вещества животного происхождения, а масла выделяются из растений. Твердые жиры содержат обычно предельные кислоты, а растительные масла – непредельные. Следует заметить, что консистенция жиров не всегда соответствует характеру входящих в их состав карбоновых кислот. Так, например, твердое кокосовое масло содержит преимущественно предельные кислоты. Жиры и масла используются человеком в основном как пищевые продукты. Они являются необходимой и весьма ценной составной частью пищи. С жирами организм получает значительно большее количество энергии, чем с таким же количеством белков и углеводов. Жиры в организме вследствие их энергетической ценности служат резервным питательным веществом. В кишечнике под влиянием фермента липазы они распадаются на глицерин и органические кислоты. Продукты гидролиза всасываются стенками кишечника, из которых в организме синтезируются новые жиры. Дополнительно глицерин поставляется за счет расщепления углеводов. Следует отметить, что отдельные непредельные кислоты синтезируются только растениями, и поэтому являются незаменимыми компонентами пищи. Они необходимы для человека и животных как исходный материал в синтезе простагландинов, недостаток которых вызывает замедление роста, поражение кожи, нарушение функции почек и органов размножения. Дополнительным источником пищевых твердых жиров могут служить растительные масла, которые гидрогенизацией переводят в твердую консистенцию. Синтетические твердые жиры используются в производстве пищевого продукта маргарина. Для улучшения вкусовых и питательных свойств к нему добавляют яйца, молоко, соли, а для отдушки – диацетил CH3COCOCH3 и ацетоин CH3COCH(OH)CH3. Значительные количества растительных масел используются для приготовления красок и лаков. Поскольку масла содержат глицериды кислот с двумя и более двойными связями, то при окислении они образуют прозрачные пленки за счет разрушения кратных связей. Такие масла получили название высыхающих. Однако высыхание красок – это не только испарение растворителя (скипидара), но и химический процесс: олифу готовят, проваривая, например, льняное масло с небольшим количеством оксидов марганца или свинца. При этом происходят двоякого рода процессы. Изолированные двойные связи линолевой и линоленовой кислот вступают в сопряжение, а образовавшиеся продукты подвергаются окислению по схеме диенов. Далее пероксид распадается с образованием свободных радикалов которые вызывают полимеризацию по сопряженным и изолированным двойным связям. Так, тунговое масло, дающее знаменитый китайский лак, содержит глицерид элеостеариновой кислоты, включающий три сопряженные двойные связи; оно полимеризуется под влиянием воздуха быстрее, чем льняное масло. 1 Вейцман Х. (1874-1952) – израильский биохимик. Основные работы посвящены биохимии углеводов. Первый президент Израиля. 1 Буво Л. (1864-1909) – французский химик-органик. Основная деятельность – органический синтез. 2 Блан Г. (1872-1927) – французский химик-органик. Исследования в области химии терпенов и органического синтеза. 1 Эльтеков А. (1846 – 1894) – русский химик. Основные работы посвящены превращениям углеводородов и их кислородных производных. 2 Эрленмейер В. (1825 – 1909) – немецкий химик. Основные исследования посвящены структурной органической химии. 1 Кляйзен Л. (1851 – 1930) – немецкий химик; основные работы посвящены органическому синтезу, ацилированию карбонильных соединений, таутомерии. 1 Бутенант А. (1903 - 1996) – немецкий химик. Основные работы посвящены химии половых гормонов. Нобелевский лауреат 1939 г. |
