_Спирты. Спирты
 Скачать 1.03 Mb. Скачать 1.03 Mb.
|
|
13.6. отдельные представители одноатомных спиртов
Это основной путь получения метанола. Метанол широко используют в технике для метилирования анилина, производства диметилсульфоксида и формалина. Используется как растворитель лаков. Следует отметить, что уже небольшие количества метанола при попадании вовнутрь вызывают тяжелые отравления организма. Летальная доза для человека составляет 25 мл. метанола.
13.7. Непредельные спирты и их эфиры 13.7.1. Енолы Известно, что олефины не могут нести гидроксил при атоме углерода в sp2-гибридном состоянии, поэтому структуры (1) неустойчивы и изомеризуются в (2), согласно правилу Эльтекова1-Эрленмейера2. 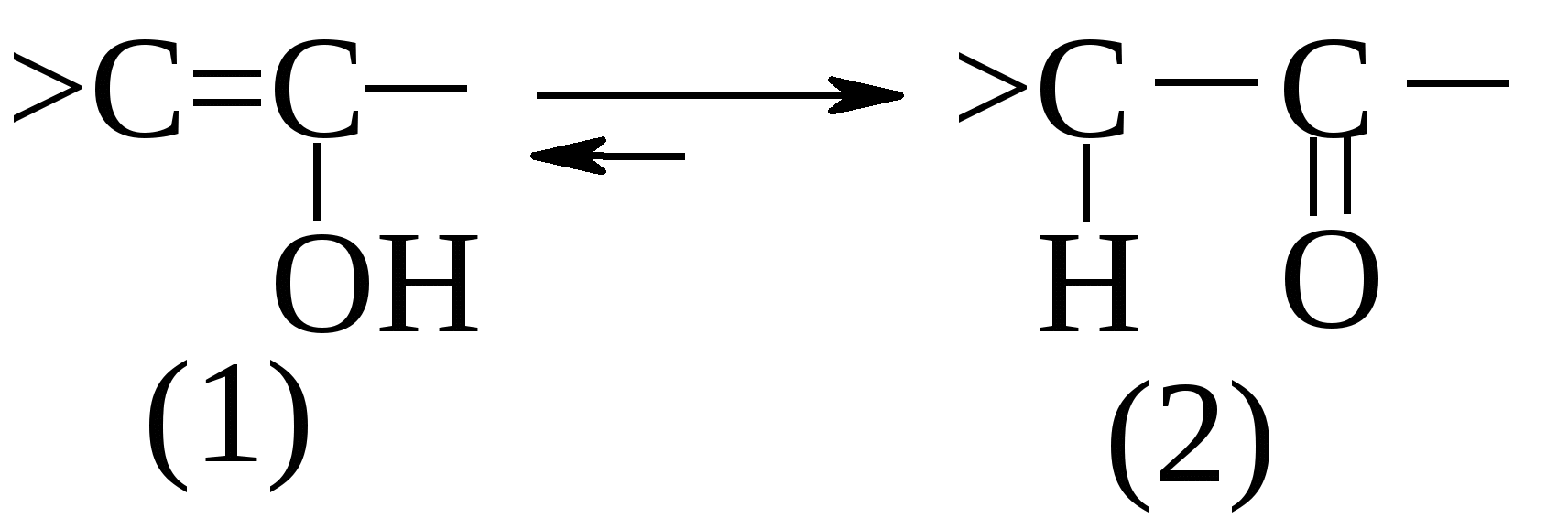 Для структур, несущих гидроксил при непредельном углеродном атоме, который не связан с электронакцепторными группами (>C=O, –NO2 и др.), правило Эльтекова–Эрленмейера имеет полную силу. Поэтому виниловый спирт и его гомологи не существуют, а при попытках их получить перегруппировываются в ацетальдегид или, соответственно, его гомологи. В настоящее время известны многие соединения, правда, обычно более сложные или содержащие несколько атомов кислорода, которые устойчивы и могут быть выделены не только в карбонильной форме, но и в виде непредельного спирта – енола, например: Изомерия между карбонильным соединением и образующимся из него при перемещении одного атома водорода непредельным спиртом-енолом относится к явлениям таутомерии, или десмотропии. Жидкие смеси таутомерных форм, в которых оба изомера находятся в равновесии, называются аллелотропными смесями. Подробнее о таутомериии см. главу 5 «Изомерия». Причина перегруппировки – проявление, как и в случае винилхлорида, мезомерного эффекта, но в этом случае доходящего до конца. 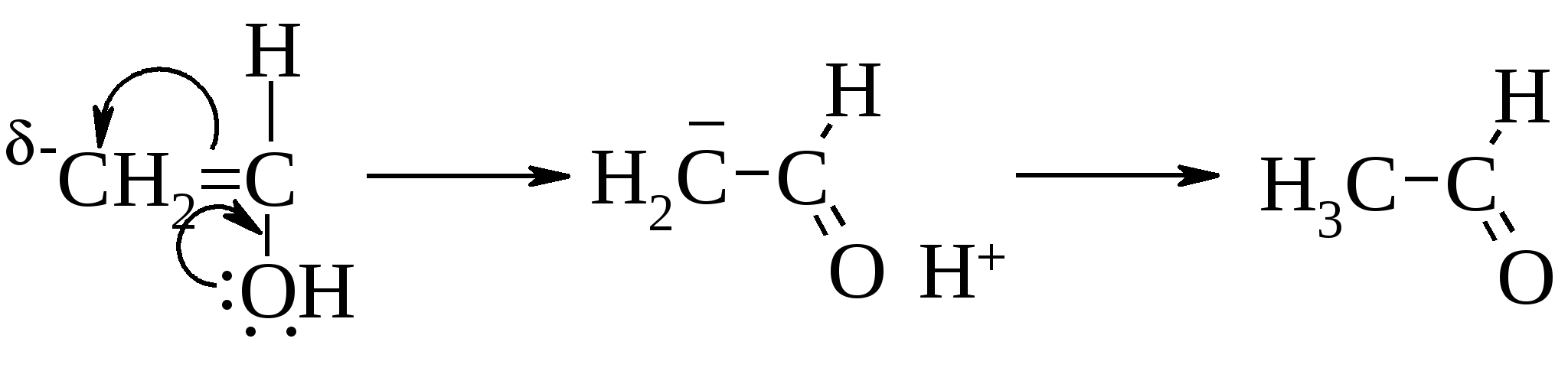 Вследствие мезомерного эффекта протонизируется атом водорода гидроксильной группы и создается у второго ненасыщенного атома углерода с его δ– зарядом удобное место для атаки протона. 13.7.2. Получение производных енолов В отличие от енолов простые и сложные эфиры винилового спирта не только существуют, но и в последних двух случаях широко используются в промышленном масштабе в качестве мономеров. Разумеется, их приходится получать непрямым путем.
Сюда следует добавить действие уксусного ангидрида на кетоны в присутствии каталитических количеств серной кислоты: 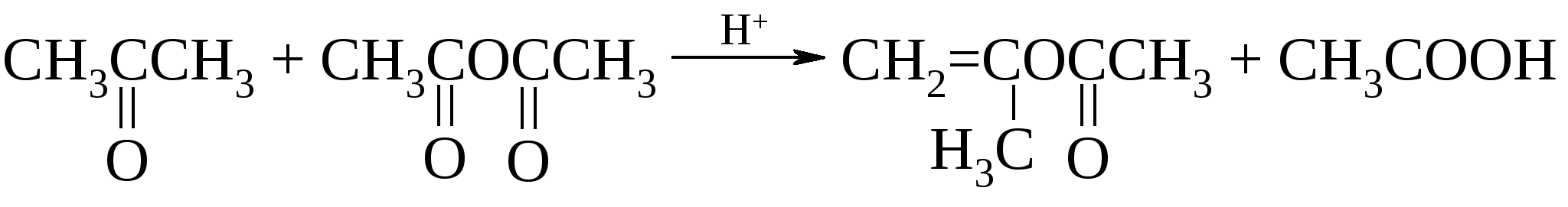 , ,а также действие кетена на ацетальдегид:
Простые виниловые эфиры могут быть получены также взаимодействием винилацетата с соответствующими спиртами. Их особенностью является гидролиз, легко проходящий в кислой среде.
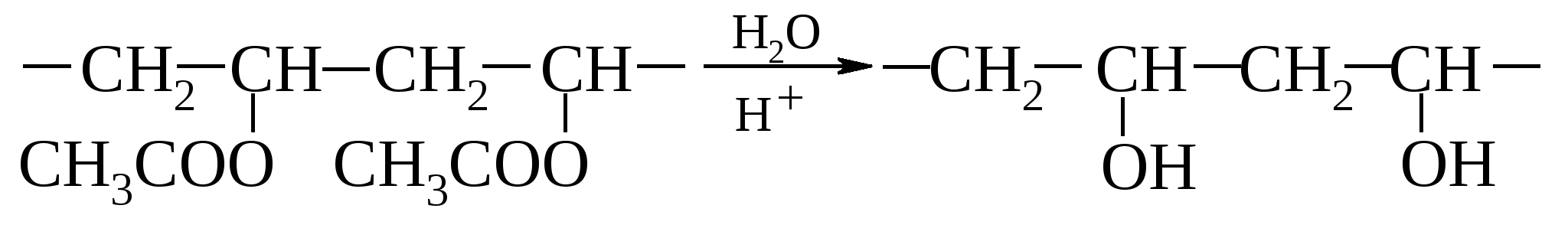 Поливиниловый спирт применяют в производстве синтетической крови, плазмозаменителей и эмульгаторов важных полимерных материалов, таких как волокно винол. Находят практическое применение поливиниловые спирты после их ацеталирования, например, масляным альдегидом (поливинилбутираль R-C3H7): 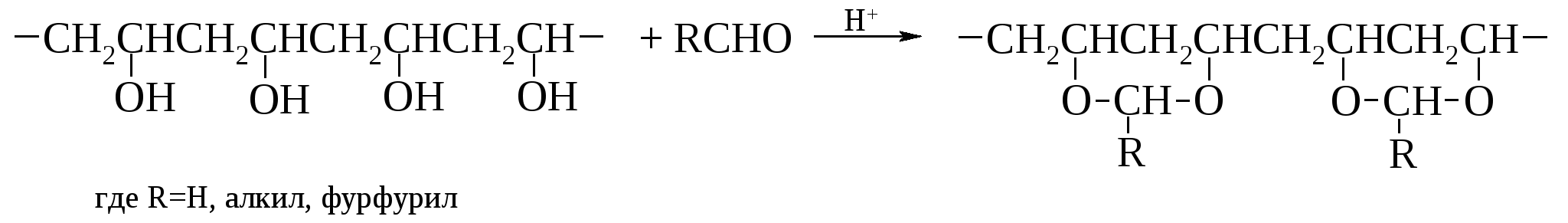 Основное назначение – соединительная основа многослойных пленок, производство клеев, лаков, эмалей. Простые виниловые эфиры также легко полимеризуются, но преимущественно при инициировании реакции кислотами Льюиса, например, хлоридом железа(III). 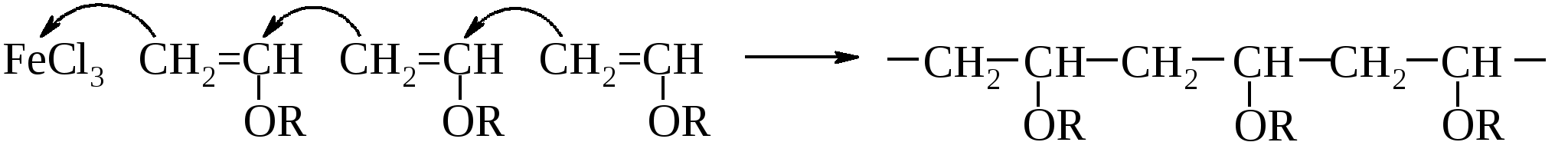 Получаются жидкие вязкие полимеры, применяемые как загустители. Полимеризацией винилбутилового эфира получают бальзам Шостаковского. Простые виниловые эфиры образуют и твердые сополимеры, но в результате инициируемой перекисями гомолитической полимеризации. Синтез из ацетилена простых виниловых эфиров и их гидролиз в ацетальдегид (реакции, не требующие ртутного катализатора, применяемого при прямой гидратации ацетилена в ацетальдегид по Кучерову) предложены как способ получения ацетальдегида из ацетилена его непрямой гидратацией (А. Фаворский, М. Шостаковский). При нагревании алкилвиниловые эфиры претерпевают перегруппировку Кляйзена1, превращаясь в альдегиды вследствие сильного М-эффекта р,π-сопряженной группы. 13.7.3. Аллиловый спирт
Еще раньше аллиловый спирт получали нагреванием глицерина со щавелевой кислотой. Образующийся при гидролизе эфир теряет фрагменты щавелевой кислоты в виде углекислого газа. 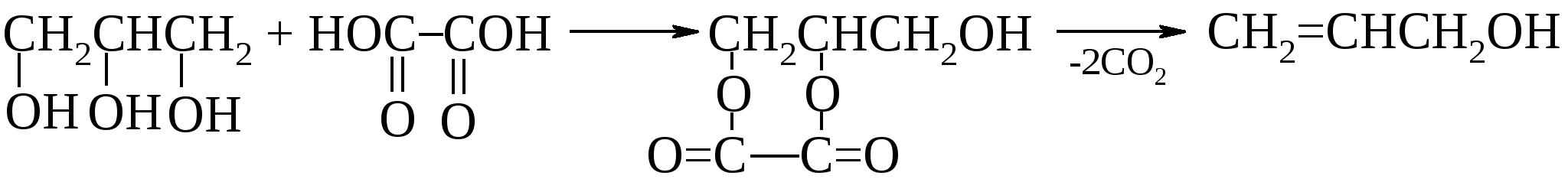 В настоящее время в промышленности аллиловый спирт получают изомеризацией пропиленоксида.
13.7.4. Высшие непредельные спирты Некоторые высшие непредельные спирты, имеющие одну или две двойные связи, найдены в эфирных маслах различных растений. Они отличаются сильным приятным запахом и являются основными началами этих масел. По своему строению они относятся к терпенам (см. Главу 10 «Диены») или легко могут быть в них превращены. Среди эфирных масел наиболее широко распространены следующие представители.
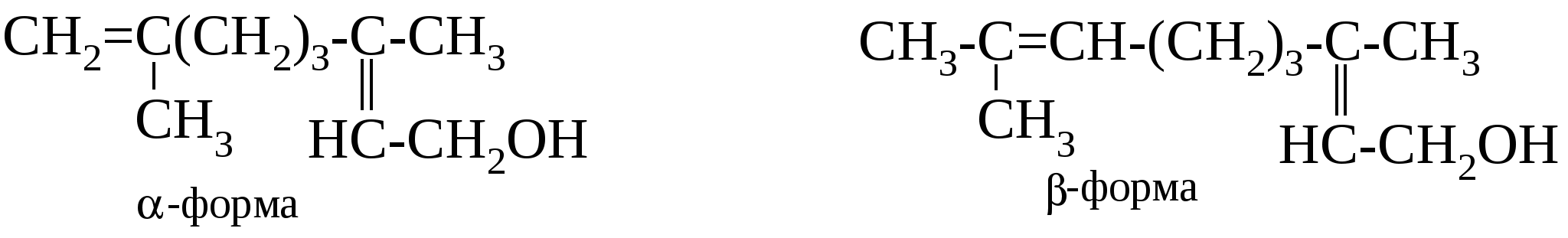 Его получают из эфирных масел многих растений, а также изомеризацией линалоола – (СН3)2С=СНСН2СН2С(СН3)(ОН)СН=СН2 или гидрированием цитраля.
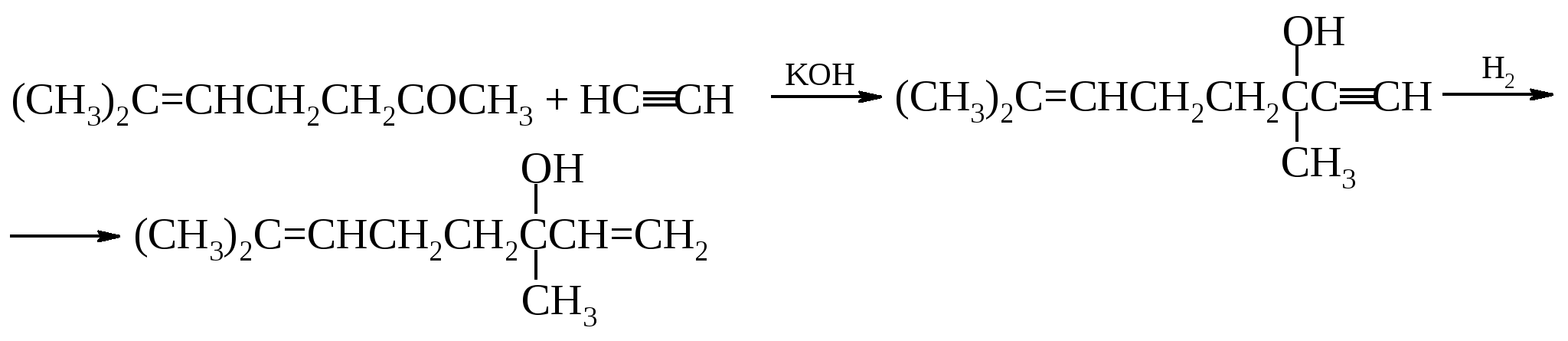
При озонировании и расщеплении этого спирта образуется гликолевый альдегид и кетон С18Н36О, который оказался идентичным кетону, полученному из гексагидрофарнезола.
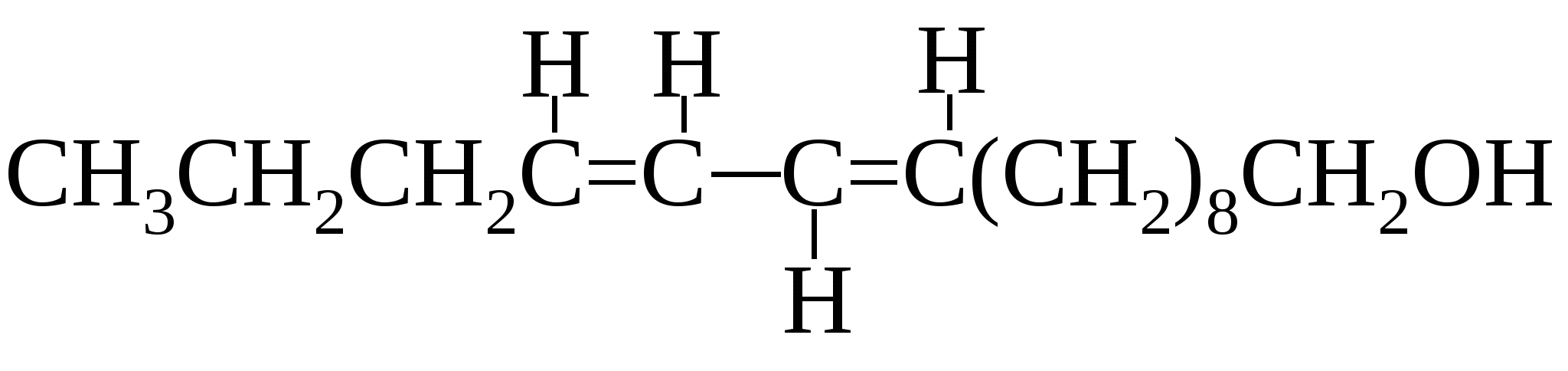 Самцы чувствуют его запах в сверхмалых концентрациях на огромном расстоянии от самок. 13.7.5. Ацетиленовые спирты и простые эфиры
Он обладает обычной спиртовой функцией, при замещении гидроксила способен к аллильной перегруппировке; имея ацетиленовый водород, может замещать его, как и ацетилен, на металлы, в частности, серебро и медь, или подвергаться гидроксиметилированию по Репе до бутиндиола. Пропаргиловый спирт в промышленности применяют для получения аллилового спирта, а также в качестве растворителя полиамидов, ацетата целлюлозы и других полимеров.
По Д. Якобсу их получают, действуя цинковой пылью в спирте на ацетали дибромацетальдегида, а затем отщепляя бромоводород от образовавшегося алкилбромвинилового эфира. Эти вещества нашли применение в диеновом синтезе, т.к. они легко конденсируются с диенами.
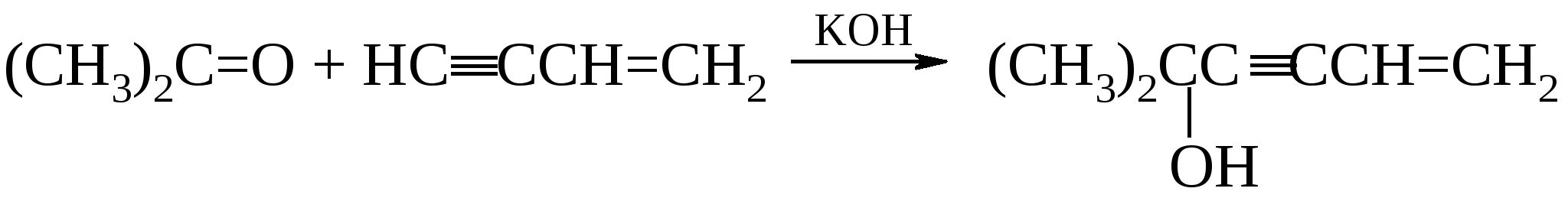 2-метилгексен-5-ин-3-ол-2 (диметилвинилэтинилкарбинол) Диметилвинилэтинилкарбинол легко полимеризуется в прозрачную стекловидную массу; его полимер применяется в качестве клея (карбинольный клей Назарова). 13.8. Гликоли До сих пор мы рассматривали только свойства одноатомных спиртов, хотя, конечно, обращалось внимание на то, как эти свойства изменяются в присутствии других заместителей. Теперь перейдем к некоторым наиболее важным классам полифункциональных соединений. В веществах этих классов функциональные группы влияют на свойства друг друга до такой степени, что в результате возникают определенные свойства, не характерные ни для одной из этих групп, а лишь для данной комбинации. Первыми в этом ряду будут рассмотрены двухатомные спирты или гликоли. Следует отметить, что присутствие двух гидроксильных групп у одного атома углерода невозможно, т. к. такие соединения вследствие дегидратации превращаются в альдегиды или кетоны. 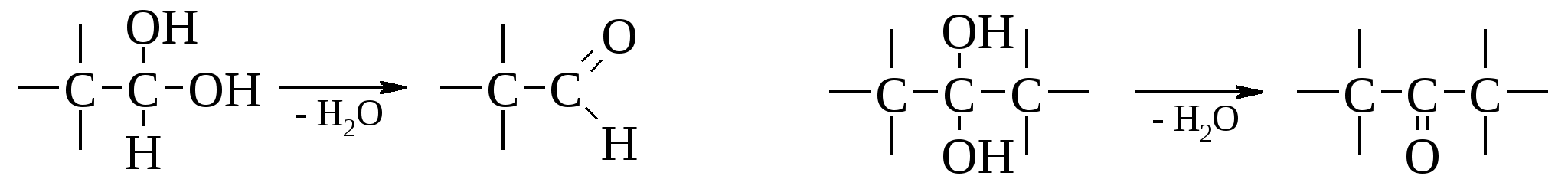 Однако их производные – ацетали и ацилали – устойчивы. 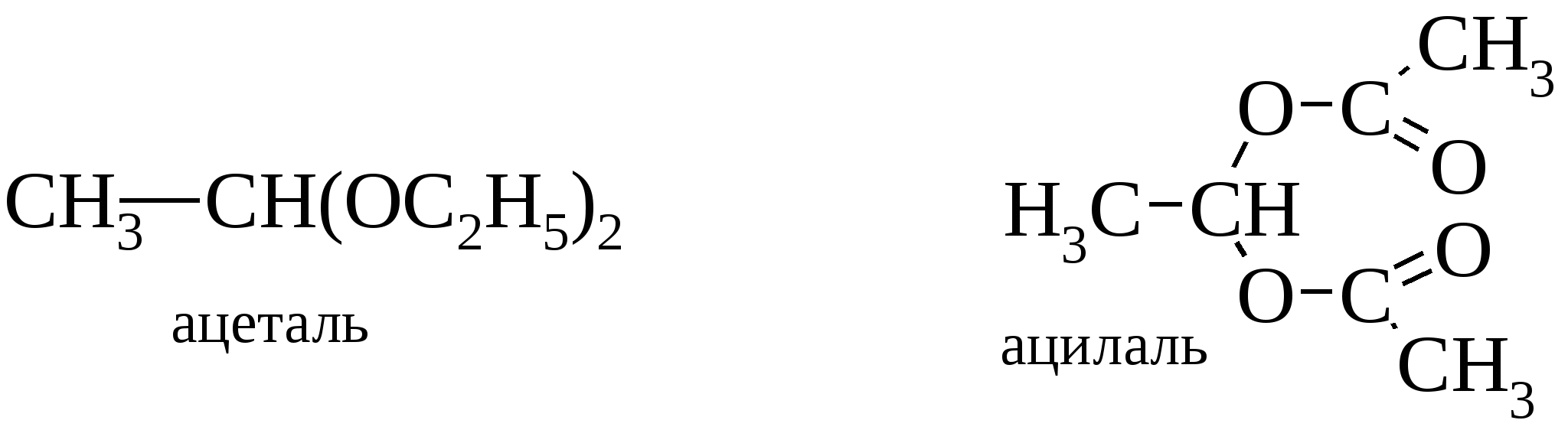 В свободном состоянии соединения устойчивы, если две и более гидроксильные группы содержатся у различных атомов. К важнейшим многоатомным спиртам принадлежат гликоли (две гидроксильные группы), глицерины (три гидроксила), инозиты (шесть гидроксилов) и моносахариды с различным числом гидроксильных групп. Последние содержат кроме гидроксилов еще альдегидную или кетонную группу. Рассмотрим сначала двухатомные спирты. 1,2-Гликоли имеют сладкий вкус, откуда и произошло название этого класса веществ. Примечательно, что с увеличением количества гидроксильных групп сладкий вкус усиливается. 13.8.1. Физические свойства гликолей Как и следовало ожидать из рассмотрения структуры гликолей, в которых имеется более одного центра для образования водородной связи, для них характерны высокие температуры кипения. Уже для простейшего члена ряда, этиленгликоля, температура кипения равна 197 С. Низшие гликоли смешиваются с водой, и даже гликоли, содержащие семь атомов углерода, обнаруживают заметную растворимость в воде. Гликоли – вязкие жидкости большей плотности, чем одноатомные спирты. Этиленгликоль находит применение в качестве компонента антифриза из-за своей высокой температуры кипения, низкой температуры замерзания и высокой растворимости в воде. Смесь 66,7% этиленгликоля и 33,3% воды, составляющая основу антифриза, замерзает при –75 С. 13.8.2. Методы синтеза гликолей
Этот способ получения гликолей оставался наиболее применимым до последнего времени; правда, теперь вместо ацетата серебра обычно пользуются более дешевым, но вполне пригодным ацетатом калия. Возможна также прямая замена галогенов гидроксильными группами при действии слабых оснований, например, раствора соды, но этот процесс протекает с плохими выходами вследствие побочных реакций.
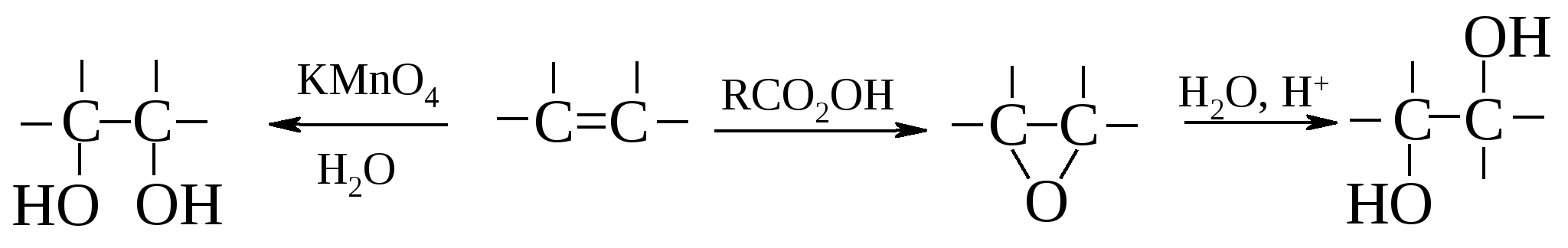 Пример: Различные способы гидроксилирования алкенов уже подробно рассматривались ранее. Напомним только, что окисление алкенов разбавленным раствором перманганатом калия (реакция Вагнера) приводит к цис-1,2-гликолям, так же как и окисление пероксидом водорода в присутствии оксида осмия(VIII) (реагент Майлса). Гидратация гомологов оксида этилена в кислой среде протекает по механизму SN2, в результате чего эпоксидное кольцо расщепляется с образованием транс-изомера. Следует отметить, что для получения исходных синтонов – эпоксидов, кроме традиционных методов – реакции Прилежаева или окисления алкенов над серебряным катализатором, – используют галогенгидрины.
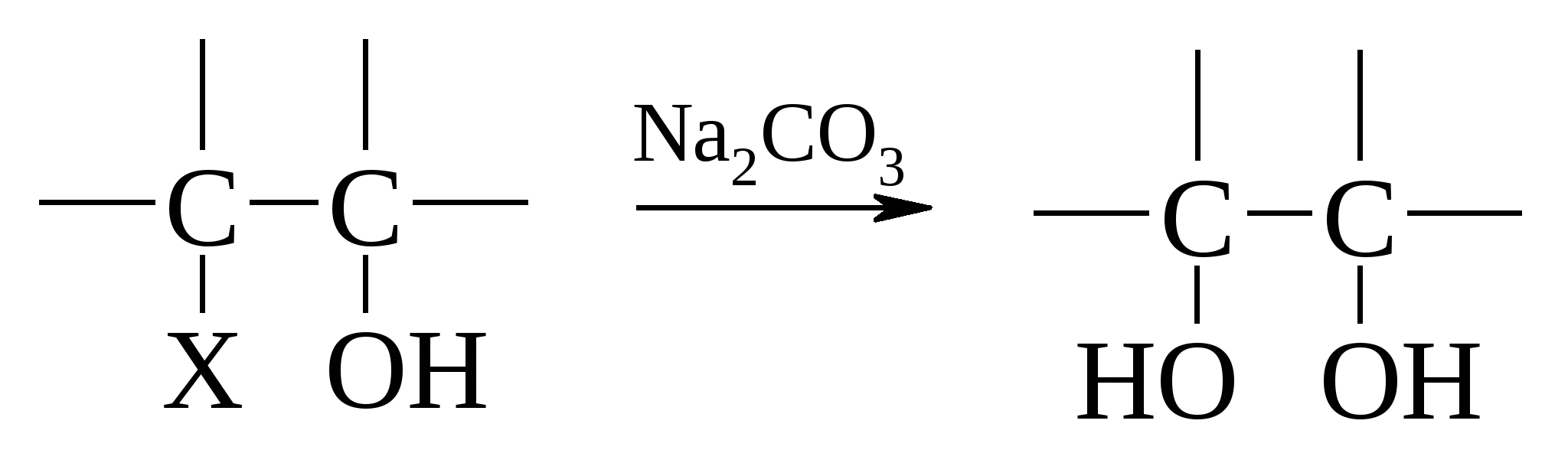 Пример:
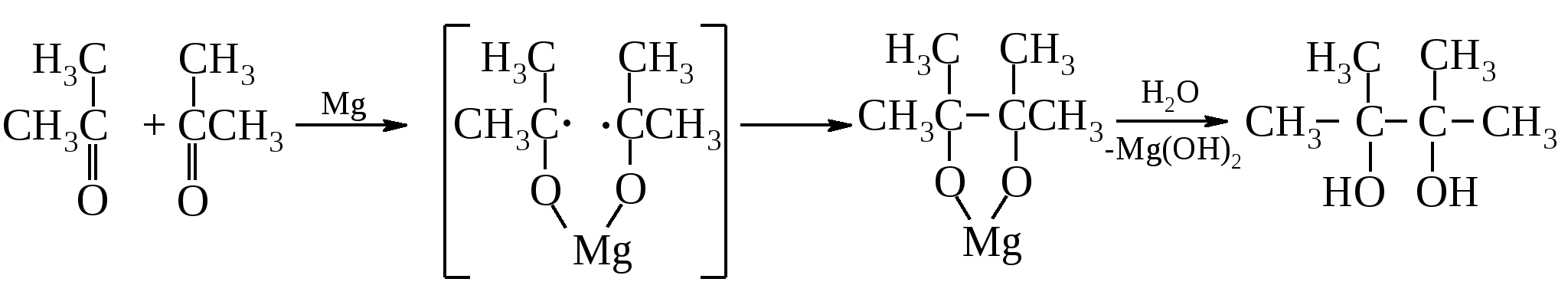
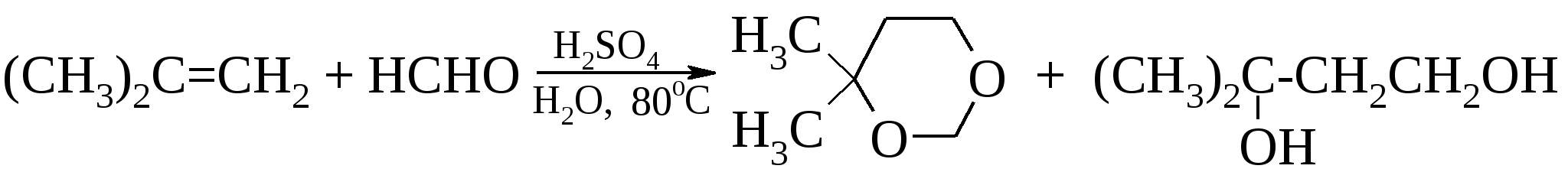
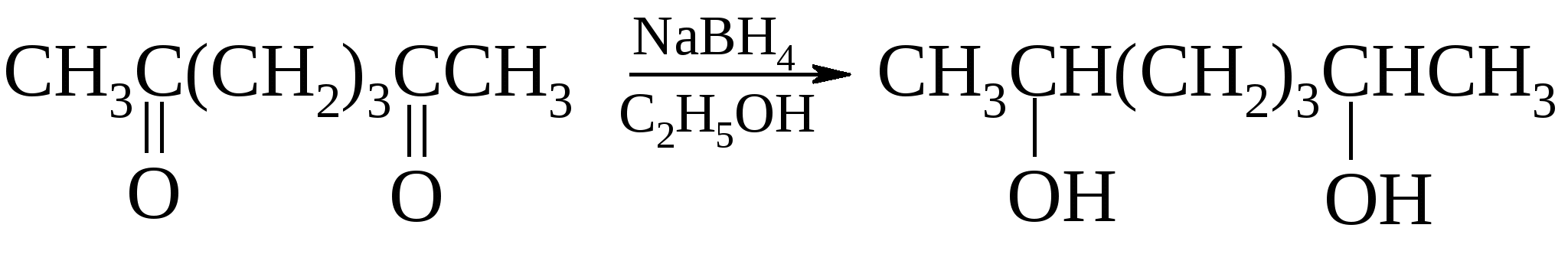
13.8.3. Химические свойства гликолей Также как и одноатомные спирты, гликоли могут иметь первичные, вторичные и третичные гидроксилы и все, что было сказано о свойствах одноатомных спиртов, относится и к соответствующим гликолям.
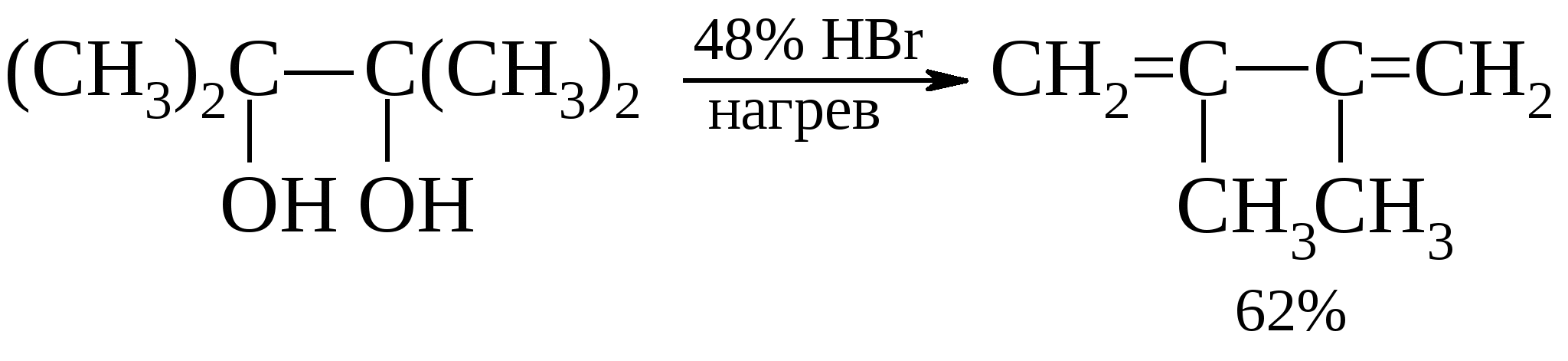 Более эффективно дегидратация идет на оксиде алюминия. Выход составляет от 70 до 85%. При нагревании этиленгликоля с хлоридом цинка происходит дегидратация с образованием ацетальдегида.
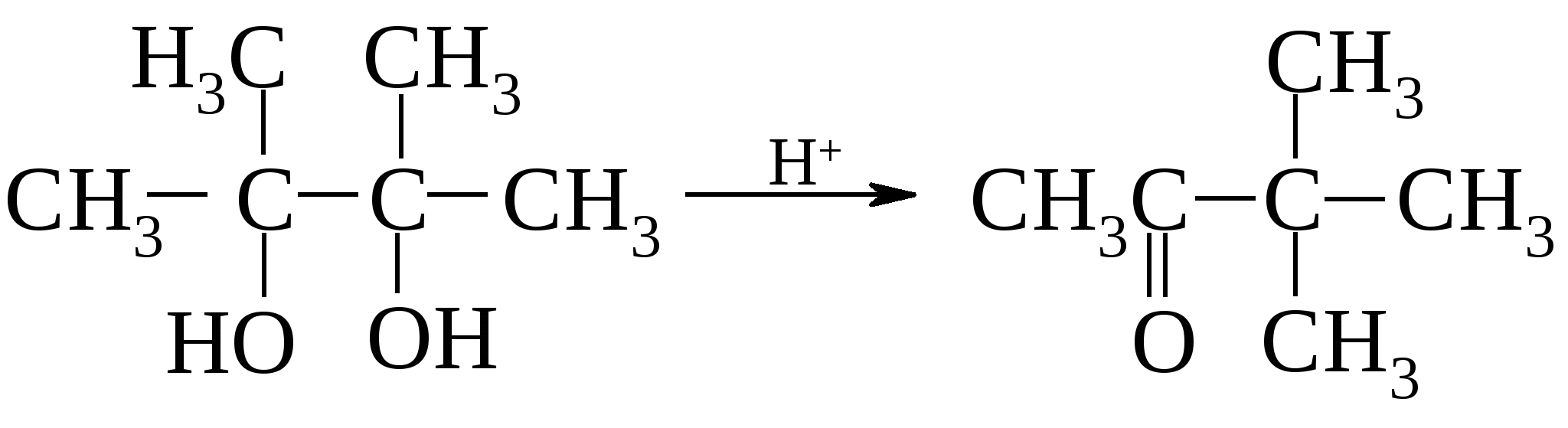 пинакон пинаколин Предполагается, что пинаколиновая перегруппировка включает две важные стадии. Сначала происходит отщепление воды от протонированного гликоля с образованием карбкатиона (1), а затем протекает перегруппировка карбкатиона с 1,2-метильным сдвигом с образованием протонированного кетона (2). 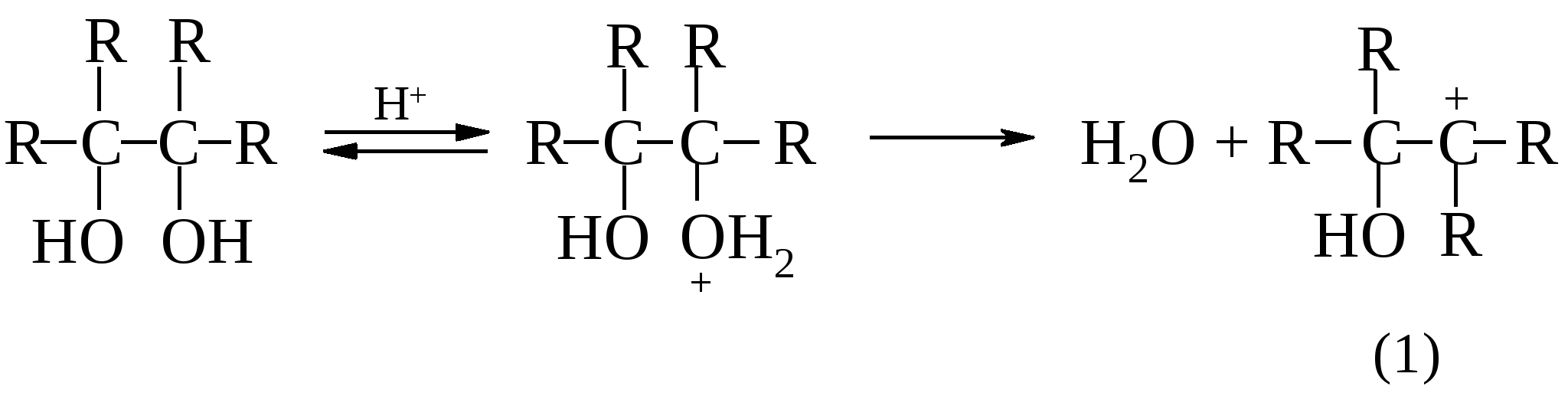 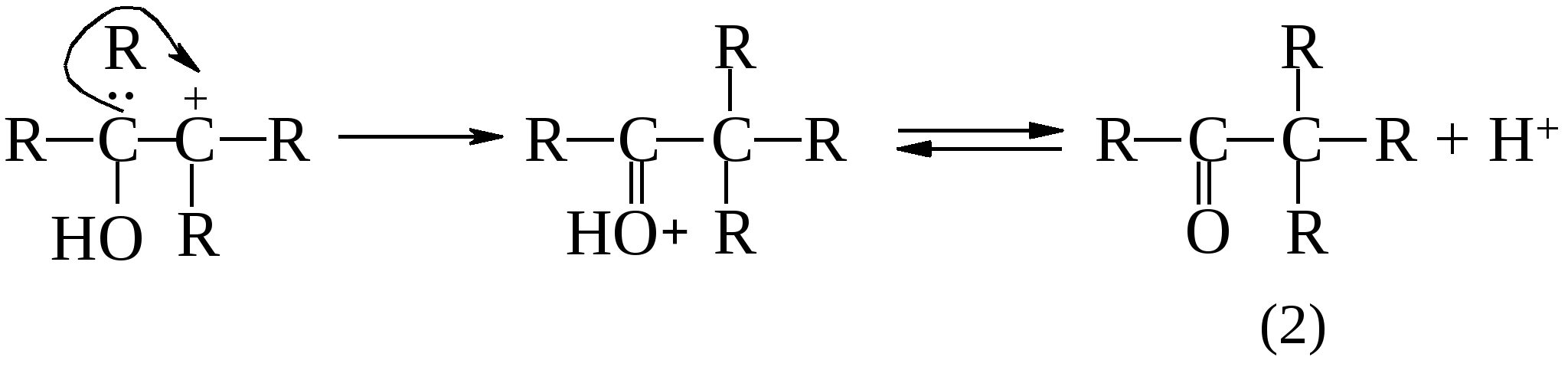 Как и в большинстве случаев 1,2-сдвигов к электронодефицитным атомам углерода, мигрирующая группа ни в какой момент не бывает совершенно «свободной»: она до тех пор не отрывается от «покидаемого» ею атома углерода, пока не образует связи с электронодефицитным центром (3). 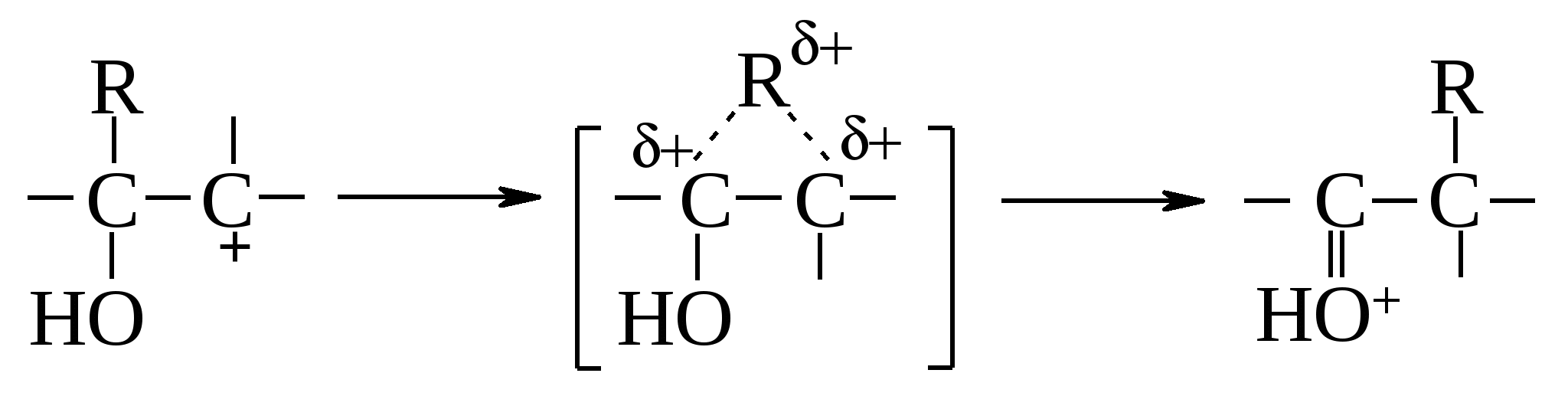 (3) (3)
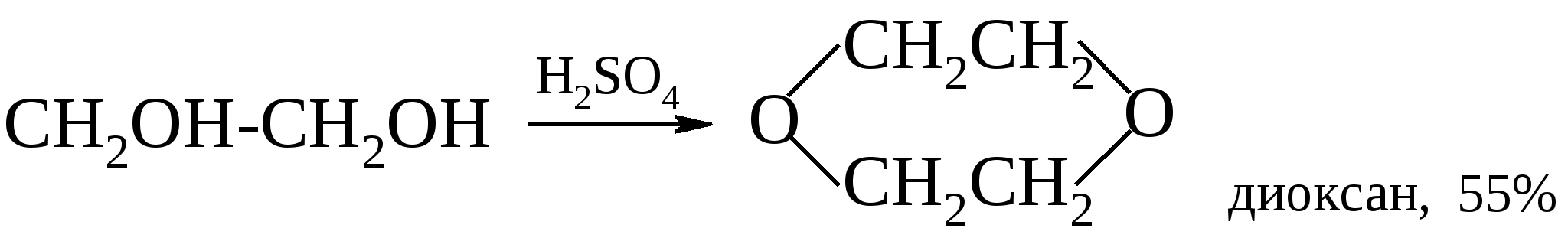 1,4-Диолы и 1,5-диолы превращаются в присутствии каталитических количеств минеральных кислот в тетрагидрофуран и тетрагидропиран. Эти реакции впервые были реализованы А. Фаворским. 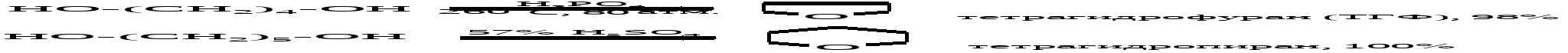 В последние годы ТГФ предпочитают получать гидрированием фурана при 80-140С, а катализаторами служат никель и осьмий или палладий.
7  Однако в промышленности ди- и триэтиленгликоль получаются в качестве побочного продукта при синтезе этиленгликоля из оксида этилена.
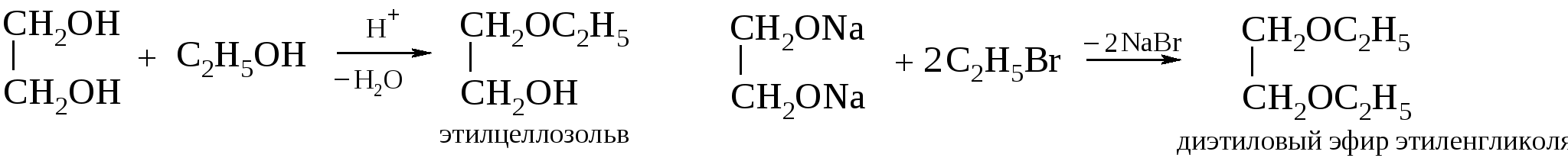 Аналогично спиртам гликоли или гликоляты реагируют с органическими одноосновными кислотами или их производными, образуя сложные эфиры: 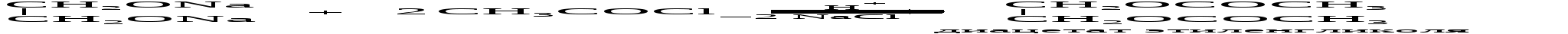 С двухосновными кислотами этиленгликоль образует сложные линейные полимеры.
с акрилонитрилом моно- и бис-цианэтиловые эфиры: 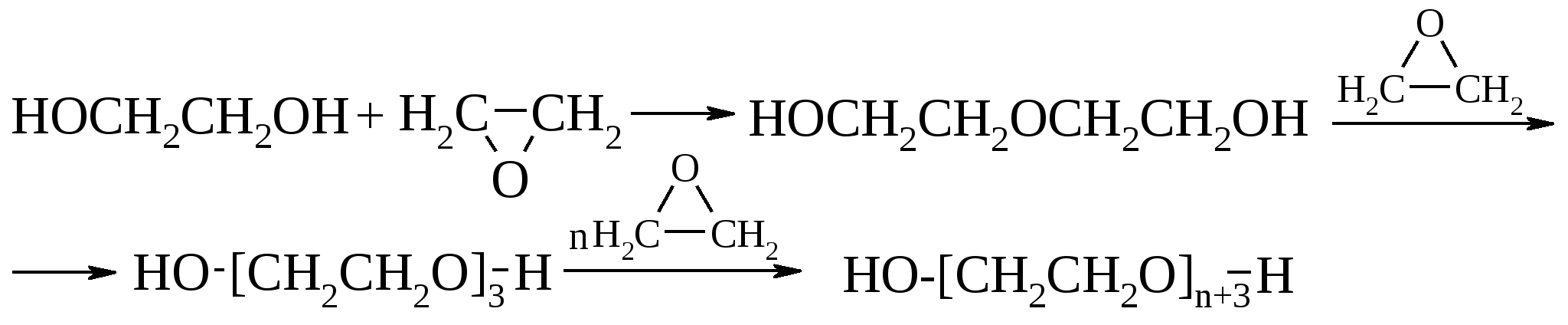
HOCH2CH(OH)CH3 + HCl → ClCH2CH(OH)CH3 + HOCH2CH2ClCH3 + H2O Следует отметить, что вторая гидроксильная группа замещается труднее. Для этой цели хлоргидрины необходимо обрабатывать хлоридом фосфора PCl5 или тионилхлоридом SOCl2.
|
