Справочный материал. Глава 18 – Эндокринная система. Справочный материал по Физиологии. Глава 18 Эндокринная система
 Скачать 0.66 Mb. Скачать 0.66 Mb.
|
|
Рис. 18–2. Гипоталамическая регуляция аденогипофиза [11]. Рилизинг–гормоны по аксонам нейросекреторных нейронов поступают в срединное возвышении, где секретируются в капилляры первичной капиллярной сети. Эти капилляры объединяются в несколько воротных вен гипофиза (vv. portae hypophysis), которые в передней доле гипофиза образуют вторичную капиллярную сеть. Таблица 18–1. Эффекты гипоталамических нейрогормонов на секрецию гормонов аденогипофиза
Сокращения: АК — аминокислота, пп — полипептид, п — пептид. Роль дофамина. Промежуточный продукт метаболизма тирозина и предшественник норадреналина и адреналина — катехоловый амин дофамин (3-гидрокситирамин), поступающий к клеткам передней доли гипофиза через кровь — ингибирует секрецию ФСГ, лютропина (лютеинизирующий гормон), тиреотропного гормона (ТТГ) и пролактина. Гормоны задней доли гипофиза Нанопептиды вазопрессин и окситоцин синтезируются в перикарионах нейросекреторных нейронов паравентрикулярного и супраоптического ядер гипоталамуса, транспортируются по их аксонам в составе гипоталамо-гипофизарного пути в заднюю долю гипофиза, где и секретируются в кровь (рис. 18–3, см. также рис. 16–3Г). Сигналом к секреции является импульсная активность этих же самых нейросекреторных нейронов. 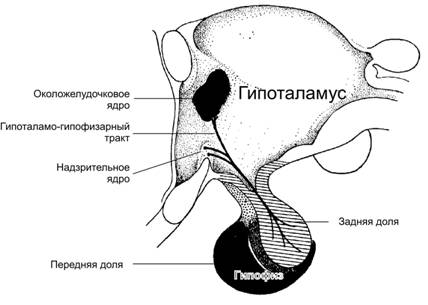 Рис. 18–3. Гипоталамо-гипофизарный тракт. Синтезируемые в телах нервных клеток супраоптического (nucleus supraopticus) и паравентрикулярного (n. paraventricularis) ядер гипоталамуса окситоцин и АДГ транспортируются по аксонам этих нейронов в заднюю долю гипофиза, где поступают в кровь. Вазопрессин (aргинин вазопрессин, антидиуретический гормон — АДГ, C46H65N15O12S2) оказывает антидиуретический (регулятор реабсорбции воды в канальцах почки) и сосудосуживающий (вазоконстриктор) эффекты (эти эффекты гормона приводят к повышению системного АД). Главная функция АДГ — регуляция обмена воды (поддержание постоянного осмотического давления жидких сред организма), что происходит в тесной связи с обменом натрия. Экспрессия гена АДГ происходит в части нейросекреторных нейронов паравентрикулярного и супраоптического ядер гипоталамуса. Внегипоталамическая секреция АДГ возможна в клетках злокачественных опухолей (например, овсяно–клеточная карцинома лёгкого, рак поджелудочной железы). Секрецию АДГ стимулируют: гиповолемия через барорецепторы каротидной области, гиперосмоляльность через осморецепторы гипоталамуса, переход в вертикальное положение, стресс, состояние тревоги. Секрецию АДГ подавляют: алкоголь, –адренергические агонисты, глюкокортикоиды. Окситоцин. Экспрессия гена окситоцина и гена АДГ происходит в многоотростчатых нейронах супраоптического и паравентрикулярного ядер гипоталамуса, но в отдельных группах нервных клеток. Регулятор секреции окситоцина и АДГ — импульсная активность аксонов нейросекреторных нейронов. При этом окситоцин, как и АДГ, отщепляется от нейрофизинов и поступает в кровь. Окситоцин секретируется также при раздражении соска и околососкового поля молочной железы. Мишени окситоцина — ГМК миометрия и миоэпителиальные клетки молочной железы. Окситоцин стимулирует сокращение ГМК миометрия в родах, при оргазме, в менструальную фазу месячного цикла Окситоцин также стимулирует сокращение миоэпителиальных клеток альвеол лактирующей молочной железы (рефлекс молокоотделения). Рецептор окситоцина — трансмембранный гликопротеин, связанный с G белком. Взаимодействие окситоцина с его рецептором приводит к стимуляции фосфолипазы С, образованию фосфатидилинозитола и увеличению содержания внутриклеточного Ca2+. Передняя доля гипофиза В передней доле синтезируются и секретируются так называемые тропные гормоны и пролактин (рис. 18–4). Тропными называют гормоны, мишенями которых являются другие эндокринные клетки. По химической структуре гормоны аденогипофиза являются либо пептидными гормонами, либо гликопротеинами. Гликопротеины: тиреотропный гормон и гонадотропины (лютеинизирующий гормон — ЛГ и фолликулостимулирующий гормон — ФСГ). Полипептидные гормоны: гормон роста, адренокортикотропный гормон (АКТГ) и пролактин. При экспрессии гена проопиомеланокортина — помимо АКТГ — происходит синтез и секреция ряда других пептидов (- и липотропины, меланокортины [-, - и меланотропины], эндорфин, АКТГ–подобный пептид), из которых гормональная функция установлена для меланотропинов; функции остальных пептидов изучены недостаточно. 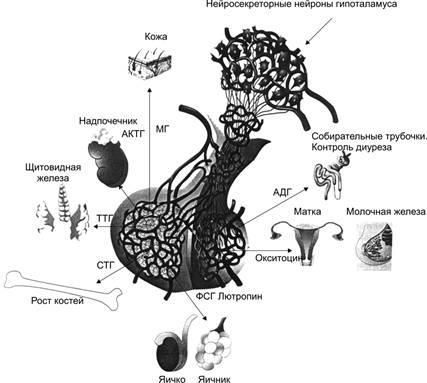 Рис. 18–4. Система «Гипоталамус–гипофиз–периферические органы–мишени» [11]. В гипофизе слева — передняя доля, справа — задняя доля. МК — меланокортины. Гормоны роста Гормон роста (соматотрофный гормон — СТГ, соматотропин) нормально синтезируется только в ацидофильных клетках (соматотрофы) передней доли гипофиза. Другой гормон роста — хорионический соматомаммотрофин (плацентарный лактоген, 190 аминокислот, мол. масса 22 125) синтезируется в клетках синцитиотрофобласта (другими словами, гены этого гормона принадлежат геному плода). Эффекты гормонов роста опосредуют инсулиноподобные факторы роста — соматомедины. Гормоны роста — анаболики, они стимулируют рост всех тканей. Другие гормоны (йодсодержащие гормоны щитовидной железы, глюкокортикоиды, инсулин, а также факторы роста нервов, фибробластов, эпидермиса и другие) также имеют аналогичный эффект. Структура. Нативный гормон роста — полипептид (191 аминокислотный остаток, C990H1529N263O299S7, мол. масса 22 124). Рекомбинантный СТГ содержит полную последовательность нативного соматотропина и N-концевой метионин (C995H1537N263O301S8). Регуляторы экспрессии (см. также таблицу 18–2). Соматолиберин стимулирует синтез и секрецию СТГ. Соматостатин подавляет секрецию СТГ. СТГ, выделившийся из эндокринных клеток аденогипофиза, подавляет дальнейшую его секрецию. На секрецию СТГ влияют физическая нагрузка, гипогликемия, аминокислоты (например, аргинин), адреноблокаторы, половые гормоны, ЛС (например, l-дофа, клонидин). При голодании и недостаточном питании секреция СТГ увеличивается. В сочетании с другими гормонами (кортизол, адреналин и глюкагон) СТГ адаптирует организм к этим ситуациям, мобилизуя в качестве источника энергии свободные жирные кислоты из жировых запасов. Таблица 18–2. Стимулирующие и подавляющие влияния на секрецию гормона роста
Суточная периодичность секреции. СТГ поступает в кровь циклически — «взрывами секреции», чередующимися с периодами прекращения секреции (продолжительность такого цикла измеряется минутами). Пик секреции СТГ приходится на третью и четвёртую фазы сна. Возрастные изменения секреции СТГ. Содержание СТГ в плазме крови наибольшее в раннем детском возрасте, постепенно уменьшается с возрастом и составляет: от 5 до 20 лет — 6 нг/мл (с пиком на стадии пубертата), от 20 до 40 лет — 3 нг/мл, после 40 лет — 1 нг/мл. Содержание соматомедина C начинает увеличиваться после рождения, достигает пика в пубертатном возрасте, далее постепенно уменьшается. Не исключено, что возрастные инволюционные процессы в виде увеличения морщин на коже, уменьшения мышечной массы и интенсивности метаболизма являются результатом сниженной секреции СТГ. Действительно, при терапии СТГ увеличивается содержание белков (особенно в мышцах), уменьшается отложение жира, ощущается прилив энергии. Функции СТГ — анаболический гормон, стимулирующий рост всех клеток за счёт увеличения поступления в клетки аминокислот и усиления синтеза белка. Наиболее очевидны долговременные эффекты СТГ на рост костей. При этом мишенями СТГ являются клетки эпифизарной хрящевой пластинки длинных трубчатых костей и остеобласты периоста и эндоста. Эпифизарный хрящ. Рост длинных трубчатых костей в длину происходит за счёт пролиферации и дифференцировки клеток эпифизарной хрящевой пластинки (энхондральный остеогенез, или образование кости на месте хряща). СТГ стимулирует этот процесс. Остеобласты. Утолщение костей происходит за счёт дифференцировки остеобластов надкостницы (периост) и эндоста. СТГ стимулирует этот процесс. В итоге наблюдается аппозиционный (наложением) рост кости. Метаболические эффекты СТГ двуфазны, направлены на поддержание уровня глюкозы в крови и обеспечение энергетических затрат организма. Начальная фаза (инсулиноподобный эффект). СТГ увеличивает поглощение глюкозы мышцами и жировой тканью, а также поглощение аминокислот и синтез белка мышцами и печенью. Одновременно СТГ угнетает липолиз в жировой ткани. Через несколько минут развивается отсроченная фаза эффектов СТГ. Отсроченная фаза (антиинсулиноподобный, или диабетогенный эффект; см. таблицу 18–3). Через несколько десятков минут происходят угнетение поглощения и утилизации глюкозы (содержание глюкозы в крови увеличивается) и усиление липолиза (содержание свободных жирных кислот в крови увеличивается). При длительном воздействии СТГ развивается резистентность клеток–мишеней (мышцы, жировая ткань, печень) к эффектам инсулина. Такая инсулинорезистентность приводит к нарушениям углеводного и жирового обмена, появляются симптомы сахарного диабета типа II. Таблица 18–3. Диабетогенные эффекты гормона роста.
Обмен белка. СТГ стимулирует поступление аминокислот и синтез белка в клетках (анаболический эффект). Жировой обмен. СТГ усиливает липолиз, освобождающиеся при этом жирные кислоты используются для пополнения энергетических затрат клеток. В итоге под влиянием СТГ происходит перераспределение в очерёдности использования веществ для получения энергии: используются жиры, а не углеводы или белки. Поскольку СТГ имеет анаболический эффект, это приводит к увеличению массы тела без накопления жиров. Циркуляция в крови. Время полужизни СТГ в крови около 25 минут. Около 40% выделившегося СТГ образует комплекс с СТГ–связывающим белком, при этом продолжительность полужизни СТГ значительно возрастает. Рецептор СТГ относится (вместе с рецептором пролактина, ряда интерлейкинов и эритропоэтина) к семейству цитокиновых рецепторов (связанные с тирозинкиназой рецепторы). СТГ связывается также с рецептором пролактина. Соматомедины C и A (полипептиды из 70 и 67 аминокислотных остатков соответственно) опосредуют эффекты СТГ, выступая в качестве аутокринных факторов роста. Оба соматомедина имеют выраженную структурную гомологию с проинсулином, почему их также называют инсулиноподобными факторами роста. Рецепторы соматомединов, как и рецептор инсулина, относятся к рецепторным тирозинкиназам. Соматомедин C, связываясь с его рецепторами, стимулирует синтез гипофизарного СТГ и гипоталамического соматостатина и подавляет синтез гипоталамического соматолиберина. Карликовость и низкорослость развиваются при патологии гипоталамуса (вследствие дефицита соматолиберина) и гипофиза, а также как результат мутаций генов соматолиберина, СТГ и его рецепторов, соматомединов и их рецепторов. Пангипопитуитаризм — снижение или отсутствие секреции всех аденогипофизарных гормонов, включая и гормон роста. При гипофизарной карликовости все части тела развиваются пропорционально, но скорость их роста крайне замедлена. При пангипопитуитаризме карлики имеют сниженную половую функцию. При изолированном дефиците СТГ у них сохраняется сексуальная и репродуктивная деятельность. В настоящее время современные технологии позволяют вырабатывать рекомбинантный СТГ в достаточном количестве. Поэтому карликовость, вызванная только недостатком СТГ, может полностью излечиваться в раннем возрасте. Избыток СТГ обычно наблюдается при СТГ–секретирующих аденомах передней доли гипофиза. При этом у детей (до завершения остеогенеза) развивается гипофизарный гигантизм. По завершении окостенения точек роста развивается акромегалия. Гигантизм — результат чрезмерно высокой активности клеток, вырабатывающих СТГ. Все части тела, включая кости, растут очень быстро. Для гигантов обычно характерна гипергликемия вследствие дегенерации. -клеток островков Лангерханса. Поэтому у 10% гигантов развивается сахарный диабет. Акромегалия возникает при избыточной секреции гормона роста после того, как исчезают эпифизарные хрящевые пластинки длинных трубчатых костей срастаются и рост тела прекращается. Однако, под влиянием СТГ происходит рост костей в толщину, особенно заметный на руках и ногах и на плоских костях, включая кости черепа, носа, выпуклости лицевого черепа, нижнюю челюсть, части позвоночного столба. Многие органы (например, язык, печень, почки) также чрезмерно увеличены. Адренокортикотропный гормон Адренокортикотропный гормон (АКТГ, кортикотропин). Структуру АКТГ кодирует ген проопиомеланокортина. Ген проопиомеланокортина содержит нуклеотидные последовательности, кодирующие АКТГ и -липотропин. Так называемый большой АКТГ содержит -меланотропин (аминокислотные остатки 1-13) и АКТГ–подобный пептид (18-39), а -липотропин — -липотропин (в свою очередь содержащий -меланотропин) и -эндорфин. Структура. АКТГ состоит из 39 аминокислотных остатков, первые 24 аминокислотных остатка обеспечивают полную биологическую активность гормона. Синтез АКТГ осуществляют базофильные аденоциты (кортикотрофы) преимущественно передней и в меньшей степени промежуточной доли гипофиза, а также ряд нейронов ЦНС. Эктопическая секреция АКТГ характерна для некоторых опухолей лёгкого, щитовидной и поджелудочной желёз. Регуляторы экспрессии Кортиколиберин стимулирует синтез и секрецию АКТГ. Глюкокортикоиды Высокие дозы глюкокортикоидов ингибируют секрецию как АКТГ, так и кортиколиберина. Низкие концентрации глюкокортикоидов в крови стимулируют секрецию АКТГ. Стресс (например, эмоциональный, лихорадка, острая гипогликемия, хирургические операции) стимулирует секрецию АКТГ. Суточный ритм. Секреция АКТГ начинает расти после засыпания и достигает пика при пробуждении. Функции. АКТГ стимулирует синтез и секрецию гормонов коры надпочечников (преимущественно глюкокортикоида кортизола). Гиперсекреция АКТГ ведёт к гиперплазии коры надпочечников с увеличением секреции не только глюкокортикоидов, но и минералокортикоидов. Болезнь Иценко–Кушинга развивается вследствие повышенной секреции гипофизом АКТГ (например, при вырабатывающих АКТГ аденомах). Синдром Кушинга — состояние любого происхождения, характеризующееся повышенным уровнем глюкокортикоидов. Дефицит АКТГ вызывает эндокринную недостаточность надпочечников. Рецепторы АКТГ (АКТГ связывается с рецептором меланокортина типа 2) относятся к мембранным, связанным с G белком (активирует аденилатциклазу, что при помощи цАМФ в конечном итоге активирует многочисленные ферменты синтеза глюкокортикоидов). Мутации рецепторов приводят к развитию резистентности коры надпочечников к АКТГ (глюкокортикоидная недостаточность). Меланокортины Меланокортины (меланотропины) контролируют пигментацию кожи и слизистых оболочек. Экспрессия АКТГ и меланокортинов в значительной степени сочетаются. Меланостатин подавляет секрецию меланотропинов (вероятно, и АКТГ). Известно несколько типов рецепторов меланокортинов, через тип 2 этих рецепторов происходит также реализация эффектов АКТГ. Гонадотропные гормоны К этой группе относят гипофизарные фоллитропин (фолликулостимулирующий гормон — ФСГ) и лютропин (ЛГ, лютеинизирующий гормон), а также хорионический гонадотропин (ХГТ) плаценты. Гонадотропные гормоны, а также тиреотропный гормон (ТТГ) — гликопротеины, состоящие из двух СЕ. СЕ всех 4 гормонов идентична, СЕ различна. Фолликулостимулирующий гормон (ФСГ, фоллитропин) у женщин вызывает рост фолликулов яичника, у мужчин регулирует сперматогенез (мишени ФСГ — клетки Сертоли). Лютеинизирующий гормон (ЛГ, лютропин) стимулирует синтез тестостерона в клетках Ляйдига яичек (у мужчин ЛГ иногда называют «стимулирующий интерстициальные клетки гормон»), синтез эстрогенов и прогестерона в яичниках, стимулирует овуляцию и образование жёлтого тела в яичниках. Хорионический гонадотропин (ХГТ) синтезируется клетками трофобласта с 10–12 дней развития. При беременности ХГТ взаимодействует с клетками жёлтого тела и стимулирует синтез и секрецию прогестерона. Регуляторы экспрессии гонадотропинов Гонадолиберин стимулирует синтез и секрецию ФСГ и ЛГ в базофилах (гонадотрофы) передней доли гипофиза. - и -ингибины — гликопротеины, вырабатываемые зернистыми клетками фолликулов яичника и клетками Сертоли яичка, подавляют секрецию ФСГ. Рецепторы гонадотропинов — трансмембранные гликопротеины, связанные с G белком (происходит активация аденилатциклазы). Идентифицирован рецептор для ФСГ и общий рецептор для ЛГ и ХГТ. Преждевременный пубертат. Преждевременное изосексуальное половое созревание: девочки — менархе (первое менструальное кровотечение) до 8,5 лет, мальчики — маскулинизация до 10 лет. Причины далеко не всегда ясны, но в любом случае происходит увеличение секреции гипофизарных гонадотропинов. Недостаточность гонадотропинов приводит, как правило, к развитию гипогонадотрофного гипогонадизма (неадекватное функционирование половых желёз из за дефектов гаметогенеза, гонад и/или секреции половых гормонов; выраженное или неполное развитие вторичных половых признаков). Тиреотропный гормон Гликопротеиновой природы тиреотропный гормон (ТТГ, тиреотропин) стимулирует синтез и секрецию йодсодержащих гормонов щитовидной железы (T3 и T4). ТТГ состоит из двух СЕ (при этом СЕ ТТГ, ФСГ, ЛГ и ХГТ идентична). Синтез ТТГ происходит в базофильных клетках (тиреотрофы) передней доли гипофиза. Регуляторы экспрессии Соматостатин подавляет секрецию ТТГ. Тиреолиберин стимулирует синтез и секрецию ТТГ. Гормоны щитовидной железы (Т3 и Т4), циркулирующие в крови, подавляют секрецию ТТГ по принципу отрицательной обратной связи. Функции. Тиреотропин стимулирует дифференцировку эпителиальных клеток щитовидной железы (кроме так называемых светлых клеток, синтезирующих тиреокальцитонин) и их функциональное состояние (включая синтез тиреоглобулина и секрецию Т3 и Т4). При дефиците ТТГ развивается недостаточность щитовидной железы — вторичный гипотиреоз (первичный гипотиреоз возникает при различных поражениях щитовидной железы). Рецептор ТТГ — трансмембранный гликопротеин, связанный с G белком (активация аденилатциклазы). Связывание аутоантител. Внеклеточный домен рецептора ТТГ имеет участки связывания с так называемыми стимулирующими щитовидную железу Ig (например, аутоантиген системной красной волчанки). Экспрессия рецептора происходит в фолликулярных клетках щитовидной железы, а также в ретробульбарных тканях, что объясняет офтальмопатии при гиперфункции щитовидной железы. Мутации гена, кодирующего рецептор ТТГ, многочисленны, их последствия — синдромы резистентности щитовидной железы к эффектам ТТГ. Эндокринная функция щитовидной железы при этих синдромах может быть увеличена (гипертиреоз), уменьшена (гипотиреоз) или нормальна (эутиреоз). Пролактин Пролактин ускоряет развитие молочной железы и стимулирует секрецию молока. Ген PRL кодирует полипептид, имеющий сходство аминокислотных последовательностей (гомология) с СТГ и хорионическим соматомаммотрофином (плацентарный лактоген). Синтез пролактина происходит в ацидофильных аденоцитах (лактотрофы) передней доли гипофиза. Количество лактотрофов составляет не менее трети всех эндокринных клеток аденогипофиза. При беременности объём передней доли удваивается за счёт увеличения числа лактотрофов (гиперплазия) и увеличения их размеров (гипертрофия). Регуляторы экспрессии Пролактиностатин подавляет секрецию пролактина из лактотрофных клеток передней доли гипофиза. Дофамин ингибирует синтез и секрецию пролактина. Тиреолиберин стимулирует секрецию пролактина из лактотрофов. Стимуляция соска и околососкового поля увеличивает секрецию пролактина. Стресс. Увеличение секреции пролактина происходит при различных стрессах. Опухоли аденогипофиза. Гиперсекреция пролактина — один из важных симптомов аденом гипофиза (около половины всех гипофизарных аденом секретирует пролактин). Функции. Главная функция пролактина — стимуляция функции молочной железы. Рецептор пролактина — мембранный полипептид семейства цитокиновых рецепторов (связанный с тирозинкиназой рецептор). Гены рецепторов гормона роста и пролактина происходят из общего предшественника и расположены рядом в хромосоме 5. Рецептор пролактина также связывает СТГ, что объясняет лактогенный эффект при гиперсекреции соматотрофина (например, при акромегалии). Гиперсекреция пролактина приводит к разным нарушениям. Симптоматика: Женщины. Менструальные нарушения и галакторея (синдром галактореи–аменореи). Мужчины. Галакторея, импотенция и снижение либидо. Дети. Задержка полового созревания. Дефицит пролактина может стать причиной послеродовой недостаточной лактации. Щитовидная железа В клетках щитовидной железы происходит синтез двух химически и функционально разных классов гормонов — йодсодержащих (синтезируются в эпителиальных фолликулах железы) и продуктов экспрессии кальцитониновых генов (синтезируются в так называемых светлых клетках — C клетки — фолликулов). Йодсодержащие гормоны железы — производные тирозина. Тироксин (T4) и трийодтиронин (Т3) увеличивают обменные процессы, ускоряют катаболизм белков, жиров и углеводов, необходимы для нормального развития ЦНС, увеличивают ЧСС и сердечный выброс. Кальцитонин (32-аминокислотный пептид) и катакальцин (21-аминокислотный пептид). Их функции антагонистичны эффектам ПТГ — гормона паращитовидной железы: кальцитонин уменьшает [Са2+] в крови, стимулирует минерализацию кости, усиливает почечную экскрецию Са2+, фосфатов и Na+ (уменьшается их реабсорбция в канальцах почки). Относящиеся к кальцитониновому гену пептиды и (37 аминокислот) экспрессируются в ряде нейронов ЦНС и на периферии (особенно в связи с кровеносными сосудами). Их функции — участие в ноцицепции, пищевом поведении, а также в регуляции тонуса сосудов. Рецепторы к этим пептидам найдены в ЦНС, сердце, плаценте. Тироксин Тироксин { [(3,5 дийодо-4 гидроксифенокси)-3,5 дийодофенил]аланин, или 3,5,3',5' тетрайодтиронин, C15H11I4NO4, Т4, мол. масса 776,87} образуется из пары дийодтирозинов. Тироксин — основной йодсодержащий гормон, на долю T4 приходится не менее 90% всего содержащегося в крови йода. Транспорт в крови. Не более 0,05% Т4 циркулирует в крови в свободной форме, практически весь тироксин находится в связанной с белками плазмы форме. Главный транспортный белок — тироксин–связывающий глобулин (связывает 80% Т4); на долю тироксин–связывающего преальбумина, а также альбумина приходится 20% Т4. Время циркуляции в крови (время полужизни) T4 около 7 дней, при гипертиреозе — 3-4 дня, при гипотиреозе — до 10 дней. L-форма тироксина физиологически примерно вдвое активнее рацемической (DL-тироксин), D-форма гормональной активности не имеет. Дейодирование наружного кольца тироксина, частично происходящее в щитовидной железе, осуществляется преимущественно в печени и приводит к образованию Т3. Реверсивный трийодтиронин. Дейодирование внутреннего кольца тироксина происходит в щитовидной железе, преимущественно в печени и частично в почке, в результате образуется реверсивный (обратный) Т3 (3,3',5' трийодтиронин, rT3 [от англ. reverse]), имеющий после рождения незначительную физиологическую активность. Содержание rT3 в амниотической жидкости много выше rT3 крови матери. Это обстоятельство означает, что преобладающий йодсодержащий гормон плода — rT3. Измерение rT3 в амниотической жидкости используют для диагностики возможной недостаточности функции щитовидной железы (гипотиреоз плода). Рецепторы тиреоидных гормонов Ядерные рецепторы тиреоидных гормонов — факторы транскрипции. Известно не менее трёх подтипов этих рецепторов: 1, 2 и . 1 и -подтипы — трансформирующие гены ERBA1 и ERBA2 соответственно. Подтип 1 экспрессируется преимущественно в ЦНС, подтипы 2 и экспрессируется во многих органах. Сродство Т3 к рецепторам клеток–мишеней в 10 раз выше, чем у Т4. Нечувствительность к тиреоидным гормонам. Известно несколько десятков дефектов генов, приводящих на фоне различной выраженности гипертиреоза к развитию различных синдромов (например, к синдрому гиперактивного ребёнка, периодической тахикардии, затруднённому обучению, низкорослости, глухоте). Функции йодсодержащих гормонов Функции йодсодержащих гормонов многочисленны. Т3 и Т4 увеличивают интенсивность обменных процессов, ускоряют катаболизм белков, жиров и углеводов, они необходимы для нормального развития ЦНС, увеличивают ЧСС и сердечный выброс. Крайне разнообразные эффекты йодсодержащих гормонов на клетки–мишени (ими практически являются все клетки организма) объясняют увеличением синтеза белков и потребления кислорода. Синтез белков увеличивается в результате активации транскрипции в клетках–мишенях, в том числе гена гормона роста. Йодтиронины расценивают как синергисты гормона роста. При дефиците Т3 клетки гипофиза теряют способность к синтезу СТГ. Потребление кислорода возрастает в результате увеличения активности Na+,K+ АТФазы. Печень. Йодтиронины ускоряют гликолиз, синтез холестерола и синтез жёлчных кислот. В печени и жировой ткани Т3 повышает чувствительность клеток к эффектам адреналина (стимуляция липолиза в жировой ткани и мобилизация гликогена в печени). Мышцы. Т3 увеличивает потребление глюкозы, стимулирует синтез белков и увеличение мышечной массы, повышает чувствительность к действию адреналина. Теплопродукция. Йодтиронины участвуют в формировании ответной реакции организма на охлаждение увеличением теплопродукции, повышая чувствительность симпатической нервной системы к норадреналину и стимулируя секрецию норадреналина. Гиперйодтиронинемия. Очень высокие концентрации йодтиронинов тормозят синтез белков и стимулируют катаболические процессы, что приводит к развитию отрицательного азотистого баланса. Оценка функций щитовидной железы Радиоиммунологический анализ позволяет прямо измерять содержание Т3, Т4, тиреотропного гормона (ТТГ). Поглощение гормонов смолами — непрямой метод определения связывающих гормоны белков. Индекс свободного тироксина — оценка свободного Т4. Тест стимуляции ТТГ тиреолиберином определяет секрецию в кровь тиреотропина в ответ на внутривенное введение тиреолиберина. Тесты выявления АТ к рецепторам ТТГ выявляют гетерогенную группу Ig, связывающихся с рецепторами ТТГ эндокринных клеток щитовидной железы и изменяющих её функциональную активность. Сканирование щитовидной железы при помощи изотопов технеция (99mТс) позволяет выявить области пониженного накопления радионуклида (холодные узлы), обнаружить эктопические очаги щитовидной железы или дефект паренхимы органа. 99mТс накапливается только в щитовидной железе, период полувыведения составляет всего 6 часов. Исследование поглощения радиоактивного йода при помощи йода-123 (123I) и йода-131 (131I). Содержание йода в питьевой воде. Проводится йодирование воды на водопроводных станциях. Пищевая соль. В России запрещено выпускать нейодированную пищевую соль. Тиреоидный статус определяет эндокринную функцию щитовидной железы. Эутиреоидия — отсутствие отклонений. Заболевание щитовидной железы можно предположить при появлении симптомов недостаточности эндокринной функции (гипотиреоз), избыточных эффектов тиреоидных гормонов (гипертиреоз) либо при очаговом или диффузном увеличении щитовидной железы (зоб). Избыточная секреция тиреоидных гормонов (табл. 18–4). Повышает основной обмен на 60–100% и уменьшает массу тела. Ускоряет потребление глюкозы клетками, усиливает гликолиз и глюконеогенез, увеличивает скорость абсорбции углеводов из кишечника и стимулирует выделение инсулина. Понижает концентрацию холестерола, фосфолипидов и триглицеридов в плазме, увеличивает концентрацию свободных жирных кислот. Повышает тканевой метаболизм, ускоряет потребление O2 и выделение продуктов обмена, что значительно усиливает кровоток. В соответствии с увеличением кровотока растёт сердечный выброс. Значительно повышает возбудимость и увеличивает ЧСС, но подавляет силу сокращений сердца вследствие усиленного распада белков и экспрессии тяжёлой цепи с более высокой активностью АТФазы миозина. Увеличивает потребление O2 и образование CO2. Эти эффекты активируют все механизмы, повышающие частоту и глубину дыхания. Стимулирует секрецию желудочного сока и моторику ЖКТ. Повышает возбудимость ЦНС, увеличивает реактивность синапсов в спинном мозге, что проявляется лёгким тремором кончиков пальцев с частотой 10–15 в секунду. Увеличивает чувствительность адренорецепторов к норадреналину. Увеличивает секрецию эндокринных желез и повышает потребность тканей в гормонах. Так, увеличение секреции T4 усиливает метаболизм глюкозы во всех тканях организма, соответственно возрастает необходимость в инсулине. Стимулирует остеогенез. Увеличивает скорость инактивации глюкокортикоидов в печени, что — по механизму обратной связи — стимулирует секрецию АКТГ в передней доле гипофиза и глюкокортикоидов в коре надпочечников. Таблица 18–4. Метаболические эффекты йодсодержащих гормонов щитовидной железы
Недостаточная секреция тиреоидных гормонов (табл. 18–4). Снижает на 50% основной обмен, увеличивает массу тела. Повышает концентрацию в плазме холестерола, фосфолипидов и триглицеридов. Уменьшает сердечный выброс. Вызывает сонливость. У мужчин приводит к потере либидо. У женщин нарушается регулярность менструального цикла, возможны интенсивные и частые менструальные кровотечения. Околощитовидные железы Четыре небольшие паращитовидные железы расположены на задней поверхности и под капсулой щитовидной железы. Поскольку паращитовидные железы топографически связаны с щитовидной железой, при хирургической резекции последней существует опасность удаления паращитовидных желёз. При этом развиваются гипокальциемия, тетания, судороги, возможна смерть. При запущенном раке лёгкого возможно поражение опухолевым процессом левого или обоих возвратных гортанных нервов, развивается паралич голосовой связки, приводящий к осиплости или полной потере голоса. Функция околощитовидных желёз — синтез и секреция Са2+-регулирующего пептидного гормона паратиреокрина (ПТГ). ПТГ вместе с кальцитонином и катакальцином щитовидной железы, а также витамином D регулирует обмен кальция и фосфатов. Гормоны В паращитовидной железе синтезируются и секретируются в кровь как паратиреокрин (ПТГ), так и относящийся к ПТГ белок. Эти гормоны кодируют разные гены, но физиологическое значение относящегося к ПТГ белка значительно шире. Паратиреокрин Паратиреокрин (паратирин, паратгормон, гормон паращитовидной железы, паратиреоидный гормон, ПТГ) — полипептид из 84 аминокислотных остатков. Ген PTH кодирует прогормон, процессируемый конвертазой (фурин) до мРНК ПТГ. Известно несколько мутаций гена PTH, приводящих к развитию гипопаратиреоидизма. Регуляторы экспрессии ПТГ [Са2+] сыворотки — главный регулятор секреции ПТГ. Ионы Са2+ взаимодействуют с рецепторами Са2+ (Са2+-сенсор) главных клеток паращитовидных желёз. Гипокальциемия ([Са2+] в крови) усиливает секрецию ПТГ. Гиперкальциемия ([Са2+] в крови) уменьшает секрецию ПТГ. Са2+-сенсор — трансмембранный гликопротеин, обнаруженный в главных клетках околощитовидных желёз, а также в эпителии почечных канальцев. Связывание Са2+ с рецептором стимулирует фосфолипазу C, что приводит к освобождению инозитолтрифосфата и диацилглицерола с последующим выбросом Са2+ из его внутриклеточных депо. Увеличение внутриклеточного [Са2+] активирует протеинкиназу C. Конечный результат — подавление секреции ПТГ. Витамин D — вспомогательный регулятор экспрессии гена ПТГ. Рецепторы витамина D (кальцитриола) относятся к ядерным факторам транскрипции. Связывание комплекса «кальцитриол–рецептор кальцитриола» с ДНК угнетает транскрипцию гена ПТГ. Ионы магния. Пониженное содержание Mg2+ стимулирует секрецию ПТГ, избыток Mg2+ оказывает на неё тормозящий эффект. Секреция ПТГ увеличивается под влиянием активации –адренергических рецепторов и цАМФ. Рецепторы ПТГ — трансмембранные гликопротеины, связанные с G белком — в значительном количестве содержатся в костной ткани (остеобласты) и корковой части почек (эпителий извитых канальцев нефрона). Известно 2 типа рецепторов ПТГ: тип I связывает ПТГ и относящийся к ПТГ белок, тип II — только ПТГ. При связывании лигандов с рецептором в клетках–мишенях происходит не только увеличение внутриклеточного содержания цАМФ, но и активация фосфолипазы C (освобождение инозитолтрифосфата и диацилглицерола, выброс Са2+ из его внутриклеточных депо, активация Са2+–зависимых протеинкиназ). Мутации генов ПТГ–рецепторов, а также мутации генов отдельных субъединиц G белка приводят к развитию разных форм остеодистрофий. Функции. ПТГ поддерживает гомеостаз кальция и фосфатов. ПТГ увеличивает содержание кальция в крови, усиливая резорбцию кости и вымывание кальция из костей, а также усиливая канальцевую реабсорбцию кальция в почках. ПТГ стимулирует образование кальцитриола в почках, кальцитриол же усиливает всасывание кальция и фосфатов в кишечнике. ПТГ уменьшает реабсорбцию фосфатов в канальцах почки и усиливает их вымывание из костей. Гиперфункция паращитовидных желез (гиперпаратиреоз) может быть вызвана развитием в них опухоли. Гиперпаратиреоз характеризуется гиперкальциемией, гипофосфатемией, деминерализацией костей, гиперкальциурией и образованием в почках камней, содержащих кальций. Вторичная гиперфункция паращитовидных желез может возникать при хронических заболеваниях почек и рахите, для которых характерен хронически низкий уровень Ca2+ в плазме. Это обстоятельство по типу обратной связи вызывает стимуляцию паращитовидных желез и приводит к их компенсаторной гипертрофии. Обмен минералов и костная ткань Кости формируют скелет организма, защищают и поддерживают жизненно важные органы, выполняют функцию депо кальция для нужд всего организма. В кости присутствуют две линии клеток — созидающая (остеогенные клетки остеобласты остеоциты) и разрушающая (многоядерные остеокласты). Клетки костной ткани окружает костный матрикс. Различают незрелый (неминерализованный) костный матрикс — остеоид и зрелый (обызвествлённый, или кальцифицированный) костный матрикс Костный матрикс Зрелый костный матрикс составляет 50% сухого веса кости и состоит из неорганической (50%) и органической (25%) частей и воды (25%). Органическая | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
