Справочный материал. Глава 18 – Эндокринная система. Справочный материал по Физиологии. Глава 18 Эндокринная система
 Скачать 0.66 Mb. Скачать 0.66 Mb.
|
|
Глюкокортикоиды Основной естественный глюкокортикоид, секретируемый надпочечниками, — кортизол (объём секреции — от 15 до 20 мг/сут, концентрация кортизола в крови около 12 мкг/100 мл). Для кортизола, а также для регулирующих его синтез и секрецию кортиколиберина и АКТГ характерна выраженная суточная периодичность. При нормальном ритме сна увеличение секреции кортизола наступает после засыпания и достигает максимума при пробуждении. В качестве ЛС в клинической практике обычно применяют синтетические глюкокортикоиды (дексаметазон, преднизолон, метилпреднизон и др.). Химическая структура глюкокортикоидов, дексаметазона и минералокортикоида альдостерона приведена на рис. 18–12. Практически все глюкокортикоиды имеют одновременно и эффекты минералокортикоидов (табл. 18–5). 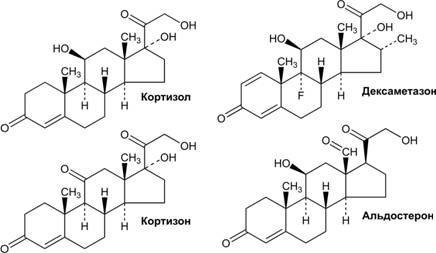 Рис. 18–12. Глюкокортикоиды и минералокортикоиды Таблица 18–5. Относительные глюко- и минералокортикоидные эффекты различных кортикостероидов
Регуляция секреции глюкокортикоидов (рис. 18–13). Активирующие (нисходящие) влияния. Непосредственный активатор синтеза и секреции кортизола — АКТГ. АКТГ выделяется клетками передней доли гипофиза под действием кортиколиберина, поступающего в кровь гипоталамо-гипофизарной воротной системы из гипоталамуса. Стрессовые стимулы активируют всю нисходящую систему влияний, вызывая быстрое выделение кортизола. Кортизол вызывает различные метаболические эффекты, направленные на снятие повреждающей природы состояния стресса. Восходящие (тормозные) влияния по принципу отрицательной обратной связи реализует кортизол, подавляя секрецию АКТГ в передней доле гипофиза и кортиколиберина в гипоталамусе. Это уменьшает концентрацию кортизола в плазме в то время, когда организм не подвергается воздействию стресса. 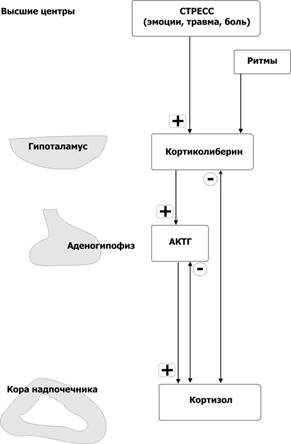 Рис. 18–13. Регуляторные контуры в системе «Гонадолиберин–АКТГ–кортизол». Символами «+» и «-» обозначены стимулирующие и тормозящие влияния. Метаболизм Связанные и свободные формы. Более 90% глюкокортикоидов циркулирует в крови в связи с белками — альбумином и связывающим кортикоиды глобулином (транскортин). Около 4% кортизола плазмы — свободная фракция. Время циркуляции определяется прочностью связывания с транскортином (время полужизни кортизола — до 2 часов, кортикостерона — менее 1 часа). Водорастворимые формы. Модификация липофильного кортизола осуществляется преимущественно в печени, формируются конъюгаты с глюкуронидом и сульфатом. Модифицированные глюкокортикоиды — водорастворимые соединения, способные к экскреции. Экскреция. Конъюгированные формы глюкокортикоидов секретируются с жёлчью в ЖКТ, из них 20% теряется с калом, 80% всасывается в кишечнике. Из крови 70% глюкокортикоидов экскретируется с мочой. Рецептор глюкокортикоидов — ядерный фактор транскрипции — полипептид из семейства онкогенов erb-A, обнаружен практически во всех ядерных клетках. В цитоплазме клетки–мишени рецептор находится в комплексе с молекулярными шаперонами (например, с белком теплового шока hsp90). При связывании кортизола с рецептором молекула шаперона отсоединяется, а комплекс «кортизол–рецептор» перемещается в ядро клетки–мишени. Шаперон (от chaperone — надзирающий спутник) — внутриклеточный белок, осуществляющий правильную пространственную упаковку полипептидов. К шаперонам относятся нуклеоплазмины, шаперонины, белки теплового шока и некоторые другие группы белков. Белки теплового шока (англ. heat shock proteins) — специфические белки, синтезирующиеся при внезапном повышении температуры, гипоксии и других стрессовых для клетки состояниях. Функции этих белков крайне разнообразны. По аутосомно-доминантному типу наследуется несколько мутаций рецептора глюкокортикоидов, приводящих к развитию нечувствительности мишеней к глюкокортикоидам. Функции глюкокортикоидов разнообразны — от регуляции метаболизма до модификации иммунологического и воспалительного ответов. Углеводный обмен. Основные события разворачиваются между скелетными мышцами, жировыми депо организма и печенью. Основные пути метаболизма — стимуляция глюконеогенеза, синтез гликогена и уменьшение потребления глюкозы внутренними органами (кроме головного мозга). Основной эффект — увеличение концентрации глюкозы в крови. Глюконеогенез — синтез глюкозы за счёт аминокислот, лактата и жирных кислот, т.е. неуглеводных субстратов. В скелетных мышцах глюкокортикоиды усиливают распад белков. Образующиеся аминокислоты поступают в печень. В печени глюкокортикоиды стимулируют синтез ключевых ферментов обмена аминокислот — субстратов глюконеогенеза. Синтез гликогена усиливается за счёт активации гликогенсинтетазы. Запасаемый гликоген легко превращается в глюкозу путём гликогенолиза. Липидный обмен. Кортизол увеличивает мобилизацию жирных кислот — источник субстратов для глюконеогенеза. Липолиз усиливается в конечностях. Липогенез усиливается в других частях тела (туловище и лицо). Эти дифференциальные эффекты придают больным (например, при синдроме Кушинга) характерный внешний вид. Синдром Кушинга (гиперкортицизм) возникает в результате значительного повышения содержания глюкокортикоидов в крови. Гипокортицизм. Пониженная секреция адренокортикоидов может быть вызвана первичной надпочечниковой недостаточностью (болезнь Аддисона) или отсутствием стимуляции коры надпочечников АКТГ (вторичная надпочечниковая недостаточность). Аддисонова болезнь — первичная недостаточность надпочечников. Атрофия коры надпочечников, обусловленная аутоиммунным процессом, — наиболее частая причина. Белки и нуклеиновые кислоты Анаболический эффект в печени. Катаболический эффект в других органах (в особенности в скелетных мышцах). Иммунная система. В высоких дозах глюкокортикоиды выступают как иммунодепрессанты (применяют для предупреждения отторжения трансплантированных органов, при тяжёлой псевдопаралитической миастении — myasthenia gravis — результат появления аутоантител к никотиновым рецепторам ацетилхолина). Воспаление. Глюкокортикоиды имеют выраженный противовоспалительный эффект. Синтез коллагена. Глюкокортикоиды при длительном применении ингибируют синтетическую активность фибробластов и остеобластов, в результате развиваются истончение кожи и остеопороз. Скелетные мышцы. Длительное применение глюкокортикоидов поддерживает катаболизм мышц, что приводит к их атрофии и мышечной слабости. Воздухоносные пути. Введение глюкокортикоидов может уменьшить отёк слизистой оболочки, развивающийся, например, при бронхиальной астме. Физиологические реакции органов и систем организма, вызываемые кортизолом, приведены в табл. 18–6. Таблица 18–6. Физиологические реакции на кортизол
Альдостерон Основной минералокортикоид — альдостерон (рис. 18–12). Нормальная концентрация альдостерона в крови около 6 нг на 100 мл, объём секреции — от 150 до 250 мкг/день. Другие стероиды надпочечника, расцениваемые как глюкокортикоиды (кортизол, 11-дезоксикортизол, 11-дезоксикортикостерон, кортикостерон), имеют и минералокортикоидную активность, хотя — сравнительно с альдостероном — их суммарный вклад в минералокортикоидную активность не столь велик. Регуляторы синтеза и секреции (рис. 18–14). 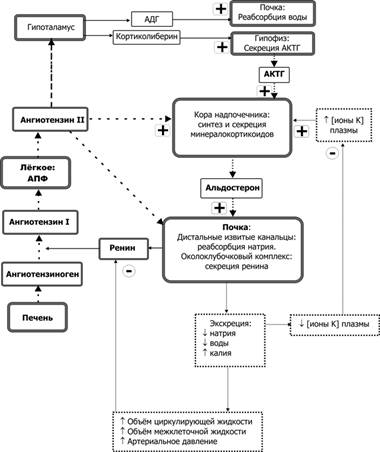 Рис. 18–14. Поддержание баланса электролитов в жидкостях организма. Символами «+» и «-» обозначены стимулирующие и тормозящие влияния. АПФ — ангиотензин-превращающий фермент. Ангиотензин II — компонент ренин-ангиотензиновой системы — главный регулятор синтеза и секреции альдостерона. Этот пептид стимулирует выброс альдостерона. Сердечный натрийуретический фактор (атриопептин) ингибирует синтез альдостерона. Na+. Эффекты гипо- и гипернатриемии реализуются через ренин-ангиотензиновую систему. К+. Эффекты ионов калия не зависят от содержания в крови Na+ и ангиотензина II. Гиперкалиемия стимулирует секрецию альдостерона. Гипокалиемия тормозит секрецию альдостерона. Простагландины E1 и E2 стимулируют синтез альдостерона. F1 и F2 тормозят секрецию минералокортикоидов. Травмы и стрессовые состояния увеличивают секрецию альдостерона за счёт активирующего влияния АКТГ на кору надпочечников. Метаболизм. Альдостерон практически не связывается с белками плазмы крови, по этой причине время его циркуляции в крови (время полужизни) не превышает 15 минут. Альдостерон из крови удаляется печенью, где он трансформируется в экскретируемый почками тетрагидроальдостерон-3-глюкуронид. Рецептор альдостерона — внутриклеточный (ядерный) полипептид — связывает альдостерон и активирует транскрипцию генов, в первую очередь генов Na+,K+ АТФазы и сочетанного трансмембранного переносчика Na+, K+ и Cl–. Рецепторы альдостерона обнаружены в эпителиальных клетках почечных канальцев, слюнных и потовых железах. Высокоаффинный рецептор в системах in vitro также связывает кортизол, но in vivo взаимодействие кортизола и рецептора практически не происходит, так как внутриклеточная 11-гидроксистероид дегидрогеназа превращает кортизол в кортизон, плохо связывающийся с рецептором минералокортикоидов. Следовательно, глюкокортикоид кортизол не проявляет в клетках–мишенях эффекта минералокортикоида. Функция минералокортикоидов — поддержание баланса электролитов в жидкостях организма — осуществляется посредством влияния на реабсорбцию ионов в почечных канальцах (дистальные извитые канальцы и начальный отдел собирательных трубочек). Na+. Альдостерон увеличивает реабсорбцию ионов натрия. Задержка натрия приводит к увеличению содержания воды в организме и повышению АД. К+. Альдостерон увеличивает экскрецию ионов калия. Потеря калия вызывает гипокалиемию. Cl–, HCO3–, Н+. Альдостерон увеличивает реабсорбцию хлора, бикарбоната и почечную экскрецию ионов водорода. Альдостеронизм (гиперальдостеронизм) — гиперсекреция альдостерона. Причины: аденома или двусторонняя гиперплазия коры надпочечников, сердечная недостаточность, нефроз, вызванное диуретиками снижение объёма циркулирующей крови (ОЦК). При альдостеронизме задержка натрия в организме приводит к повышению АД, а потеря калия вызывает гипокалиемию, мышечную слабость, парестезии и тетанию (в тяжёлых случаях). Гипоальдостеронизм — пониженная секреция альдостерона. При гипоальдостеронизме потеря натрия приводит к гиповолемии, снижению сердечного выброса и кровотока в почках, слабости, артериальной гипотензии, а задержка калия ведёт к гиперкалиемии и нарушениям сердечного ритма. Хромаффинная ткань Эндокринную функцию мозговой части надпочечника выполняют происходящие из нервного гребня хромаффинные клетки, формирующие также параганглии (см. рис. 18–9). Мелкие скопления и одиночные хромаффинные клетки находят также в сердце, почках, симпатических ганглиях. Для хромаффинных клеток характерны содержащие либо адреналин (их большинство), либо норадреналин гранулы с электроноплотным содержимым, которое с бихроматом калия даёт хромаффинную реакцию. В гранулах также содержатся АТФ и хромогранины. Катехоловые амины Синтез. Катехоламины синтезируются из тирозина по цепочке: тирозин (превращение тирозина катализирует тирозин гидроксилаза) ДОФА (ДОФА-декарбоксилаза) дофамин (дофамин--гидроксилаза) норадреналин (фенилэтаноламин-N-метилтрансфераза) адреналин. ДОФА (диоксифенилаланин). Эта аминокислота выделена из бобов Vicia faba L, как антипаркинсоническое средство применяется её L-форма — леводопа (L-ДОФА, леводофа, 3-гидрокси-L-тирозин, L-дигидроксифенилаланин). Дофамин — 4-(2-аминоэтил)пирокатехол. Норадреналин [2-амино-1-(3,4-дигидроксифенил)этанол] — деметилированный предшественник адреналина. Фермент синтеза норадреналина (дофамин--гидроксилаза) секретируется из хромаффинных клеток и норадренергических терминалей вместе с норадреналином. Адреналин — l-1-(3,4-дигидроксифенил)-2-(метиламино)этанол — только гуморальный фактор, в синаптической передаче не участвует. Секреция. При активации симпатической нервной системы хромаффинные клетки выбрасывают в кровь катехоловые амины (преимущественно адреналин). Вместе с катехоламинами из гранул выделяются АТФ и белки. Адреналин-содержащие клетки содержат также опиоидные пептиды (энкефалины) и секретируют их вместе с адреналином. Метаболизм адреналина и других биогенных аминов происходит под влиянием катехол-О-метилтрансферазы и моноаминооксидаз. В результате образуются экскретируемые с мочой метанефрины и ванилилминдальная кислота соответственно. Время полураспада катехоламинов в плазме около 2 минут. У здорового мужчины в положении лёжа содержание в крови норадреналина составляет около 1,8 нмоль/л, адреналина — 16 нмоль/л и дофамина — 0,23 нмоль/л. Эффекты. Катехоламины имеют широкий спектр эффектов (воздействие на гликогенолиз, липолиз, глюконеогенез, существенное влияние на сердечно-сосудистую систему). Вазоконстрикция, параметры сокращения сердечной мышцы и другие эффекты катехоловых аминов реализуются через - и –адренергические рецепторы на поверхности клеток–мишеней (ГМК, секреторные клетки, кардиомиоциты). Чрезмерная продукция адреналина (например, при феохромоцитоме) гарантирует развитие артериальной гипертензии. Феохромоцитома — опухоль, состоящая из хромаффинных клеток, синтезирующих катехоламины. Феохромоцитому обнаруживают примерно у 0,5% больных с артериальной гипертензией. Рецепторы катехоловых аминов — адренергические. Адренорецепторы клеток–мишеней (включая синаптические) связывают норадреналин, адреналин и различные адренергические ЛС (активирующие — агонисты, адреномиметики, блокирующие — антагонисты, адреноблокаторы). Адренергические рецепторы подразделяют на - и -подтипы. Среди - и адренорецепторов различают: 1- (например, постсинаптические в симпатическом отделе вегетативной нервной системы), 2- (например, пресинаптические в симпатическом отделе вегетативной нервной системы и постсинаптические в головном мозге), 1- (например, кардиомиоциты), 2- и 3 адренорецепторы. Адренорецепторы связаны с G белком: Все подтипы 2 адренорецепторов активируют аденилатциклазу и увеличивают внутриклеточное содержание цАМФ. 2-Адренорецепторы ингибируют аденилатциклазу и уменьшают внутриклеточное содержание цАМФ. 1-Адренорецепторы активируют фосфолипазу C, что увеличивает (посредством инозитолтрифосфата и диацилглицерола) внутрицитоплазматическое содержание ионов Ca2+. Эффекты, опосредуемые разными подтипами адренергических рецепторов (см. также главу 15). 1 |
