Инъекционные формы. Инъекционные ЛФ - лекции для учащ. Стерилизация. Аппаратура. Выбор метода стерилизации. Стерилизация
 Скачать 163.37 Kb. Скачать 163.37 Kb.
|
|
ИНЪЕКЦИОННЫЕ РАСТВОРЫ. К парентеральным ЛС относятся водные и неводные растворы, суспензии, эмульсии, твёрдые порошки, таблетки, пористые массы, предназначенные для растворения перед введением. К стерильным растворам аптечного производства относят: растворы для инъекций (растворы объемом до 100 мл, пути введения разные, кроме внутривенного капельного), растворы для инфузий (растворы объемом более 100мл, вводятся только внутривенно капельно),глазные капли, офтальмологические р-ры для орошения в микрохирургии глаза, некоторые р-ры для наружного применения (внутриматочные, для инстилляции в мочевой пузырь), р-ры для обработки раневой поверхности и слизистой, р-ры для наружного и внутреннего применения для новорожденных и детей до 1 года. Стерильные растворы должны изготавливаться согласно НД (ГФ РБ, постановление № 35 и др.). В зависимости от природы ЛВ и технологии изготовления стерильные растворы аптечного производства делят на 2 группы: 1) растворы, стерилизующиеся в конечной упаковке 2) растворы, не выдерживающие стерилизацию и изготавливающиеся в асептических условиях на стерильном растворителе. Достоинства: быстрое наступление терапевтического эффекта (1-7 мин) в зависимости от способа введения; 100% биодоступность при внутривенном введении, возможность введения больным в бессознательном состоянии, возможность изготовления в запас. Недостатки: болезненное введение; нарушение целостности кожных покровов; возможность заражения и эмболии (закупорка сосудов); необходимость обученного персонала. ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ К ИНЪЕКЦИОННЫМ РАСТВОРАМ Растворы должны быть стерильными, свободными от механических включений (чистыми), апирогенными, стабильными, прозрачными, выдерживать испытания на токсичность. Стерильностьобеспечивается изготовителем растворов в асептических условиях с последующей стерилизацией. Стерилизовать растворы следует не позднее 3 часов после начала приготовления. Основной метод стерилизации растворов – паровой: приt =120 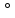 С, Р=1,1 АТ в зависимости от объёма: С, Р=1,1 АТ в зависимости от объёма:до 100 мл – 8 мин 101-500 мл – 12 мин 501-1000 мл – 15 мин Категорически запрещается перестерилизовывать растворы (не соблюдать время стерилизации) и повторная стерилизация. Отсутствие механических включений (чистота), т.е. растворы для инъекций должны быть свободными от механических включений. Под механическими включениями подразумеваются посторонние, подвижные, нерастворимые вещества, кроме пузырьков газа, случайно присутствующие в растворе. Особые требования к чистоте растворов предъявляются из-за возможности эмболии, местных воспалительных реакций и других патологических изменений в сосудах при попадании в них механических частиц. Чтобы освободить раствор от механических включений, его фильтруют. Все изготовленные растворы подвергаются первичному и вторичному контролю на отсутствие механических включений. После изготовления и химического контроля раствор фильтруется через бумажный складчатый стерильный фильтр с подложенным стерильным ватным тампоном. Первые порции раствора фильтруются в подсобную склянку, чтобы промыть фильтр и ватный тампон. Затем фильтрат возвращается на фильтр и р-р фильтруется во флакон для отпуска. Все фильтрующие материалы должны отвечать следующим требованиям: Обеспечивать необходимую степень очистки растворов. Быть биологически безвредными. Быть химически стабильными по отношению к лекарственным веществам и растворителю. Выдерживать термическую стерилизацию. После фильтрования флакон укупоривают резиновой пробкой и рассматривают на спец. приборе «Устройство для контроля растворов на отсутствие механических загрязнений» (УК – 2) на чёрном и белом экране. Флакон плавно переворачивается вверх дном и рассматривается в течении определённого времени невооружённым глазом (при зрении =1,0) на расстоянии 25-30 см. Освещение производится матовой электрической лампочкой в 60 Вт или лампой дневного света 20 Вт. Не должно быть посторонних включений. При обнаружении механических включений раствор повторно фильтруется до отсутствия их. Вторичный контроль осуществляется для 100% флаконов после стерилизации. При обнаружении механических включений растворы бракуются. Апирогенность – растворы для инъекций должны быть апирогенными, т.е. лишёнными пирогенных веществ. Пирогенными называются вещества, вызывающие у больного пирогенные реакции, которые выражаются повышением температуры, лихорадкой, иногда приводят к летальному исходу.………………………………………………………………….. К пирогенным в-вам относятся грамм отрицательные микроорганизмы, погибшие микробные клетки, продукты их жизнедеятельности (токсины), некоторые грибы и вирусы. Если в раствор попали пирогенные вещества, то освободиться от них можно лишь стерилизацией фильтрованием. Т.к. в аптеке практически отсутствует мембранная стерилизация, все усилия должны быть направлены на предотвращение попадания микроорганизмов в растворы: растворы для инъекций готовят в строго асептических условиях, на воде для инъекций апирогенной, используя стерильные флаконы и укупорочный материал, ЛВ марки «Годен для инъекции» либо «Химически чистый», либо «Чистый для анализа», стерильный вспомогательный материал. Приготовленные р-ры не позднее 3 часов подвергают стерилизации. Все эти мероприятия позволяют предотвратить попадание в растворы пирогенных веществ. Стабилизация растворовдля инъекции, т.е. стабильность – это неизменность раствора по составу и своийствам в процессе приготовления, стерилизации, хранения. Существуют физические и химические методы стабилизации: Физические методы: Освобождение воды для инъекции и растворов от кислорода. Очистка ЛВ от примесей путем перекристаллизации Очистка растворов от примесей и пирогенов с помощью сорбентов. Научно-обоснованный выбор фильтрующих материалов. Научно-обоснованный выбор посуды и укупорочных материалов. Применение специальных технологических приёмов (заполнение флакона на 2/3 объёма или под горлышко). Соблюдение режима стерилизации. Химические методы: В водных растворах наблюдается большое разнообразие различных химических процессов, наиболее часто такие как гидролиз и окисление. Гидролиз – реакция ионного обмена между различными веществами и водой. Гидролизу подвергаются соли, эфиры, белки, углеводы, жиры. На степень гидролиза оказывают влияние: 1) Химическая природа соли : гидролизу подвергаются соли, образованные одним или двумя слабыми компонентами. 2) рН среды: изменяя рН можно управлять гидролизом. 3) Температура: при повышенной температуре степень диссоциации воды резко возрастает и возрастает концентрация ионов Н+ и ОН-. 4) Концентрация соли: при разбавлении водой раствора гидролиз усиливается, если один из компонентов соли слабый электролит; если оба слабые, то степень гидролиза от разбавления не зависит. Для предотвращения гидролиза в растворы добавляют стабилизаторы:……………… 1) если соль образована сильным основанием и слабой кислотой, то для подавления гидролиза добавляют 0,1 М растворгидроксида натрия. Объём стабилизатора указан в НД (пост. №35). Например, на 1 л р-ра NaNO2 -2 мл 0,1 М р-р NaOH, на 1 л р-ра кофеина - 4 мл 0,1 М р-р NaOH. Иногда для стабилизации этой группы солей применяют NaHCO3, количество указано в НД. 2) если соли образованы слабым основанием и сильной кислотой, то для подавления гидролиза добавляют 0,1 М раствор кислоты хлористоводородной. Объём р-ра указан в НД. Обычно для создания рН=3,0 – 4,0 достаточно 10 мл 0,1 М р-раHCl на 1 л. 3) если соль образована слабым основанием и слабой кислотой, она имеет нейтральную реакцию среды и стабилизируется ПАВами. В фармации такие соли не используют. 4) если соль образована сильным основанием и сильной кислотой, гидролиза не будет. Стабилизация легко окисляющихся веществ. К легко окисляющимся в-вам относятся вещества, содержащие карбонильные, фенольные, спиртовые, аминогруппы с подвижными атомами Н+. В присутствии которых кислород, содержащийся в воде и над раствором, способствует окислению этих веществ, особенно во время стерилизации. В растворе образуются продукты окисления, обладающие токсическим действием или являющиеся физиологически неактивными. Для стабилизации применяют антиоксиданты, которые делятся на 2 группы: прямые и косвенные. Прямые связывают О2 в растворе и над ним и окисляются легче ЛВ. К ним относятся метабисульфит Na и K, ронголит и др. вещества. Антиоксидант и его количество указаны в НД на раствор. Косвенные антиоксиданты связывают следы тяж. металлов, которые являются катализаторами окислетельно-восстановительных процессов. В их качестве используются: трилон Б, тетацин кальция и др. Они связывают катионы мет. в неактивные по отношению к гидроперекиси комплексы. Если вещество подвергается в растворе гидролизу и окислению, то стабилизируются несколькими стабилизаторами согласно НД. ТИПОВАЯ ТЕХНОЛОГИЧЕСКАЯ СХЕМА ПР-ВА ИНЪЕКЦИОННЫХ РАСТВОРОВ Растворы для инъекции готовятся mV методом. В строго асептических условиях в стерильную колбу отмеривают 1/2 или 1/3 воды для инъекций апирогенной. Растворяют в ней ЛВ. Добавляют стабилизаторы и доводят водой для инъекций до требуемого объёма. 1-2 мл приготовленного раствора передают на полный химический анализ провизору-аналитику. При положительном результате раствор фильтруют через стерильный бумажный складчатый фильтр с подложенным стерильным ватным тампоном. Первые порции фильтруют в подставку, чтобы промыть фильтр, затем фильтрат возвращают на фильтр и фильтруют во флакон для отпуска, если требуется раствор дозируем. Каждый флакон укупоривают резиновой пробкой и проверяют на отсутствие механических включений. 5 флаконов серии подвергают физ. контролю на полноту заполнения. Затем каждый флакон укупоривают металлическим колпачком под обкатку. Проверяют герметичность укупорки (колпачок не должен прокручиваться, а из перевёрнутого флакона не должен вытекать р-р). Маркируют, т.е. на колпачки наносят простым карандашом наименование р-ра, концентрацию, № серии, № анализа. Стерилизуют паровым методом при t =120 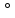 С, в зависимости от объёма. После стерилизации 1 флакон серии подвергается полному хим. анализу; каждый флакон – на отсутствие механических включений. Этикетки: «Для инъекции», «Стерильно», дополнительные «Хранить в прохладном, защищённом от света месте». На этикетке указывается № аптеки, отделения больницы (ФИО больного), состав раствора, его концентрацию, способ применения, № анализа до и после стерилизации, № партии или № рецепта, срок годности, подпись приготовившего, проверившего, отпустившего, дата изготовления. С, в зависимости от объёма. После стерилизации 1 флакон серии подвергается полному хим. анализу; каждый флакон – на отсутствие механических включений. Этикетки: «Для инъекции», «Стерильно», дополнительные «Хранить в прохладном, защищённом от света месте». На этикетке указывается № аптеки, отделения больницы (ФИО больного), состав раствора, его концентрацию, способ применения, № анализа до и после стерилизации, № партии или № рецепта, срок годности, подпись приготовившего, проверившего, отпустившего, дата изготовления.Если р-р готовился без последующей стерилизации, на стерильном растворителе, то этикетки: «Для инъекций», «Приготовлено асептически». На инъекционные растворы вместо ППК заполняется специальный журнал постадийного контроля. Категорически запрещается одновременное изготовление р-ров для инъекций, имеющих разный состав, или р-ров, содержащих одно и тоже в-во, но в разных концентрациях. Растворы для инъекций считаются забракованными, если после стерилизации нарушена гермитичность укупорки, обнаружено несоответствие в объёме, если обнаружены мех. включения и если р-р не соответствует после стерилизации по хим. показателям. Растворы для инъекций не готовят, если отсутствуют данные о технологии изготовления, если не известен режим стерилизации, отсутствуют данные о физико-химической совместимости, отсутствуют методики полного хим. контроля. Стерильные растворы хранятся в соответствии с физико-химическими св-вами и используются в течении установленного срока. По истечении срока годности изымаются. ЧАСТНАЯ ТЕХНОЛОГИЯ Приготовление растворов глюкозы. Основным фактором, определяющим устойчивость раствора глюкозы, является pH среда. При рН 1,0- 3,0 образуется альдегид ( желтоватого цвета), рН 3,0- 5,0 реакция разложения замедляется рН свыше 5,0 разложение усиливается с образованием кислот. Оптимальное значение рН раствора 3,0 – 4,0. Раствор можно готовить с добавлением стабилизатора и без него, в зависимости от рН среды (рН должен указать врач). Без стабилизатора готовят растворы глюкозы 5%, 10%, 20%, 30% с рН=3,8–6,5. Со стабилизатором готовят 5%, 10%, 20%, 25% с рН=3,0–4,1. В качестве стабилизатора используется стабилизатор Вейбеля следующего состава: 5 мл 0,1 М раствора HCl 0,26 мл NaCl воды для инъекций до 1000 мл. Стабилизатор Вейбеляберут 5% от объёма, независимо от концентрации. Согласно постановлению 35 также используется стабилизатор следующего состава NaCl 5,2 Раствор НСl (разв.) 4,4 мл Воды для инъекции до 1 л Стабилизатор расфасовывается по 10-20мл и стерилизуются. Механизм действия стабилизатора: Глюкоза является альдегидоспиртом. В твердом состоянии глюкоза находится в циклической форме, в растворе происходит вскрытие колец с образованием альдегидных групп. При добавлении раствора кислоты хлористоводородной устанавливается равновесие. Альдегидная группа более реакционноспособная, а натрия хлорид образует комплексное соединение с ней и блокирует ее окисление. Для приготовления раствора глюкозы используется глюкоза в виде кристаллогидрата, поэтому делают пересчёт на глюкозу влажную по формуле: …………………….... mкрист. гидр. = mб/вл глюкозы × 100/ 100 – % влаги При стерилизации р-ров глюкозы категорически запрещается их перестерилизовывать, т.к. они желтеют из-за карамелизации глюкозы. Приготовление растворов натрия гидрокарбоната. Готовят растворы без стабилизатора и со стабилизатором. Со стабилизатором – 3%, 4%, 5%, 7%, 8,4%. В качестве стабилизатора используется трилон Б, он связывает примеси Caи Mg. На р-ры в концентрации 3%, 4%, 5% идёт 0,1 мл трилона Б, на р-ры в концентрации 7%, 8,4% – 0,2 мл трилона Б на 1 л р-ра. Без стабилизатора готовят р-р концентрации 3%, 4%, 5%, 7%. Для приготовления используется NaHCO3 марки «Химическичистый» или «Чистый для анализа». Флаконы заполняют на 2/3 объёма, во избежание разрывафлакон укупоривают герметично под обкатку. После стерилизации растворы охлаждают в течении 2 часов, чтобы произошло растворение выделившегося CO2. Через 2 часа растворы передают на повторный химический анализ и оформляют к отпуску. Приготовление растворов натрия хлорида. Для приготовления р-ров натрия хлорида в любой концентрации, а также в том случае, если NaCl входит в состав других растворов, применяется NaCl, подвергнутыйдепирогенизации. Для этого порошок натрия хлорида марки «Годен для инъекций» помещают в открытые стеклянные (фарфоровые) ёмкости слоем не более 6–7 см и стерилизуют воздушнымметодом при t =180 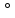 С – 2 ч в сухожировом шкафу. Помешают в стерильный штанглас и используют в течении 24 часов. С – 2 ч в сухожировом шкафу. Помешают в стерильный штанглас и используют в течении 24 часов.Приготовление растворов новокаина. Растворы для инфильтрационной анестезии готовятся в концентрации 0,25%, 0,5%, 1%, 2%. Стабилизируют растворы от гидролиза 0,1 М раствором HCl, т.к. соль образована слабым основанием и сильной кислотой из расчета на 1 литр раствора: 0,25% – 3 мл 0,1 М раствораHCl 0,5% – 4 мл 0,1 М раствораHCl 1% – 9 мл 0,1 М раствораHCl 2% – 12 мл 0,1 М раствораHCl Для спинно-мозговой анестезии готовят растворы новокаина 5% без добавления стабилизатора (раствор кислоты хлористоводородной при введении в спинномозговой канал раздражает нервные окончания) и соответственно не стерилизуется. Поэтому раствор готовится на стерильной воде для инъекций с использованием порошка новокаина, подвергнутого депирогеннизации воздушным методом при t=120 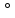 С, слоем 0,5–2 см в течении 2 часов. С, слоем 0,5–2 см в течении 2 часов.Раствор новокаина для анестезии слизистых готовятся 2%, 5%, 10% и стабилизируется от гидролиза и окисления. От гидролиза на 1 л раствора используют 0,1 М раствор кислоты хлористоводородной в зависимости от концентрации: для 2% – 4 мл 5% – 6 мл 10% – 8 мл От окисления 0,5 Na2S2O3 независимо от концентрации. Приготовление растворовгексаметилентетрамина. Гексаметилентетрамин является само стерилизующим веществом, его растворы обладают бактерицидным действием. Поэтому растворы гексаметилентетрамина готовятся в асептических условиях на стерильной воде для инъекций. С указанием на этикетке «Приготовлено асептически». Приготовление масляного раствора камфары стерильного. Готовят 20% раствор на персиковом масле. В части теплого масла растворяют камфару, фильтруют через сухой фильтр в сухую мерную колбу и доводят маслом до метки. Переливают во флакон и стерилизуют текучим паром 6минут при 100С. ИЗОТОНИЧЕСКИЕ РАСТВОРЫ. Плазма крови, лимфа, слёзная жидкость, спинно-мозговая жидкость имеют постоянное осмотическое давление (7,4 атм), которое поддерживается специальными осморегуляторами. Введение в организм больших количеств инъекционных р-ров с другим осматическим давлением может привести к сдвигу физиологического равновесия, которое сопровождается болевыми ощущениями, и может привести к тяжёлым последствиям.В организм следует вводить инъекционные растворы с осмотическим давлением равным осмотическому давлению жидкости организма (7,4 атм) – такие растворы являются изотоническими. Т.е. изотонические растворы –это растворы, у которых осмотическое давление равно осмотическому давлению плазмы крови (7,4 атм.). Кроме, изотонических растворов существуют гипотонические и гипертонические растворы. Растворы, имеющие осмотическое давление ˃7,4атм – гипертонические. При введении в кровь возникает разность осмотического давления внутри эритроцитов и в окружающей их плазме, жидкость из эритроцитов направляется в плазму, при этом происходит сморщивание эритроцитов – такое явление называется плазмолиз. Растворы, имеющие осмотическое давление ˂ 7,4 атм – гипотонические. При введении их в кровь также возникает разность давлений и жидкость пойдет внутрь эритроцита, эритроциты разбухают и лопаются, клетки гибнут – такое явление называется гемолизэритроцитов (лизис). |
