Химия. Лекция_начало-2. Техника лабораторных работ химические реактивы
 Скачать 316.04 Kb. Скачать 316.04 Kb.
|
|
ТЕМА 3. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ НЕОРГАНИЧЕСКОГО СИНТЕЗА Химическим синтезом называют совокупность последовательных операций, приводящих к получению нового химического вещества. Химический синтез решает три основные задачи: Получение известных веществ по известным методикам. Получение известных веществ с определенной заданной морфологией (высокодисперсных порошков, пленок, монокристаллов и др.). Получение новых, ранее неизвестных веществ. В начале знакомства с химическим экспериментом ставится задача получения известных веществ по известным методикам, овладение навыками выполнения основных операций. Методы синтеза неорганических соединений классифицируются по следующим признакам: по классам синтезируемых соединений (синтез оксидов, гидроксидов, кислот, солей и др.); по типам химических реакций, используемых в синтезе (гидрирование, гидролиз и др.); по агрегатному состоянию реагентов (синтез в газовой, жидкой и твердой фазах); по характеру используемой аппаратуры (синтез в вакууме, синтез под давлением, лазерный, ультразвуковой и др.); по количеству используемых реагентов (макро-, полумикро-, микросинтез). Ни одна из этих классификаций не является полной и не охватывает всё разнообразие методов синтеза неорганических веществ. Основными требования к реакциям синтеза являются: безопасность для здоровья человека; устойчивость реагентов и продуктов; невысокая стоимость реагентов и оборудования; возможность анализа полученного вещества; доступность очистки полученного вещества. Невозможно привести универсальную методику синтеза, для каждого индивидуального вещества необходим свой подход. Познакомимся с проведением синтеза веществ в различных условиях. 3.1. РЕАКЦИИ В ВОДНОМ РАСТВОРЕ Для синтеза веществ в учебной лаборатории получение веществ в водном растворе представляет особый интерес, поскольку реакции в водном растворе протекают с большой скоростью, а методики синтеза достаточно просты и удобны. Для получения веществ в растворе могут быть использованы реакции различного типа: окислительно-восстановительные реакции, реакции ионного обмена, реакции комплексообразования. Взаимодействие в растворе позволяет обеспечить равномерное распределение вещества по всему объему раствора, высокую степень его диспергирования и высокую скорость диффузии реагентов, следовательно, большую скорость протекания химического взаимодействия. Скорость таких реакций мало зависит от температуры, они идут достаточно быстро уже при комнатной температуре. Однако скорость окислительно-восстановительных реакций и реакций с участием труднорастворимых веществ повышается при увеличении температуры. 3.2. РЕАКЦИИ В ТВЕРДОЙ ФАЗЕ Реакции с участием твердых веществ разнообразны по типам и условиям их проведения: реакции образования твердого вещества в растворе; реакции взаимодействия между твердым и растворенным веществом; реакции твердого и газообразного вещества; взаимодействие двух или нескольких твердых веществ; реакции разложения (термолиза) твердых веществ. В твердой фазе протекают реакции взаимодействия двух или нескольких твердых веществ и реакции термолиза, например: Типичная особенность твердофазных реакций - протекание на границе раздела фаз, то есть на поверхности твердых частиц. Скорость твердофазных реакций зависит от многих факторов: температуры, структуры и дефектности кристалла, гомогенности реакционной смеси, скорости подвода реагентов к зоне реакции и скорости отвода продуктов. Применительно к задачам синтеза веществ наибольший интерес вызывают реакции, ведущие к образованию одного продукта, в противном случае возникает проблема разделения твердых продуктов синтеза. Среди реакций взаимодействия твердых веществ особо выделяют реакции с высоким экзотермическим эффектом. Примером таких реакций является металлотермия, например: Нагрев необходим лишь для инициирования реакции, далее она протекает с высокой скоростью и выделением большого количества тепла. В неорганическом синтезе для получения твердых веществ (оксидов, чистых металлов) широко применяются реакции термического разложения некоторых гидроксидов и солей, например: 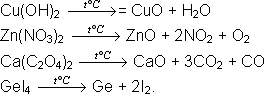 При использовании данных реакций процесс идет с большой скоростью практически до конца и образуется чистый основной продукт, так как побочные продукты при высоких температурах газообразные и покидают сферу реакции. 3.3. РЕАКЦИИ С УЧАСТИЕМ ГАЗОВ Проведение реакций с участием газов связано с определенными трудностями. Они связаны с необходимостью проводить синтез при высоких скоростях реакции, обеспечивать контролируемую подачу и отвод газа, работать с газовыми баллонами, регулировать давление в системе. Поэтому реакции типа "газ - газ" в учебной лаборатории не проводятся, используются реакции взаимодействия газов с растворами или твердыми веществами. Наиболее употребляемы реакции окисления металлов кислородом воздуха и реакции восстановления металлов из оксидов водородом. Реакция восстановления водородом также может быть использована для получения безводных хлоридов металлов в более низких степенях окисления, например: хлорида хрома (II), хлорида железа (II) и хлоридов этих металлов в более высоких степенях окисления. Практическое значение в синтезе с участием газообразных веществ находят химические транспортные реакции. В ходе этих реакций образуются промежуточные летучие продукты, которые в токе исходного или специально вводимого в систему газа-носителя можно транспортировать в реакционную зону с иными температурой и давлением. Например: Приведенная реакция используется для очистки металлического никеля от примесей. Роль газа-носителя выполняет монооксид углерода. По внешним признакам транспортные реакции похожи на процесс сублимации. Перенос вещества при химической транспортной реакции имеет место, если: в реакции участвуют твердое и газообразное вещество (газ выступает в роли газа-носителя для продукта); продукт взаимодействия нелетучих исходных веществ летуч и может переноситься специально вводимым в систему газом-носителем; продукт нелетуч, но легко переводится в промежуточное летучее вещество, которое после переноса способно к превращению с образованием нужного продукта. Особое значение в химических транспортных реакциях имеет градиент температур, поскольку вывод из сферы реакции и формирование продукта на конечной стадии достигаются при разных температурах. Примером химической транспортной реакции служит реакция получения крупнокристаллического сульфида цинка, протекающая через следующие стадии: Исходные вещества - твердые цинк и сера, в роли газа-носителя выступает азот, промежуточные продукты - йодид цинка и сера - летучи в токе азота, а выделяющийся на последней стадии йод уносится током газа. Температура 750oС на последней стадии обеспечивает условия не только для превращения, но и для образования крупных кристаллов сульфида цинка. ТЕМА 4. МЕТОДИКИ СИНТЕЗА НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ 4.1. СОЕДИНЕНИЯ S-ЭЛЕМЕНТОВ Хлорид лития LiCl Необходимые реактивы: карбонат лития Необходимое оборудование: фарфоровые чашки (2 шт.), воронка, штатив с кольцом, эксикатор, фильтровальная бумага. Методика синтеза: Карбонат лития растворяют в фарфоровой чашке в 20 - 25%-ной соляной кислоте, взятой с небольшим недостатком: Раствор нагревают и отфильтровывают от карбоната и других примесей в другую фарфоровую чашку. Фильтрат подкисляют и помещают в эксикатор над серной кислотой. Эксикатор охлаждают до 10 - 15oС, но не выше 16,2oС. После испарения части воды выпадают кристаллы При выпаривании раствора (не выше 90oС) и охлаждении (не ниже 25oС) выпадает моногидрат При выпаривании раствора в пределах 102 - 160oС выпадает безводная соль. Свойства вещества: Хлорид лития - белый мелкокристаллический порошок, на воздухе расплывается. Хранить можно только в хорошо закрытой склянке. Дигидратация происходит по схеме: Температура плавления безводного хлорида лития 610 oС, температура кипения - 1382oС. Идентификация: Качественная реакция на ион лития: Качественная реакция на хлорид-ион: 4.2. СОЕДИНЕНИЯ P-ЭЛЕМЕНТОВ Иодноватая кислота Необходимые реактивы: кристаллический йод Необходимое оборудование: химический стакан на 250 мл, мерный цилиндр на 50 мл, круглодонная колба, водяная баня, фарфоровая чашка. Методика синтеза: Вносят в термостойкий химический стакан 10,00 г иода Раствор упаривают досуха, не допуская перегрева, трижды внося добавочные порции воды (по 5 мл) и повторно упаривая смесь досуха. Сухой остаток, не охлаждая, обрабатывают концентрированной азотной кислотой (20 мл), а затем быстро охлаждают смесь льдом. Выпавшие кристаллы отделяют от маточного раствора декантацией, переносят в фарфоровую чашку и высушивают в сушильном шкафу при 30 - 40oС. Свойства вещества: Йодноватая кислота - бесцветные кристаллы, обладающие светочувствительностью; при получении на свету кристаллы желтоватые (слегка окрашенные примесью йода); температура разложения 110oС. Идентификация: Качественная реакция на йодат-ион: 4.3. СОЕДИНЕНИЯ D-ЭЛЕМЕНТОВ Оксид меди (I) Необходимые реактивы: пентагидрат сульфата меди (II) Необходимое оборудование: химический стакан на 250 мл (3 шт.), электрическая плитка, асбестовая сетка, термометр, колба Бунзена, воронка Бюхнера, водоструйный насос, фильтровальная бумага. Методика синтеза: Растворяют в термостойком химическом стакане при умеренном нагревании 19,00 г пентагидрата сульфата меди (II) Готовят раствор, содержащий 12,00 г гидроксида натрия и 30 мл воды. Нагревают приготовленный ранее раствор сульфата меди (II) с добавкой глюкозы до 35oС и вносят в него при перемешивании раствор гидроксида натрия. Реакционную смесь оставляют на 1 час. Наблюдается выделение осадка красного цвета: После отстаивания осадка раствор над ним должен быть бесцветным. Осадок промывают горячей водой декантацией до отсутствия в промывной жидкости сульфат-ионов. Затем отделяют осадок от раствора вакуумным фильтрованием и высушивают на воздухе. Свойства вещества: Оксид меди (I) - красное кристаллическое вещество, температура плавления 1229 oС, выше 1800oС разлагается. Идентификация: В водных растворах аммиака растворяется, образуя гидроксид диамминмеди (I): В соляной кислоте растворяется с образованием дихлорокупрата (I) водорода: ЛИТЕРАТУРА Анорганикум: в 2 т. / Под ред. Л.М. Кольдица. - М.: Мир, 1984. Воскресенский П.И. Техника лабораторных работ. - М.: Химия, 1966. Ключников Н.Г. Неорганический синтез. - М.: Просвещение, 1983. Практикум по неорганической химии. / Под ред. Ю.Д. Третьякова. - М.: Академия, 2004. Руководство по неорганическому синтезу: в 6 т. / Под ред. Г.М. Брауэра. - М.: Мир, 1994. Свиридов В.В., Попкович Г.А., Василевская Е.И. Неорганический синтез. - Минск, Унiверсiтэцкаэ, 2000. Химическая энциклопедия: в 5 т. - М.: БРЭ, 1988-1998. [Электронный ресурс]: Режим доступа: www.alchimik.ru/kunst/synt, свободный. |
