Айдар. Технологическая часть 4 1 фса описание процесса приема серной кислоты 4
 Скачать 148.72 Kb. Скачать 148.72 Kb.
|
СодержаниеВведение 2 Глава 1. Технологическая часть 4 1.1 ФСА описание процесса приема серной кислоты 4 1.2 Характеристика общехозяйственной вентиляционной вытяжки 6 1.3 Особенности устройств систем вентиляции 12 Глава 2. Техническая часть 17 2.1 Технология вентиляционных устройств и оборудования 17 2.2 Вредные и опасные свойства производимой продукции 24 2.3 Воздухообмен и расчеты вентиляции 26 2.4 Определение количества и площади сечения вытяжных и приточных каналов 30 Заключение 35 Список использованных источников 36 ВведениеВ нефтехимической промышленности комплексной механизации и автоматизации уделяется большое внимание. Это объясняется сложностью и высокой скоростью протекания технологических процессов, а также чувствительностью их к нарушению режима, вредностью условий работы, взрыво- и пожароопасностью перерабатываемых веществ и т. д. Автоматизация приводит к улучшению основных показателей эффективности производства: увеличение количества, улучшению качества и снижению себестоимости выпускаемой продукции, повышению производительности труда. Внедрение автоматических устройств обеспечивает высокое качество продукции, сокращения брака и отходов, уменьшение затрат сырья и энергии, уменьшение численности основных рабочих, снижение капитальных затрат на строительство зданий, производство организуется под открытым небом, удлинение сроков межремонтного пробега оборудования. Работа предусматривает разработку общеобменной вентиляционной системы реагентного хозяйства на «Приволжском заводе химических реагентов» город Казань. Проведение некоторых современных технологических процессов возможно только при условии их полной автоматизации (например, процессы, осуществляемые на атомных установках и в паровых котлах высокого давления, процессы дегидрирования и д. р.). При ручном управлении такими процессами малейшее замешательство человека и несвоевременное воздействие его на процесс могут привести к серьёзным последствиям. Комплексная автоматизация процессов (аппаратов) химической технологии предполагает не только автоматическое обеспечение нормального хода этих процессов с использованием различных автоматических устройств (контроля, регулирования, сигнализации и д. р.), но и автоматическое управление пуском и остановкой аппаратов для ремонтных работ и в критических ситуациях. В автоматизированном производстве человек переключается на творческую работу – анализ результатов управления, составление заданий и программ для автоматических устройств и т. д. Для обслуживания агрегатов, оснащенных сложными системами автоматизации, требуются специалисты с высоким уровнем знаний. Задачи, которые решаются при автоматизации современных химических производств, весьма сложны. От специалистов требуются знания не только устройства различных приборов, но и общих принципов составления систем автоматического управления. Развитие химической технологии потребовало создания гораздо более современных систем управления, чем локальные системы автоматизации. Эти принципиально новые системы получили название автоматизированных систем управления технологическими процессами (АСУТП). Создание АСУТП, необходимость в которых была вызвана объективными потребностями развития промышленности, стало возможно благодаря внедрению отечественных ЭВМ второго поколения, увеличение вычислительных ресурсов и повышение надёжности ЭВМ позволило использовать их для управления технологическими процессами в «реальном» времени. АСУТП отличается от локальных систем автоматизации более совершенной организацией потоков информации; практически полной автоматизацией процессов получения, обработки и представления информации; возможностью активного диалога оперативного персонала с ЭВМ в процессе управления для выработки наиболее эффективных решений; более высокой степенью автоматизации функций управления, включая пуск и остановку производства. В настоящее время переход к более полной автоматизации тормозится несовершенством технологических процессов, недостаточной надежностью средств автоматизации и вычислительной техники, трудностями математического описания задач, решаемых человеком в АСУТП, и другими причинами. Глава 1. Технологическая часть1.1 ФСА описание процесса приема серной кислотыНесмотря на то, что серная кислота давно известна, вначале её получали сухой перегонкой - термическим разложением купоросов, поэтому упоминается под названием «купоросное масло», в промышленных количествах она стала производиться относительно недавно. Сырьём для её получения служат элементарная сера, сульфиды и сульфаты металлов, сероводород, отходящие газы теплоэлектростанций, использующих неочищенную нефть, и др. Основным сырьём некогда являлся пирит. Так, в 1958 году в СССР из пирита было выработано 71,4 процента серной кислоты, произведённой за этот год. Однако уже к 1970 году доля пирита в производстве серной кислоты в СССР снизилась до 41,8 процента[1]. В последнее время основным сырьём производства серной кислоты является сера. Так, в 2011 году в России из общего количества в 10,7 млн тонн произведённой серной кислоты 7,9 млн тонн получено из серы и 2,8 млн тонн — из отходящих газов и в результате нефтепереработки. В мире в 2011 году из общего количества в 223 млн тонн произведённой серной кислоты 136 млн тонн получено из серы, 67 млн тонн — из отходящих газов и 20 млн тонн — из пирита. Лидером по производству серной кислоты в мире на 2011 год являлась КНР — 74 млн тонн в год[2]. Основные стадии получения серной кислоты включают: 1) Сжигание или обжиг сырья в кислороде с получением SO2 2) Очистка от примесей газа 3) Окисление SO2 в SO3 4) Абсорбция SO3 водой. C 14 века серную кислоту получали так называемым «камерным» методом, в основе которого лежала реакция горения на воздухе смеси серы и калийной селитры, описанной алхимиком Валентином. Процесс проводился в камерах, обитых свинцом, нерастворимых в серной кислоте. Продуктами горения являлись оксиды азота, соли калия и SO3. Последний поглощался водой, находящейся в камере. Таким способом удавалось получить кислоту небольшой крепости, которую концентрировали известными методами. В зависимости от соотношения реагентов получался разный состав твердого остатка. Одна из схем получения камерной серной кислоты, наиболее полно расходующая нитрат калия:  В настоящее время в промышленности применяют два метода окисления диоксида серы в производстве серной кислоты: контактный — с использованием твердых катализаторов, и нитрозный (башенный), в котором в качестве катализатора используют оксиды азота. В качестве окислителя обычно используют кислород. В первом способе реакционная смесь пропускается сквозь слой твердого катализатора, во втором орошается водой или разбавленной серной кислотой в реакторах башенного типа. Вследствие высокой эффективности (производительность, компактность, чистота и стоимость продукта и др.) контактный способ вытесняет нитрозный. Обнаружены сотни веществ, ускоряющих окисление SO2 до SO3, три лучших из них в порядке уменьшения активности: платина, оксид ванадия(V) V2O5 и оксид железа Fe2O3. При этом платина отличается дороговизной и легко отравляется примесями, содержащимися в газе SO2, особенно мышьяком. Оксид железа (III) требует высоких температур для проявления каталитической активности (выше 625 °C). Таким образом, ванадиевый катализатор является наиболее экономичным, и только он применяется при производстве серной кислоты. Ниже приведены реакции по производству серной кислоты из минерала пирита на катализаторе — оксиде ванадия (V): 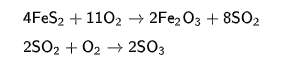 {\displaystyle {\mathsf {4FeS_{2}+11O_{2}\rightarrow 2Fe_{2}O_{3}+8SO_{2}}}} {\displaystyle {\mathsf {4FeS_{2}+11O_{2}\rightarrow 2Fe_{2}O_{3}+8SO_{2}}}} {\displaystyle {\mathsf {2SO_{2}+O_{2}\rightarrow 2SO_{3}}}} {\displaystyle {\mathsf {2SO_{2}+O_{2}\rightarrow 2SO_{3}}}} Нитрозный метод получения серной кислоты:  {\displaystyle {\mathsf {SO_{2}+NO_{2}\rightarrow SO_{3}+NO}}}{\displaystyle {\mathsf {2NO+O_{2}\rightarrow 2NO_{2}}}} {\displaystyle {\mathsf {SO_{2}+NO_{2}\rightarrow SO_{3}+NO}}}{\displaystyle {\mathsf {2NO+O_{2}\rightarrow 2NO_{2}}}} При реакции SO3 с водой выделяется огромное количество теплоты, и серная кислота начинает закипать с образованием трудноулавливаемой аэрозоли (сернокислый туман):  Поэтому SO3 смешивают с концентрированной серной кислотой, получая олеум, который далее разбавляется до нужной концентрации. Промышленные количества камерной серной кислоты получали вначале во Франции, потом в Англии. В СССР камерный способ просуществовал до 1955 г. После обнаружения каталитической роли оксидов азота в реакции образования SO3 от камерного способа стали отказываться в пользу других методов, использующих менее трудоемкий способ получения и окисления SO2. |
