|
|
ФХ экз. Теоретические экз вопросы по фх
Теоретические экз вопросы по фх
1. Общая характеристика и классификация природных и синтетических гормонов. Общие методы получения и фармакопейного анализа гормонов.
Гормоны - продукты функциональной активности эндокринных желез.
К гормональным препаратам относятся ЛС, содержащие БАВ- гормоны, и препараты, обладающие физиологической активностью гормонов.
Гормоны участвуют в гуморальной регуляции разнообразных функций организма, являясь активаторами процессов метаболизма.
Гормоны как активаторы и ингибиторы физиологических процессов применяют в ветеринарной практике при гипер - и гипофункциональных состояниях эндокринных желез, при болезнях неэндокринной этиологии.
Основной источник гормонов в организме - железы внутренней секреции: гипоталамус, гипофиз, щитовидная железа, тимус, паращитовидные железы, надпочечники, поджелудочная железа, тестикулы и яичники.
При дефиците естественных гормонов широко используют их синтетические аналоги, а также экстракты или специально обработанные ткани эндокринных желез убойного скота, содержащие преимущественно комплекс естественных гормонов.
Классификация гормонов (по химической структуре (по производным):
1. Простые белки и пептиды - препараты гормонов гипофиза, поджелудочной, щитовидной и паращитовидной желез;
2. Сложные белки - гормоны передней доли гипофиза;
3. Катехоламины и пирокатехины - гормоны мозгового слоя надпочечников;
4. Стероиды - гормоны коры надпочечников, мужских и женских половых желез и желтого тела;
5. Жирные кислоты - простогландины - биогенные активные вещества органов и тканей.
По способу получения все гормоны подразделяют на несколько групп:
экстрактивные - получают извлечением из эндокринных желез, крови, мочи и др.;
синтетические - аналоги экстрактивных препаратов;
синтетические - неидентичные (отлич. по химической структуре);
растительные гормоны (клевера, хмеля, кукурузы, подсолнечника и др.).
Классификация в зависимости от желез которыми вырабатываются:
гормоны гипофиза;
поджелудочной железы;
надпочечников;
щитовидной и паращитовидной желез;
половые.
Получение
В настоящее время разработаны методики химического синтеза многих непептидных и низкомолекулярных пептидных гормонов. Полипептидные и белковые гормоны выделяют путем экстракции из эндокринных желез крупного рогатого скота. Разработана методика получения некоторых гормонов (в том числе инсулина и гормона роста), основанная на принципах генной инженерии. Для этого ген, ответственный за синтез того или иного гормона, включают в геном бактерий, которые после этого приобретают способность синтезировать данный гормон. Так как бактерии активно размножаются, за короткое время оказывается возможным наработать довольно значительные количества нужного гормона.
Гормоны широко используются при заболеваниях, связанных с нарушениями эндокринной системы: при недостатке или отсутствии в организме того или иного гормона (например, инсулина); для усиления или подавления функции той или иной железы. Гормоны нашли широкое применение в акушерстве и гинекологии, например, окситоцин используется для усиления родовой деятельности. Стероидные половые гормоны или их аналоги применяют при нарушениях в половой сфере, в качестве противозачаточных средств и т. д. При воспалительных процессах, аллергических заболеваниях, ревматоидном артрите и ряде других заболеваний используются гормоны коры надпочечников.
Про методы анализа можно лить воду
Фармакопейный анализ лекарственных средств включает в себя оценку качества по множеству показателей. В частности, устанавливается подлинность лекарственного средства, анализируется его чистота, производится количественное определение. Первоночально для такого анализа применяли исключительно химические методы: реакции подлинности, реакции на содержание примесей и титрование при количественном определении.
Широко применяются спектральные методы: ИК, УФ и др. Активно используются методы хроматографии, электрофорез и др.
Химические и физико-химические методы основаны на использовании реакций, с помощью которых выявляют и учитывают особенности их химической структуры. Очень часто определение содержания гормонов возможно лишь после их предварительного извлечения и очистки, которые достигаются экстракцией, ультрацентрифугированием, хроматографией, осаждением белков и т. д. Для разделения смеси белковых гормонов часто применяют электрофорез в полиакриламидном геле. Под действием электрического поля заряженные молекулы гормонов перемещаются в геле. При этом поры геля выполняют функцию «молекулярного сита».
Эффективным методом очистки белковых и пептидных гормонов является ионно-обменная хроматография с применением специальных смол и других компонентов. Для разделения катехоламинов и стероидных гормонов применяют адсорбционную (молекулярную) колоночную хроматографию. Для количественного анализа стероидных гормонов применяют газожидкостную хроматографию. Через колонку газового хроматографа, заполненную гранулами адсорбента с растворителем, с помощью газа-носителя (аргон, водород, азот) продувают нагретую в испарительной камере исследуемую смесь. Выход гормонов из колонки в потоке газа регистрируется детектором. Для газо-жидкостной хроматохрафии требуется предварительная очистка экстрактов стероидов и их разделение с помощью тонкослойной и других видов хроматографии.
Значительная часть химических методов основана на применении колориметрического и флюоресцентного анализов, которые особенно широко используются для определения содержания стероидов. Поглощение света растворами исследуемых гормонов находится в прямой зависимости от их концентрации. Чувствительность флюориметрических методов определения гормонов в 10—20 раз выше чувствительности спектрофотометрии.
Иммунологические методы основаны на способности белковых и полипептидных гормонов индуцировать выработку антител при гетероиммунизации. Для иммунологического тестирования гормонов применяют реакции связывания комплемента, преципитации и торможения пассивной гемагглютинации. В связи с наличием иммунологической специфичности белковых гормонов иммунологические методы, разработанные для гормонов одного вида животных, как правило, не могут использоваться для определения тех же гормонов у других видов животных.
2. Гормоны щитовидной железы. Основные представители. Биологическая роль. Йодированные производные ароматических аминокислот (гормоны щитовидной железы): тироксин, трийодтиронин. Комплексный препарат – тиреоидин. Антитиреоидные средства: дийодтирозин. Получение. Полный фармакопейный анализ.
Тироксин был выделен из щит. желез скота; трийодтиронин – из крови человека и щит. желез скота. Тиреоидин получают измельчением обезжиренных и высушенных щит. желез убойного скота; он содержит l-тироксин и l-3,5,3`-трийодтиронин.
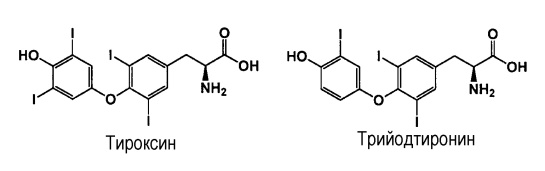 Вещества относятся к йодированным производным арилалифатических аминокислот. Тиреоидин – антигипотиреоидное средство. Применяют при гипофункции ЩЖ (заболевания микседема, гипотиреоз, кретинизм, ожирение, эндемический зоб). Вещества относятся к йодированным производным арилалифатических аминокислот. Тиреоидин – антигипотиреоидное средство. Применяют при гипофункции ЩЖ (заболевания микседема, гипотиреоз, кретинизм, ожирение, эндемический зоб).
Описание: тиреоидин - желтовато-серый порошок со слабым запахом, характерным для высушенных животных тканей. Не растворим в воде, спирте и др. растворителях.
Подлинность. 1) Обнаружение белка: ЛП нагревают до кипения с р-ром NaOH – р-р окрашивается в желтый цвет; при последующем прибавлении разв. H2SO4 р-р обесцвечивается и выделяется белый коллоидный осадок.
2) Обнаруж. органически связ-го йода: ЛП разрушают прокаливанием со смесью KNO3 и NaCO3 до обугливания. Остаток растворяют в воде и фильтруют (извлекают йод). Фильтрат подкисляют, йодиды обнаруживают реакцией окисления хлорной водой или хлорамином. Выделившийся йод извлекают хлороформом, который окраш-ся в красно-фиолетовый цвет: 2HJ+Cl2=J2+2HCl, либо
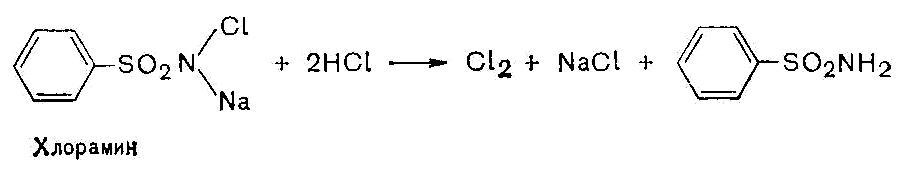 (только вместо HCl – HJ, реакция такая же) (только вместо HCl – HJ, реакция такая же)
Также йод качественно и количественно определяют методом сжигания в колбе с О2.
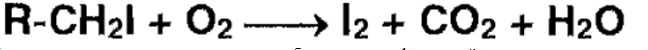
Поглощающая жидкость – р-р крахмала с добавлением сульфаминовой кислоты, которая связывает нитриты (образуются при горении белковой части молекулы): HNO2+NH2SO3H=N2+H2SO4+H2O
А выделяющийся йод при горении окрашивает крахмальный р-р в синий цвет.
3) Возможно, можно определить OH группу в реакции с FeCl3 (окрашивание), а также карбоксильную группу в реакции этерификации со спиртом (запах), или первичную аминогруппу (аминокислота) в реакции с нингидрином (окрашивание), но это нигде не указано.
С нингидрином (сокращенная): 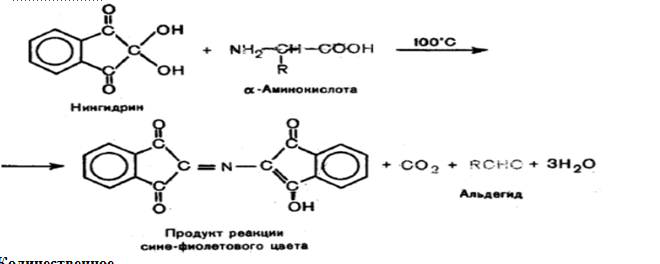
Количественное.
1 способ. Йод после сжигания (реакция с О2 выше) поглощают р-ром NaOH: J2+2NaOH=NaJ+NaJO+H2O
Далее добавляют уксус. ледяную к-ту, которая содержит Br2 – для окисления йодида и гипойодида до йодата:
NaJ+NaIO+5H2O+5Br2=2NaIO3+10HBr. Избыток Br удаляют муравьиной к-той: Br2+HCOOH=2HBr+CO2 (до обесцвечивания).
После связывания нитритов (р-ция с сульфаминовой к-той выше), добавляют H2SO4 и избыток KJ: 2NaJO3+10KJ+6H2SO4=6J2+Na2SO4+5K2SO4+6H2O, и йод оттитровывают р-ром тиосульфата: J2+2Na2S2O3=2NaJ+Na2S4O6
2 способ – восстановительный метод минерализации и выделения йода. ЛП кипятят в р-ре щелочи с Zn. Йод определяют аргентометрически.
3 способ – окислительный. ЛП кипятят с KMnO4 и H2SO4, йод окисляется до йодата: ЛП+KMnO4=KIO3+… Избыток KMnO4 удаляют: 2KMnO4+5NaNO2+3H2SO4=2MnSO4+K2SO4+5NaNO3+3H2O. Избыток NaNO2 удаляют мочевиной: 2NaNO2+H2N-CO-NH2+H2SO4=2N2+CO2+Na2SO4+3H2O.
Затем добавляют KI и образовавшийся йод оттитровывают р-ром Na2S2O3: KIO3+5KI+3H2SO4=3J2+3K2SO4+3H2O
1 мл 0,01 н. раствора тиосульфата натрия соответствует 0,0002115 г I, которого в препарате должно быть 0,17-0,23% (расчеты не известны).
Примеси
Йодиды. По реакции с хлорамином без предварительной минерализации. Хлороформный слой не должен окрашиваться в красно-фиолетовый цвет. Следовательно, свободный йод должен отсутствовать, примесь недопустимая.
Жир. ЛП экстрагируют эфиром в экстракционном аппарате до полного обезжиривания. Эфир отгоняют и остаток высушивают в вакуум-эксикаторе над прокаленным хлоридом кальция до постоянного веса. Содержание жира не более 2%. Примесь допустимая, специфическая, в проц. получения веществ.
Потеря в весе при высушивании. (за счет гигроскопической влаги и летучих в-в) Точную навеску ЛП сушат при 100-105° до постоянного веса. Потеря в весе не должна превышать 6%.
Зола и тяжелые металлы. Зола (минеральный остаток) из 0,5 г препарата не должна превышать 5°/о и не должна давать реакции на тяжелые металлы (недопустимая примесь).
Дийодтирозин – белый/белый с сероват. оттенков кристаллич. порошок без з-ха, слегка горького вкуса, трудно растворим в воде. Содержит 55% органически связ-го йода. Образуется в ЩЖ при йодировании L-тирозина. Он тормозит выработку тиреотропного гормона, функция ЩЖ снижается. Синтез:
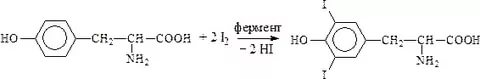
Подлинность и количественное: наверняка те же.
3. Гормоны мозгового слоя надпочечников (адреналин, норадреналин и их соли) – производные гидроксиалкиламинов. Допа. Метилдопа. Синтетические производные катехоламинов – изопреналина гидрохлорид (изадрин). Мезатон. Производные замещенных гидроксипропаноламинов (бета-адреноб-ры)- анаприлин, атенолол. Получение. Полный фармакоп-й анализ.
Адреналина гидротартрат (ГФ 10).
Получение адреналина: исходное в-во пирокатехин. Алкилируется по р-ции Фриделя-Крафтса. С хлорангидридом хлоруксусной кислоты в присутствии POCl3 или AlCl3 и последующим действием CH3NH2 превращается в адреналон, восстановлением которого получают адреналин:
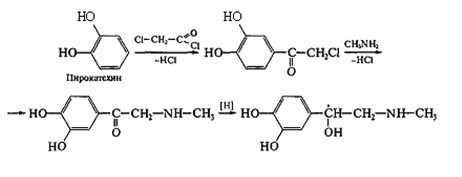
Подлинность (реакции для открытия адреналина и тартрата):
Реакции на адреналин:
1) Реакция с FeCl3 на пирокатехиновый фрагмент. Изумрудно-зел. После добавления аммиака вишнево-красное, затем оранж-красное (ГФ 10).

2) Реакция окисления также на пирокатехиновый фрагмент с р-ром I2 в буферных р-рах с разной pH. Образ-ся адренохром темно-красного цвета. Р-ция позволяет отличить адреналин от норадреналина (ГФ 10). Для удаления избытка йода добавляют тиосульфат.
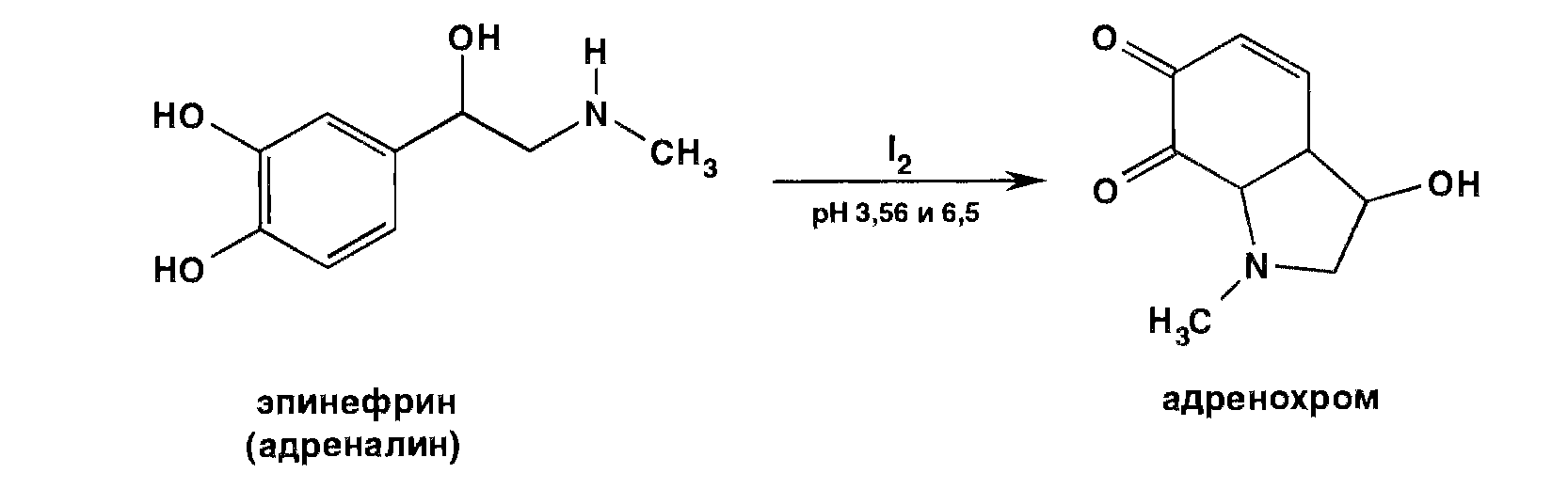
3) Реакция выделения основания адреналина с р-ром аммиака и измерения после этого его удельного вращения (ГФ 10):
Кроме того возможны реакции с общеалкалоидными реактивами, т.к. есть 3тичный N.
Реакции на тартраты:
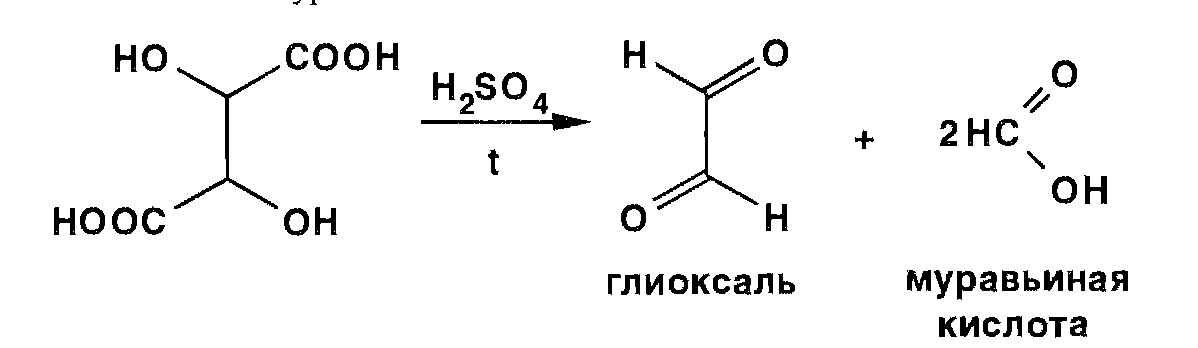
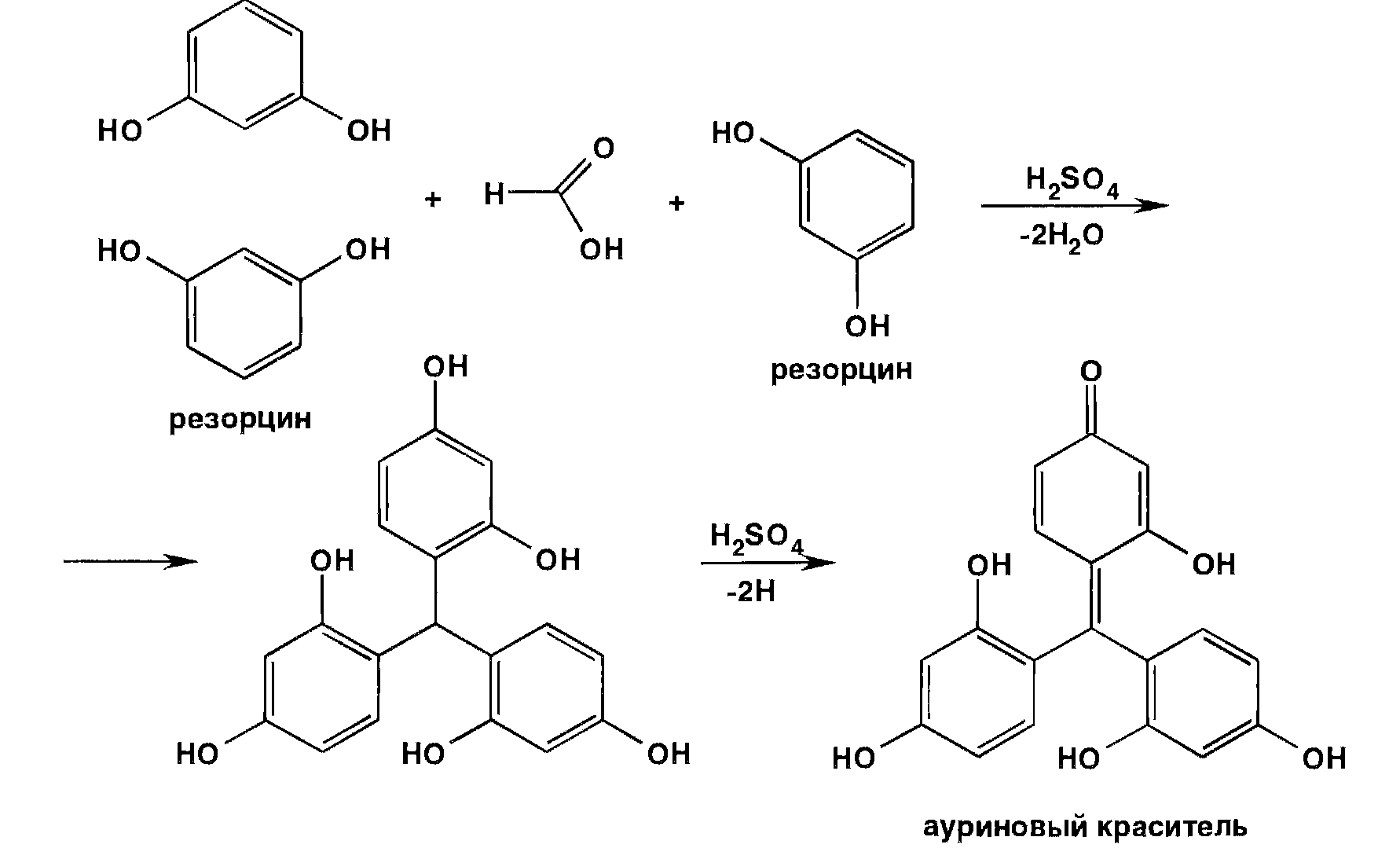
1) Нагревают с 1 мл серной к-ты конц-ной и неск-ми кристаллами резорцина; через 15 – 30 с появляется вишнево-красное окрашивание (ГФ 13).
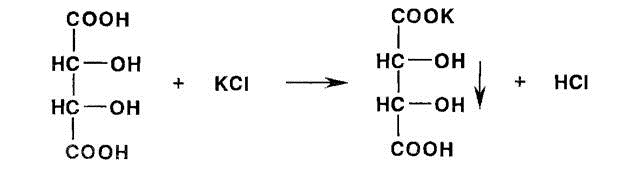
2) Реакция с KCl. Образуется белый осадок (ГФ 13).
3)
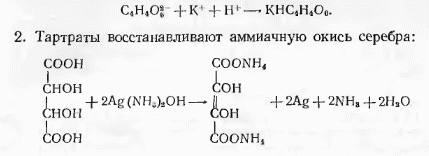
Количественное определение адреналина: КОТ в ледяной укс. к-те. Титрант – хлорная кислота. Кст = 1:1. титруют до голубовато-зеленого окрашивания (индикатор - метиловый фиолетовый).
Норадреналина гидротартрат (ГФ 10).
Получение: тоже из пирокатехина путем последовательного формилирования (добавляется H–C=O), цианирования –(OH)C–N=C, гидрирования–(OH)C–CH2–NH2.
Подлинность (реакции для открытия адреналина и тартрата):
Реакции на норадреналин:
1) Р-ция с FeCl3 Реагирует также как адреналин по фенольным гидроксилам. Эффект такой же (изумрудно-зел, после + р-ра NH3 вишнево красное, затем оранж-красное) (ГФ 10).
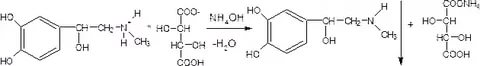
2) Отличительная р-ция от адреналина (ГФ 10):
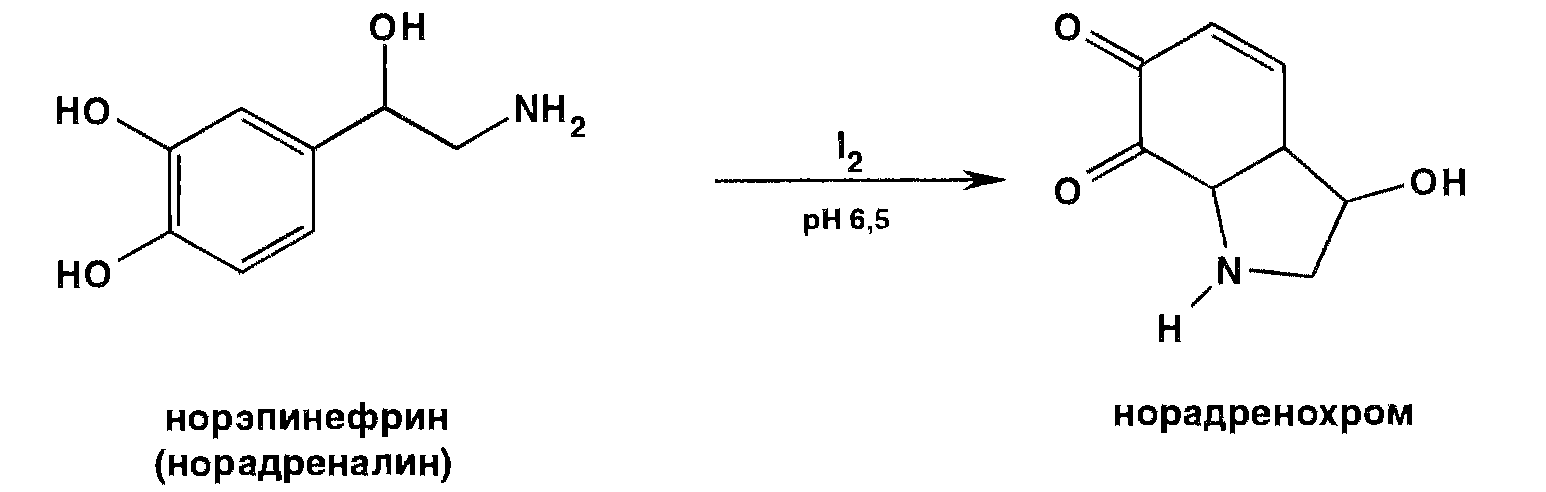
Реакции на тартрат аналогичные.
Количественное опр-ние: такое же как у адреналина. КОТ. Среда – лед. уксусная.
Изопреналина гидрохлорид (Изадрин) (нет в ГФ). – синтет. аналог катехоламинов.
Отличается от адреналина тем, что метильный радикал заменен на изопропильный.
Получение: тоже из пирокатехина.
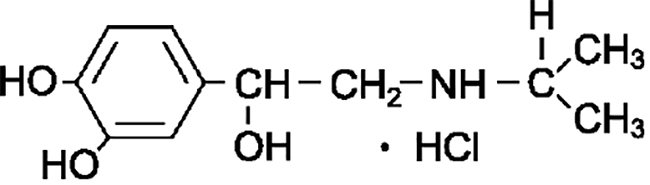
Подлинность (реакции на изадрин и на хлорид ион):
Реакции на изадрин:
1) Р-ция окисления. Изадрин окисляется легче, что связано с электронодонорным эффектом изопропильной гр-пы. Его окисление I2 проходит даже в HCI (среда кислая) где диссоциация фенол. гидроксилов подавлена (отличие от норадреналина). Образуется окрашенное соединения типа адренохрома- аминохром. рН = 1,0 – розовое, 3,56 – красное, 6,5 красно-фиол.
2) С р-ром CuSO4 в щел. среде обр-тся КС за счёт вторич-го спирт-го гидроксила и вторич. аминогруппы аналогичное эфедрину, но у изадрина желто-зелёного цвета.
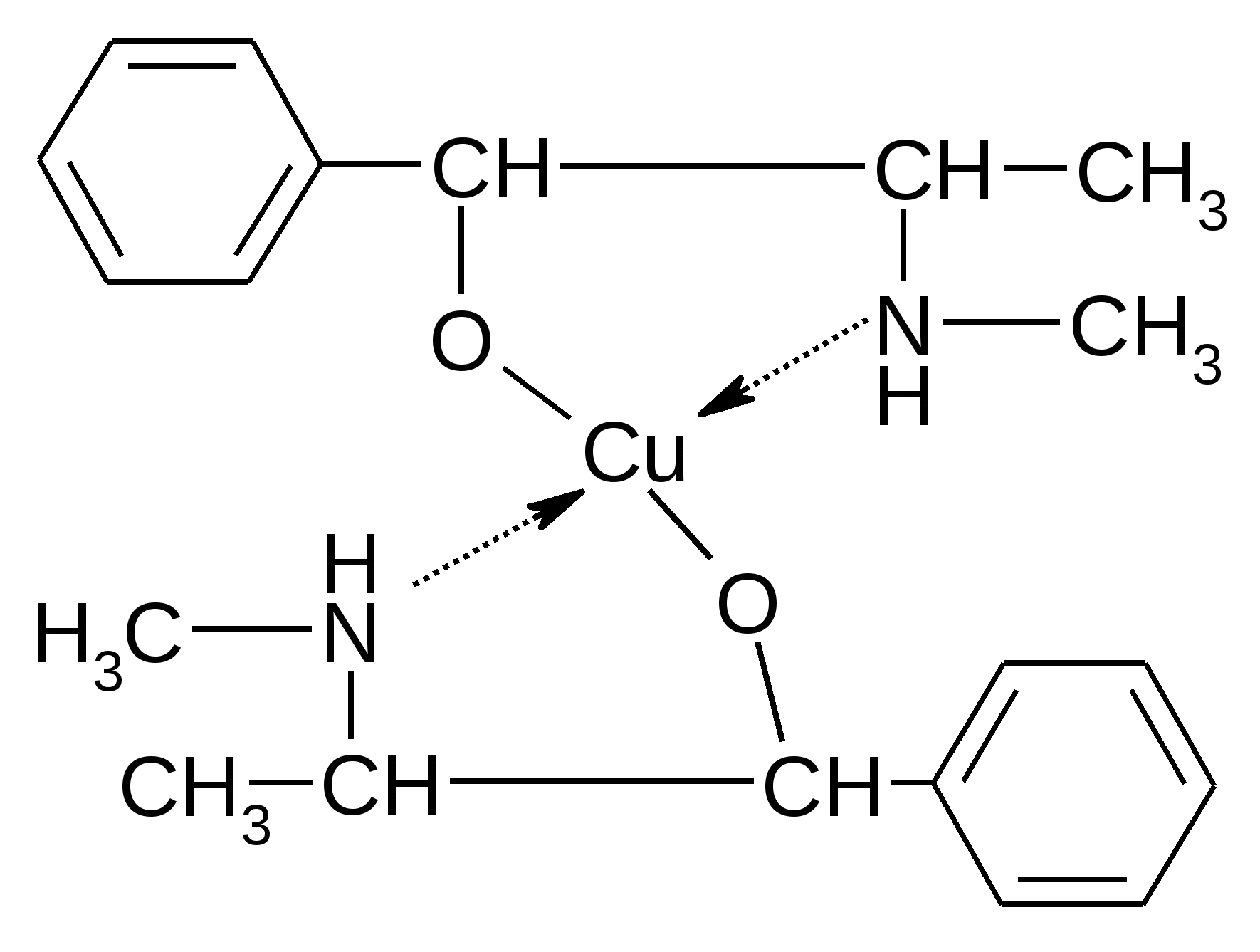
3) Аналогично КС с FeCl3. изумрудно-зеленое окр-ние. При добавлении р-ра NH3 изумрудно-зелёное окр-ние переходит в вишнёво-красное, затем оранж-красное.
4) Осадительные (общеалк-дные) р-ции за счёт вторич. алифатической аминогруппы.
Количественное: Неводное КОТ с хлорной к-той. Или аргентометрия Мора.(2AgNO3 + K2CrO4 → Ag2CrO4↓ + 2KNO3). * раств-мость осадка гораздо больше раств-мости AgCl. Поэтому при титровании р-ром AgNO3 в присутствии K2CrO4 красный осадок Ag2CrO4 появляется лишь после добавления избытка ионов Ag+, когда все Cl-ионы уже осаждены.
Леводопа. Метилдопа (нет ГФ). Сходны с адреналином и норадреналином.
Получение леводопы из тирозина или фенилаланина. Гидроксилируют и образуются фенольные гидроксилы у бензольного кольца. Метилдопу через соответствующий гидантоин.
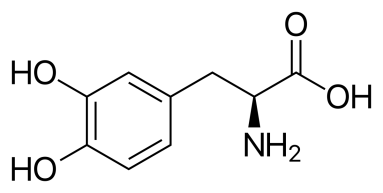 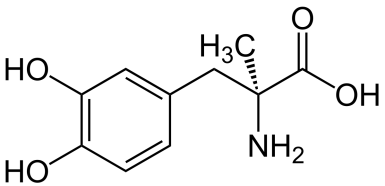
Проявляют свойства фенолов и алифатических α-АК.
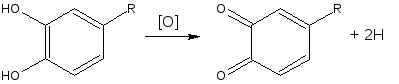
1) Реакции на пирокатехиновый фрагмент: С FeCl3 зеленые КС; окисления пирокатехинового ядра до о-хинона.
2) окисления АК с NaNO2 в кислой среде образуют желто-оранжевое окрашивание.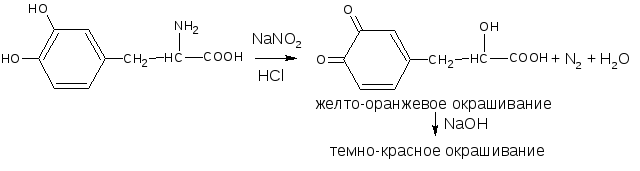
3) Нингидриновая проба на все АК (сине-фио).
4) Р-ция комплексо-я с солями меди (II) в щел. среде – аналогично алифатическим АК:
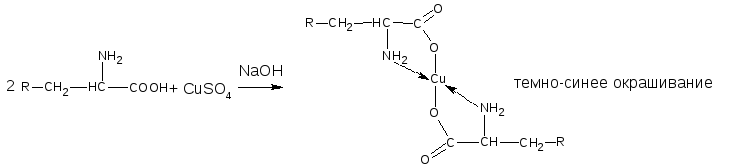
5) Р-ция отличия леводопы и метилдопы – реакция с 4-нитробензоил-хлоридом в среде пиридина. Леводопа: фио окрашивание, к-рое при кипячении переходит в бледно-желтое, а при добавлении карбоната натрия опять в фио. Метилдопа: оранжевое или янтарное окр-ние.
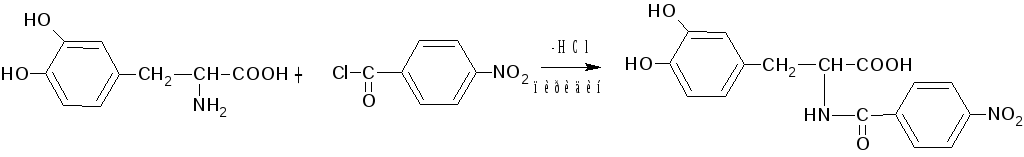
Количественное: КОТ (ацидиметрия) в среде неводного р-ля.
для леводопы - лед. уксусная кислота СН3СООН+НСООН безводн.; для метилдопы - лед. уксусная кислота СН3СООН+диоксан. Титрант - хлорная кислота, Индикатор - кристаллический фиолетовый.
|
|
|
 Скачать 1.77 Mb.
Скачать 1.77 Mb.