ФХ экз. Теоретические экз вопросы по фх
 Скачать 1.77 Mb. Скачать 1.77 Mb.
|
|
7. Андрогены и анаболики. Андрогенные гормоны как лекарственные средства: тестостерона пропионат, метилтестостерон. Связь между строением и биологическим действием. Биологические предпосылки получения полусинтетических ЛВ с анаболическим действием: метандростеналон, метиландролстендиол, феноболин. Требования к качеству ЛП, методы анализа. Фармакопейный анализ данной группы ЛВ. Применение: Тестостерон и его полусинтетические аналоги обладают способностью оказывать стимулирующее действие на синтез белков в организме (анаболический эффект). Анаболическое действие проявляют тестостерон, его эфиры, метилтестостерон. Однако у них этот эффект намного менее выражен, чем андрогенная активность. Строение и биодействие: Андрогенные гормоны вырабатываются мужскими половыми железами в период половой зрелости. В химическом отношении эти вещества являются производными андростана. Их также называют андростановыми стероидами. Гормоны класса стероидов представляют собой полициклические соединения липидной природы, в основе которых лежит циклопентанпергидрофенантреновое (стерановое) ядро, состоящее из конденсированных между собой трёх насыщенных шестичленных колец (A, B, C) и одного насыщенного пятичленного (D) кольца. 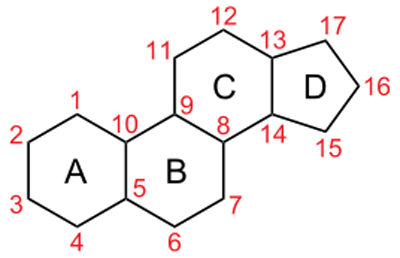 Главный андрогенный (мужской половой) гормон – тестостерон (андростен-4-ол-17-он-3) 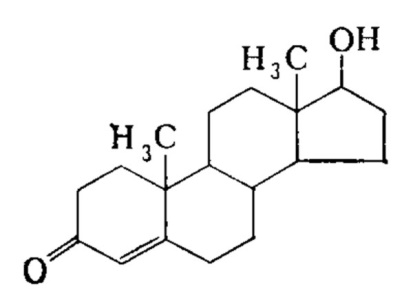 Андрогенная активность тестостерона определяется наличием 19 углеродных атомов в стерановом скелете, 3-кето-группой в кольце A и, прежде всего, гидроксилом у C17, расположенным в b-позиции (17a-группа биологически неактивна). Указанные структурные свойства необходимы для эффективного связывания андрогенов с соответствующими рецепторами. Сложные эфиры (тестостерона пропионат) гораздо медленнее высвобождаются в русло крови, т.к. они снижают возможность стероида растворяться в воде, и наоборот увеличивают его жирорастворимость. Присоединяясь к стероду, сложный эфир делает его неактивным, и таким образом, препятствует его связыванию с рецептором. Чтобы произошла его активация, фермент эстераза (фермент класса гидролаз; катализирует реакции расщепления эфирной связи) отщепляет сложный эфир и восстанавливает водород для формирования гидроксильной группы, присоединенной к С17. Как только молекула вновь конвертирована в тестостерон, она способна соединиться с рецептором (действие более локализовано). Метилтестостерон – модифицированная форма тестостерона. Он отличается добавлением метильной группы на углерод 17-альфа, что защищает гормон при пероральном применении. Что типично при алкилировании, полученный в результате стероид имеет сниженную анаболическую активность по сравнению с исходным тестостероном. Требования к качеству, методы анализа: Тестостерон-пропионат - белый или белый с кремовым оттенком кристаллический порошок нерастворим в воде. По ГФX определяется Т плавления, прозрачность и цветность раствора, кислотность, потеря в весе при высушивании (чистота препарата). Сульфатная зола из 0,5 г препарата не должна превышать 0,1%. Хранят с предосторожностью, в хорошо закупоренных банках, в сухом месте, защищенном от действия света. Метилтестостерон - белый или белый с кремовым оттенком кристаллический порошок, не растворим в воде. Определяют температуру плавления, удельный показатель. Чистоту препарата определяют по потере в весе (не более 1,5%) при высушивании до постоянного веса и отсутствии сульфатной золы (не более 0,1%). Хранят -//-. Фармакопейный анализ: Наиболее достоверно подлинность лекарственных веществ можно подтвердить рекомендуемым ФС и МФ методом ИК-спектроскопии. Хим реакции: 1) Идентификация по сложноэфирной группировке, используя реакцию омыления с последующим определением Т плавл. (150-156) - ГФ 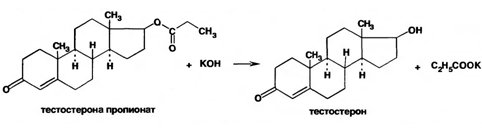 2) Тестостерона пропионат и метилтестостерон (в 3 положении кето-группа) при действии гидроксиламина образуют оксимы с температурой плавления соотвественно 166-171 и 210-216. – ГФ 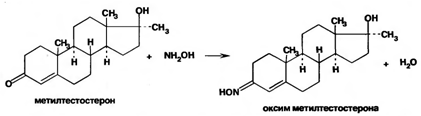 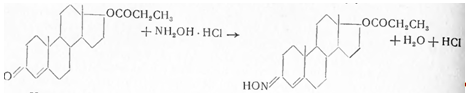 3) Тестостерон пропионат можно отличить реакцией образования окрашенной соли железа и пропионогидроксамовой кислоты – ГФ (красно-коричневое) 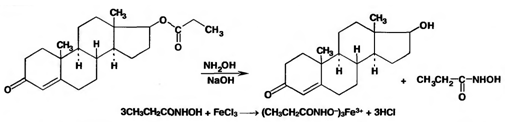 Количественное определение. Тестостерона пропионат Измеряют оптическую плотность раствора препарата в 95% спирте на спектрофотометре при длине волны. – ГФ Метилтестостерон в таб. В ГФX для субстанции нет, в таблетках предлагается спектрофотометрия Биологические предпосылки получения полусинтетических ЛВ с анаболическим действием: метандростеналон, метиландролстендиол, феноболин: Создание ЛП с более сильным и продолжительным анаболическим действием по сравнению с андрогенами. 8. Гестагены и их синтетические аналоги. Прогестерон, прегнин. Эстрогены. Этинилэстрадиол, метранол, эфиры эстрадиола. Синтетические аналоги эстрагенов нестероидной структуры: синестрол, диэтилсильбестрол. Фармакопейный анализ ЛП данной группы. Гестагены:прогестерон, прегнин. 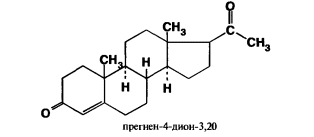 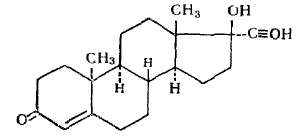 Прогестерон прегнин Полинность по гф: ЛП прогестерона с концентрированной серной кислоты появляется желтое окрашивание с зеленой флюоресценцией. А прегнина с серной малиноваяокраска с зеленой флюоресценция. Раствор охлаждают, прибавляют 3 мл хлороформа и встряхивают; оба слоя бесцветные.-доказательство стероидного цикла. НЕТ РЕАКЦИИ. ПРЕГНИН 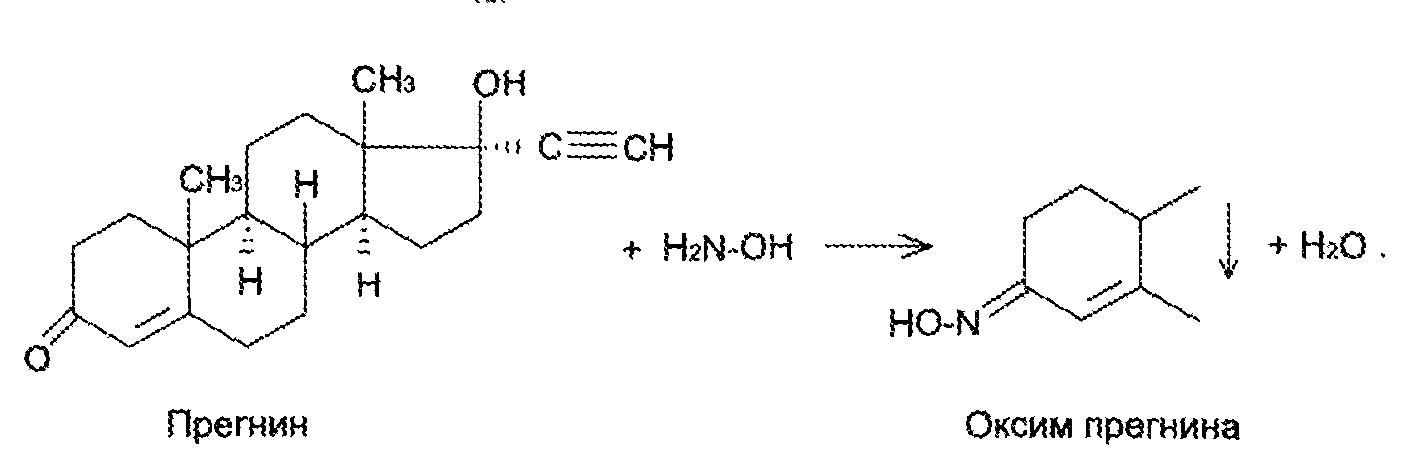 Тпла 226-232 Тпла 226-232Прегнин содержит остаток ацетилена, следовательно проявляет кислотные свойства и с нитратом серебра образует белый осадок. 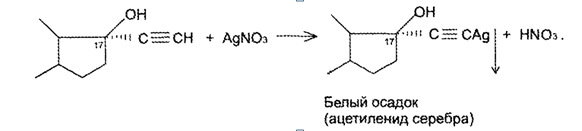 Прогетсерон Температура разложения 2,4-динитрофенилгидразона, полученного при количественном определении, 270-275°.2-3 мг препарата растворяют в 1 мл 95% спирта, прибавляют 1 мл 1% раствора м-динитробензола в 95% спирте и 1 мл раствора едкого натра; появляется розовое окрашивание, постепенно переходящее в красно-коричневое.(одно реакция для Тплав и окрашивания) 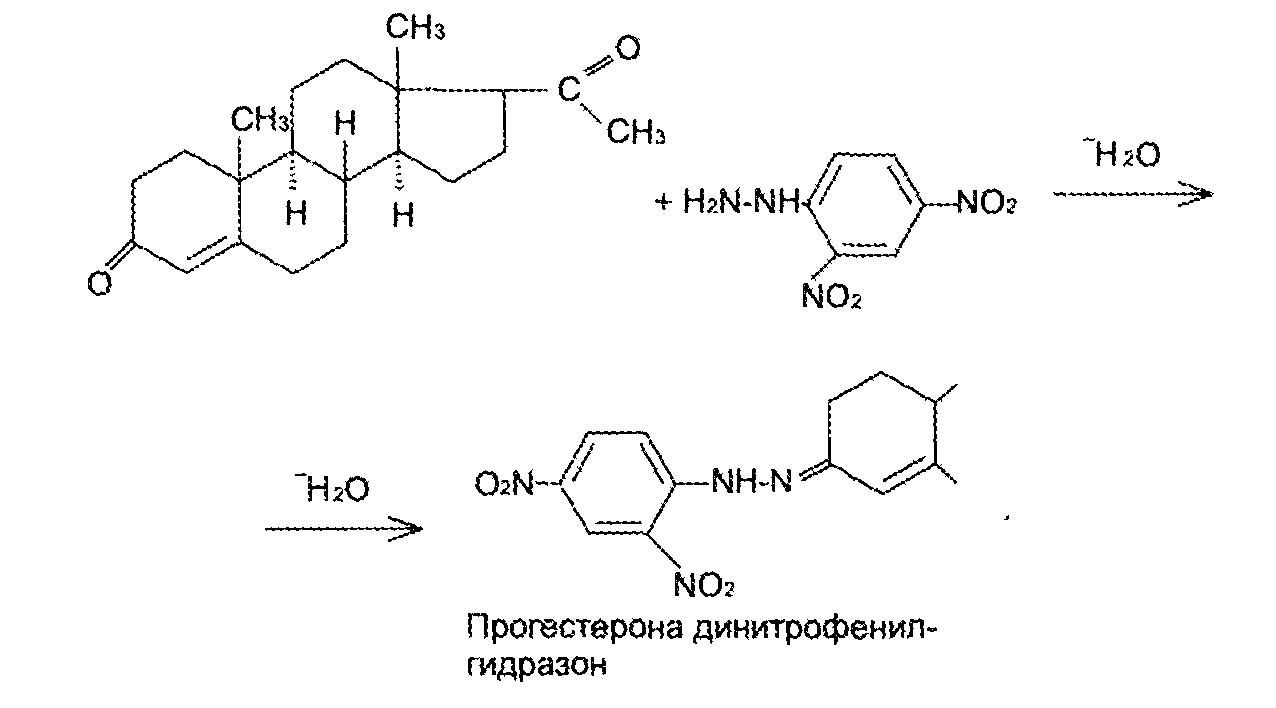 Прогестерон содержит ацетильный фрагмент, при нагревании с йодом в щелочной среде образуется желтый осадок с хар-ным запахом-йодоформ(СHI3 ) 4I2 + 6NaOH+ CH3CH2OH = HCOONa+NaI+ СHI3+H2O КОЛ-НОЕ ОПРЕДЕЛЕНИЕ Косвенная нейтрализация - прегнин 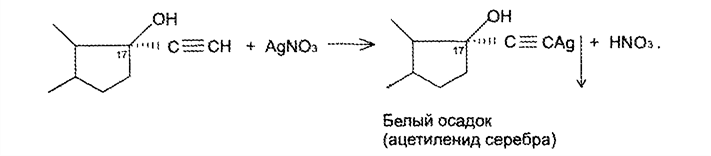 HNO3+NaOH=NaNO3+H2O В табл и порошке прегнин спектрофотометрически при длине волны 241 нм(по отношению к 0,001% раствору стандартного образца прегнина Гравиметрия Образование 2,4-динитрофенилгидразона- гравиметрия 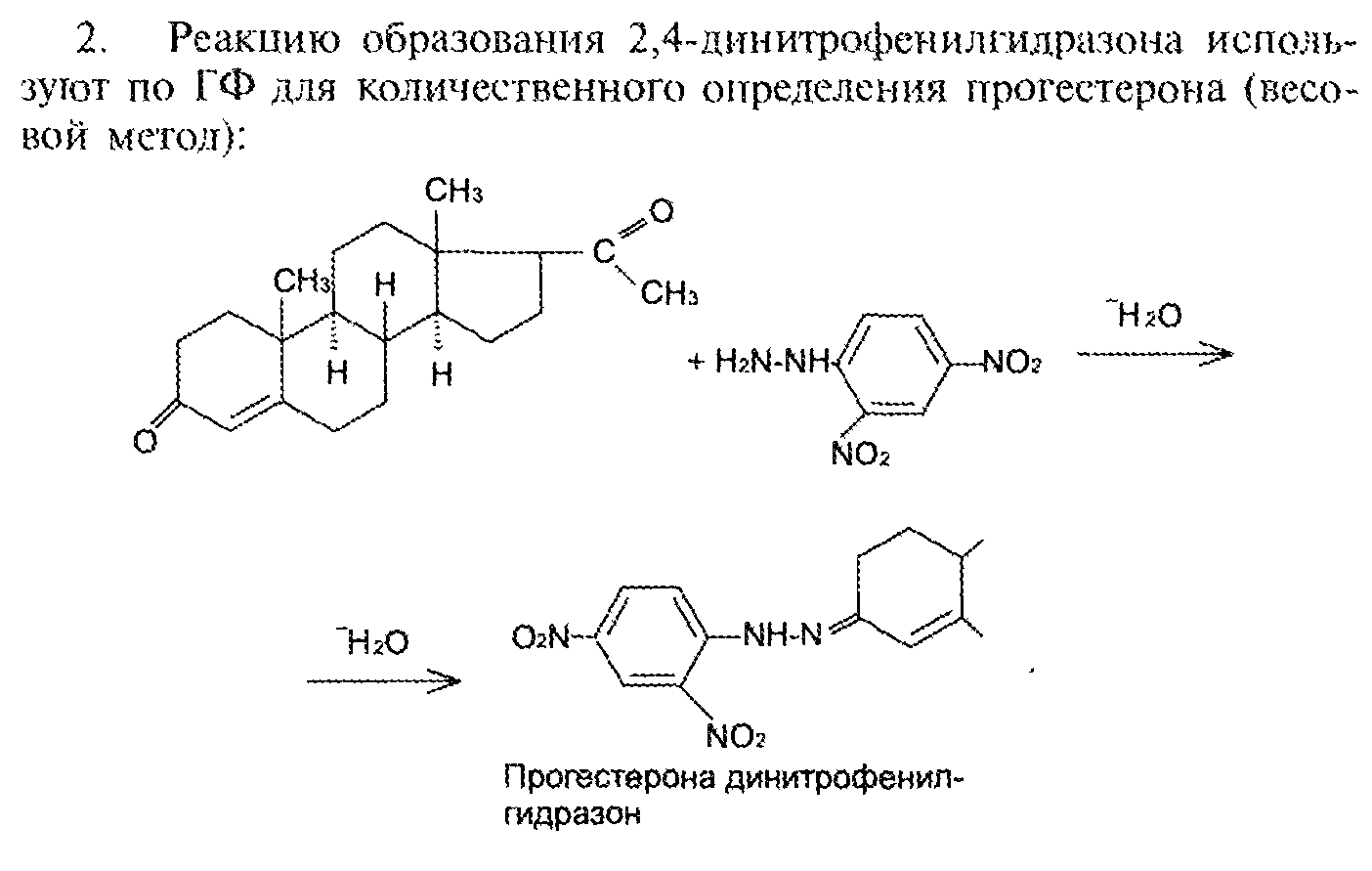 Эстрогены. Этинилэстрадиол, метранол, эфиры эстрадиола. 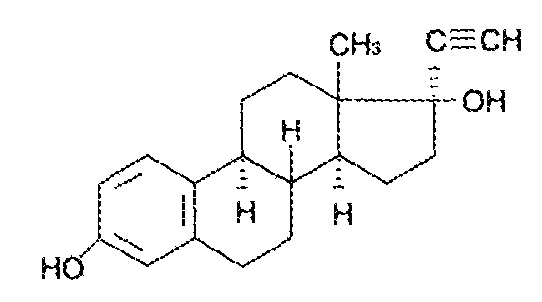 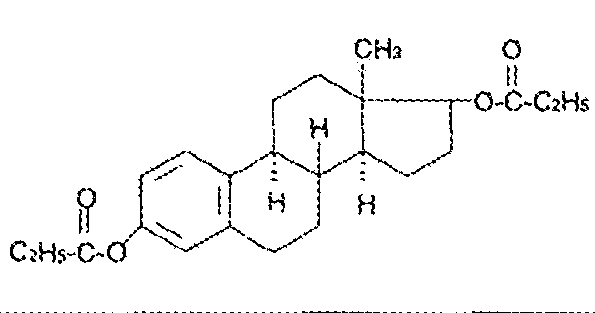 Этинилэстрадиол эстрадиола дипропиона местранол Подлинность: Стероидный цикл-этинилэстрадиол с серной оранжево-краное окраш с желтовато-зеленой флюоресценцией; Местранол с серной кроваво-красное с желтовато-зеленой флюоресценцией. Эстрадиола дипропионат с серной гидролизуется до пропионовой к-ты, кот при взаимодействии с этанолом образует этиловый эфир пропионовой к-ты с хар-ным запахом.+ определяют Тпла эстрадиола=173-179 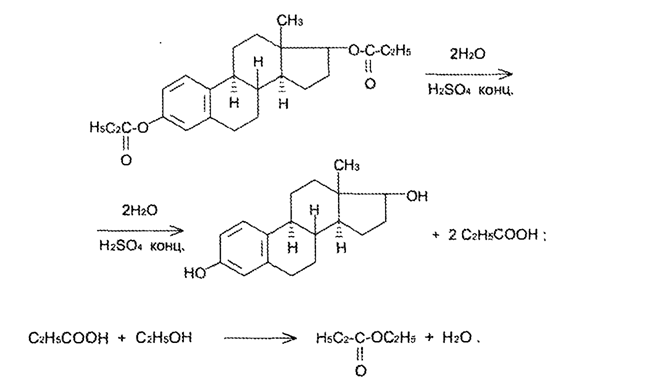 За счет фенольного гидроксила реакции: Бромирование в 2 орта положения. Азосочетания с солью диазония 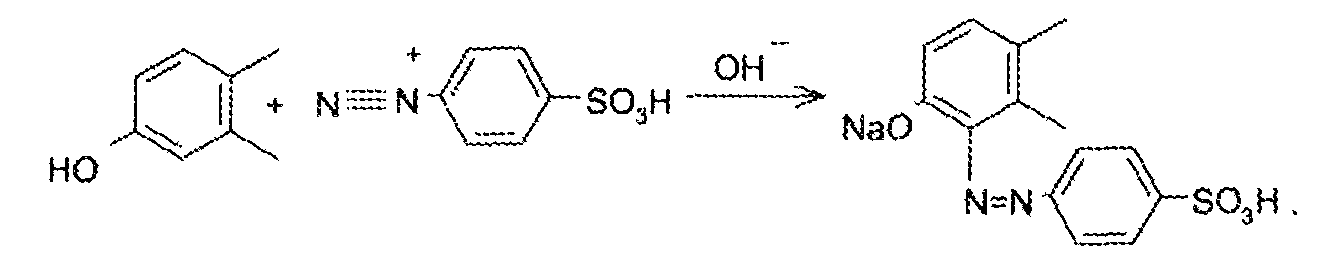 Комплексообразование с хлоридм железа3 Образование сложных эфиров у кот определяют Тплав 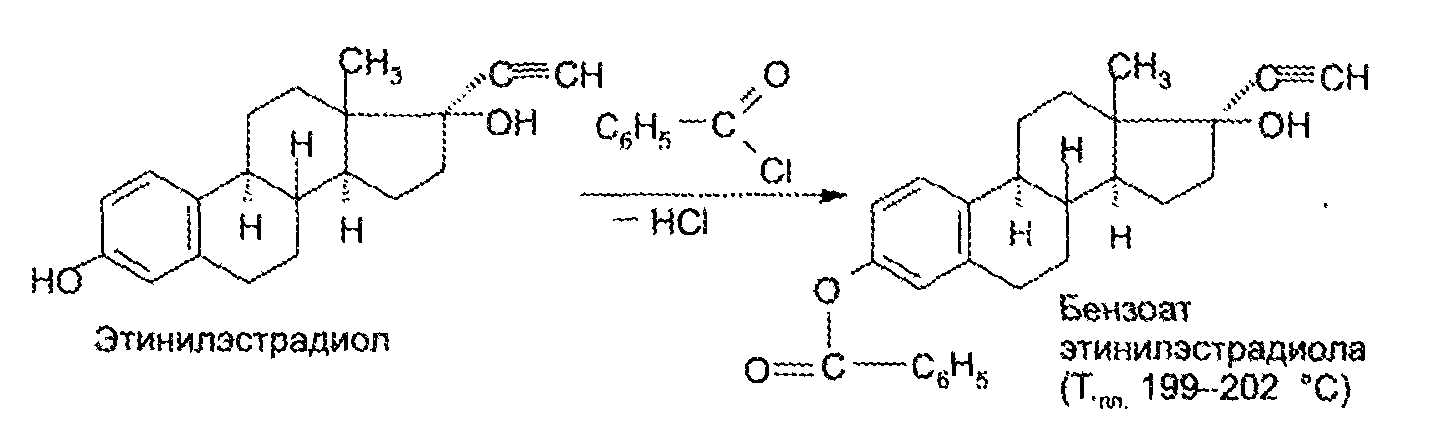 Для местрнола и этинилэстрадиола взаимодействие с нитратом серебра так как содержит остаток этилена 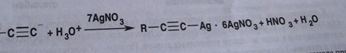 Кол-ное определение Фотоколориметрия этинилэстрадиола (окрашенное бис-азосоединение) 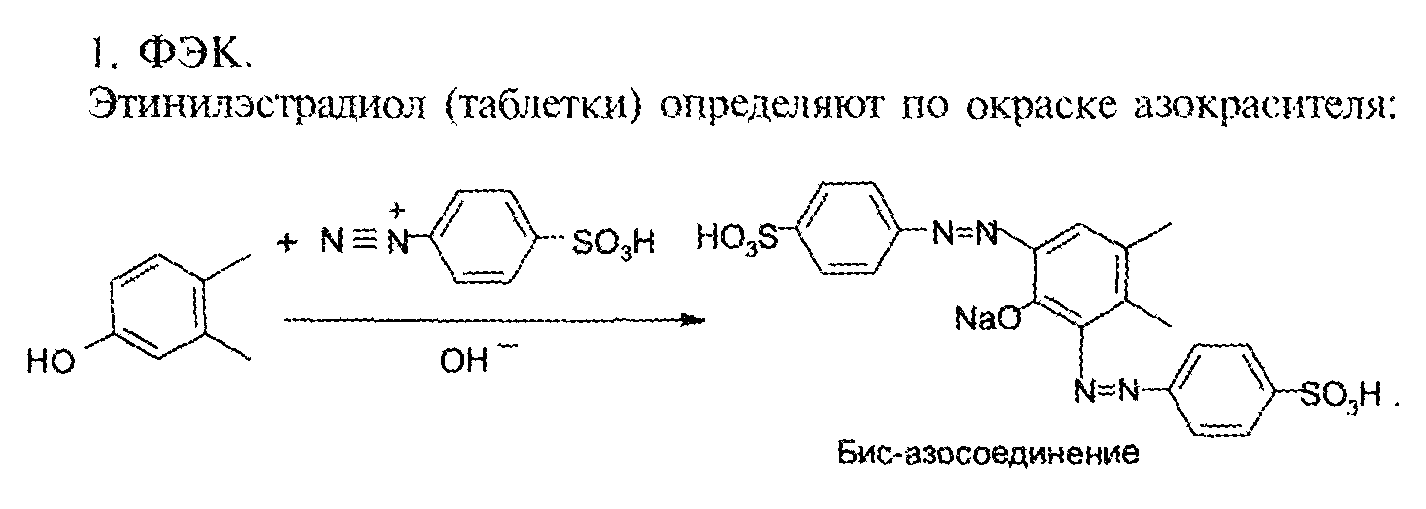 Обратная ацидиметрия: эстрадиол дипропионат с збытром гидроксида каля(гидролз), избыток гидроксида оттитровывают солянкой. Индикатор фенолфталеин. 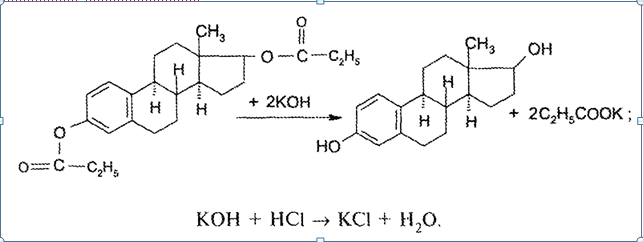 Синтетические аналоги эстрагенов нестероидной структуры: синестрол, диэтилсильбестрол. 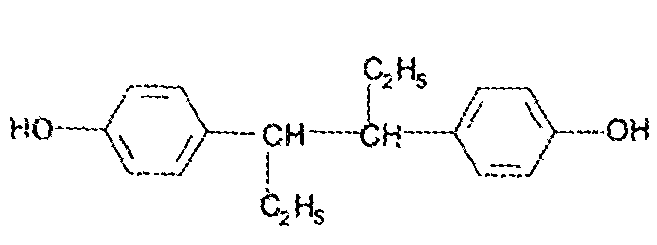 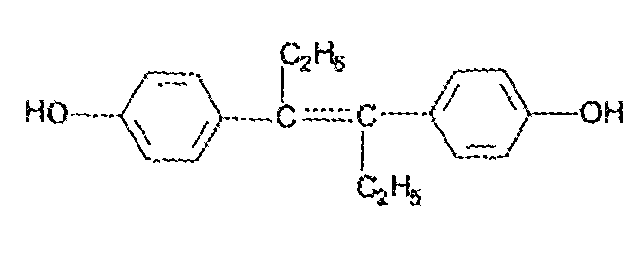 Синестрол диэтилсильбестрол Подлинность: Синестрол с серной в присутствии формалина, хлороформный слой вищнево-красный. Диэтилсильбестрол с серной ярко-оранжевое. Синестрол с бромной водой осадок желтого цвета в растворе ледяной уксусной к-те. 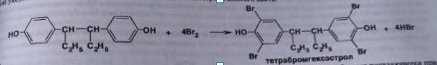 Диэтилсильбестрол с бромной водой в растворе фенола при нагревании изумрудно-зеленое.+ с хлоридом железа 3 спиртовой раствор ЛП окрашивается в зеленый цвет. Синестрол нитрование (азотка и нагревание на водяной бане)-желтое окрашивание 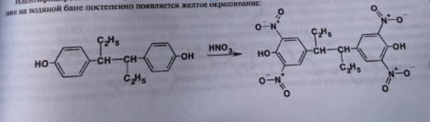 Реакция этерификации с уксусным ангидридом, и определяют Тплав диацетатов. 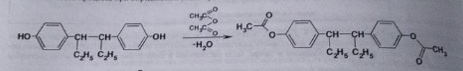 Азосочетания реакция 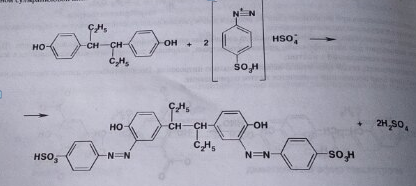 КОЛ_НОЕ ОПРЕДЕЛЕНИЕ ЛП(синэстрол или диэтилстильбэстрол) нагревают с точно отмеренным кол-вом уксусного ангидрида, избыток уксусного ангидрида, превратившийся в уксусную кис-ту оттитровывают гидроксидом натрия. 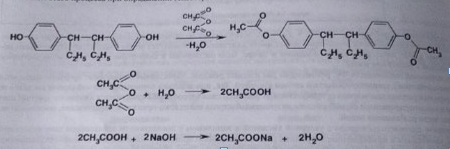 Синэстрол бромид-броматометрически. 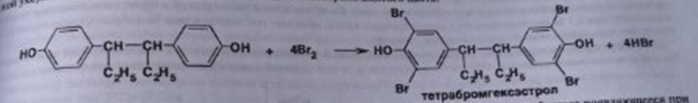 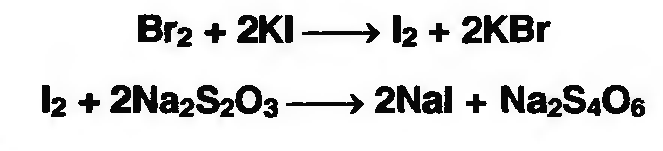 ЛП(синэстрол или диэтилстильбэстрол) фотометрический по реакции азосочетания. 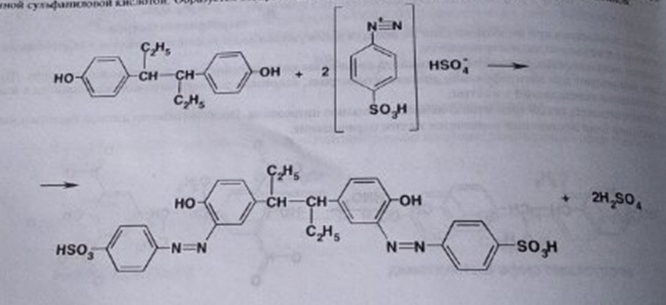 9. Государственные принципы и положения, регламентирующие качество лекарственных средств. Это различные документы в области стандартизации, федеральные законы. -ФЗ №61 «Об обращении», ФЗ №3 «О НСиПВ» -Надлежащая производственная практика -ГФ, ОФС и ФС В Законе «О лекарственных средствах» определены структура государственной системы контроля качества, эффективности и безопасности ЛС, порядок проведения исследований в области разработки ЛС, их производства и изготовления, регулирования отношений в сфере обращения ЛС, государственной регистрации. Указанные положения федерального закона имеют непосредственное отношение к профессиональной деятельности провизора, занимающегося контролем качества ЛС. Отражена информация о государственной регистрации ЛС, проведении клинических испытаний, производства, ввоз и вывоз, осуществление фармдеятельности, уничтожение ЛС, гос. регулирование цен, мониторинг эффективности и безопасности. Сертификация ЛС представляет собой процесс компетентного и авторитетного подтверждения соответствия качества ЛС требованиям НД, осуществленного специально аккредитованными органами. Сертификация ЛС состоит из двух взаимосвязанных частей: сертификации соответствия производства и сертификации соответствия ЛС. Сертификация производства ЛС — подтверждение компетентным органом, прошедшим аккредитацию, соответствия производства ЛС предъявляемым требованиям, которые содержатся в российских и международных «Правилах организации производства ЛС», фармакопеях, стандартах. Если производство ЛС соответствует установленным требованиям, выдается документ—сертификат производства ЛС. Сертификация соответствия ЛС — подтверждение компетентным органом, прошедшим аккредитацию, соответствия ЛС требованиям НД, утвержденным в установленном порядке. Документ, удостоверяющий прохождение сертификации, — сертификат соответствия ЛС. Стандартизация – деятельность по разработке (ведению), утверждению, изменению (актуализации), отмене, опубликованию и применению документов по стандартизации и иная деятельность, направленная на достижение упорядоченности в отношении объектов стандартизации. Правовое регулирование отношений в сфере стандартизации осуществляется 162-ФЗ «О стандартизации в Российской Федерации». Применение документов по стандартизации для целей технического регулирования регламентировано184-ФЗ «О техническом регулировании». Значительная роль в международных правилах обеспечения качества, эффективности и безопасности лекарственных средств отводится системе GXP, которая представляет собой свод правил добротной практики, включающий следующие элементы: GLP (good laboratory practice) – надлежащая лабораторная практика, целью которой является получение надежной воспроизводимой информации об эффективности и безопас- ности создаваемых лекарств на экспериментальных моделях; GCР (good clinical practice) – надлежащая клиническая практика, соблюдение кото- рой необходимо при клинический испытаниях новых ЛС и технологий их использования, проводимых с целью характеристики эффективности и безопасности изучаемых фармаколо- гических средств в клинике человека, выявления преимуществ этих средств и рекомендации их для промышленного производства; GМР (good manufacturing practice) – надлежащая производственная практика, обес- печивающая получение фармацевтических субстанций и лекарственных препаратов, соот- ветствующих всем показателям качества, предусмотренным нормативно-технической доку- ментацией на эту продукцию; GDP (good distribution practice) – правила добротной дистрибьюции, цель которых – обеспечить продвижение выпускаемых фармацевтических товаров к их институциональным, оптовым и промежуточным потребителям; GРР (good pharmacy practice) – правила надлежащей аптечной практики. Их цель – организация обеспечения населения (покупателей), амбулаторных и стационарных больных всеми товарами аптечного ассортимента и оказания научно-консультативной помощи по вы- бору, использованию ЛС в различных клинических ситуациях и др. Стандартизация ЛС заключается в разработке и использовании единых норм, правил, требований при поиске, создании, внедрении в промышленное производство и медицинскую практику лекарственных, профилактических, диагностических средств и медицинских иммунобиологических препаратов. Результаты стандартизации лекарственных средств находят свое отражение в специальных нормативных документах – фармакопейных статьях. Различают общие фармакопейные статьи и фармакопейные статьи. Общая фармакопейная статья (ОФС) – документ, содержащий перечень показате- лей качества и (или) методов контроля качества конкретной лекарственной формы, лекар- ственного растительного сырья, описания биологических, биохимических, микробиологиче- ских, физико-химических, физических, химических и других методов анализа лекарственно- го средства, а также требования к используемым в целях проведения данного анализа реак- тивам, титрованным растворам, индикаторам. Фармакопейная статья (ФС) – документ, содержащий перечень показателей каче- ства и методов контроля качества лекарственного средства. Сводом ОФС и ФС является Государственная фармакопея. В настоящее время на территории РФ действуют фармакопеи XII и XIII и 14 издания. Порядок разработки ОФС и ФС и включения их в государственную фармакопею, а также размещения на официальном сайте в сети Интернет данных Государственной фармакопеи утверждён приказом Минздравсоцра вития России № 756н. Нормативная документация (НД) – документ, содержащий перечень определяемых по результатам соответствующих экспертиз показателей качества лекарственного средства, методов контроля его качества и установленный его производителем. НД учитывают конкретную технологию данного предприятия, что позволяет использовать НД для более детального контроля качества ЛС Эти правила GMP распространяются на все виды ЛС и содержат общие требования к: - организации производства и контроля качества лекарственных средств; - фармацевтическим субстанциям, используемым в качестве исходного сырья. Кроме того, Правила содержат специальные требования к производству: стерильных лекарственных средств биологических (в том числе иммунобиологических) фармацевтических субстанций и лекарственных препаратов радиофармацевтических лекарственных средств лекарственных средств для ветеринарного применения медицинских газов лекарственных растительных препаратов Основные требования правил GMP: все производственные процессы должны быть регламентированы, должны систематически пересматриваться с учетом накопленного опыта, а также должна подтверждаться их способность обеспечивать постоянное производство ЛС требуемого качества в соответствии со спецификациями; критические стадии производственного процесса и существенные изменения процесса должны пройти валидацию (Валидация – документально оформленные действия, дающие высокую степень уверенности в том, что методика, процесс, оборудование, материал, операция или система соответствуют заданным требованиям и их использование будет постоянно приводить к результатам, соответствующим заранее установленным критериям приемлемости); должны быть обеспечены необходимые условия для выполнения требований Правил, включая наличие: - надлежащим образом обученного персонала, имеющего необходимую квалификацию; - соответствующих помещений и площадей; - соответствующих оборудования и обслуживания; - соответствующих исходного сырья и упаковочных материалов; - утвержденных процедур и инструкций в соответствии с фармацевтической системой качества; - соответствующих условий хранения и транспортировки; инструкции и процедуры должны быть конкретными, изложены в письменной форме ясно и однозначно; персонал должен быть обучен надлежащему выполнению процедур; в процессе производства должны составляться записи (рукописным способом и (или) с применением технических средств), документально подтверждающие фактическое проведение этапов, требуемых установленными методиками и инструкциями, а также то, что количество и качество продукции соответствуют установленным нормам; отклонения должны быть оформлены документально и расследованы с целью определения причины отклонения и осуществления соответствующих корректирующих и предупреждающих действий; досье на серию, включая документацию по реализации, должно позволять отслеживать полную историю производства серии, составляться в понятной форме и храниться в доступной форме; при реализации лекарственных средств необходимо свести к минимуму все риски для их качества и учитывать правила оптовой торговли лекарственными средствами для медицинского применения; должна быть организована система отзыва любой серии лекарственных средств из обращения; должны рассматриваться претензии в отношении качества реализованных лекарственных средств, расследоваться причины дефектов и приниматься соответствующие меры как в отношении лекарственных средств ненадлежащего качества, так и для предотвращения подобных случаев. Выполнение требований правил GMP и осуществление управления рисками для качества являются элементами фармацевтической системы качества. Производитель должен документально оформить фармацевтическую систему качества и контролировать ее эффективность. Ответственным персоналом являются: - руководитель производства; - руководитель подразделения контроля качества; - уполномоченное лицо – работник производителя ЛС, имеющий высшее фармацевтическое, химическое или биологическое образование, стаж работы не менее чем пять лет в области производства и контроля качества ЛС и аттестованный в порядке, установленном уполномоченным федеральным органом исполнительной власти. Документация может существовать в различных формах, в том числе на бумажном, электронном или ином носителе. Главной целью применяемой системы документации является создание, управление, контроль и регистрация всей деятельности, которая может непосредственно или опосредованно влиять на все аспекты качества ЛС. Существуют два основных вида документации: - регламентирующая документация, необходимая для выполнения требований правил GMP (спецификации, промышленные регламенты, инструкции, протоколы, договоры); - регистрирующая документация, предназначенная для регистрации соблюдения требований правил GMP (записи, паспорта, аналитические листки, отчеты). |
